Содержание
- 2. Цель и задачи Определить количество этилендиамина, содержащееся в образцах соединения [Gd(en)x][Fe(CN)6] Отработка методики индикаторного кислотно-основного титрования
- 3. Комплексные соли Комплексные соли – продукты сочетания солей металлов с почти недиссоциированным на составные части органическими
- 4. Аммиак и амины. Неподеленная электронная пара аммиака позволяет во многих реакциях выступать в качестве основания или
- 5. Этилендиамин. Жидкость без цвета с запахом аммиака, дымит на воздухе, хорошо растворяется в воде с разогреванием
- 6. Кислот-основное титрование. Основной является реакция нейтрализации между кислотой и основанием с образованием воды. Титрование раствором щелочи
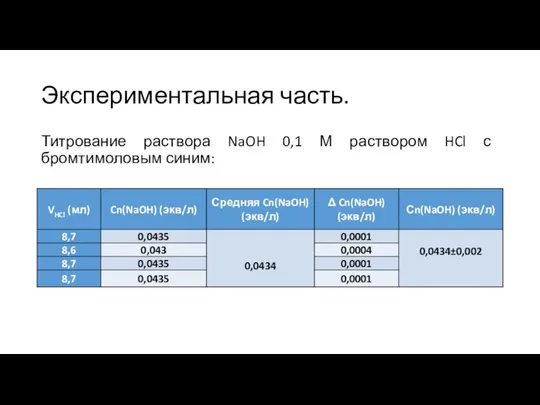
- 7. Экспериментальная часть. Титрование раствора NaOH 0,1 М раствором HCl с бромтимоловым синим:
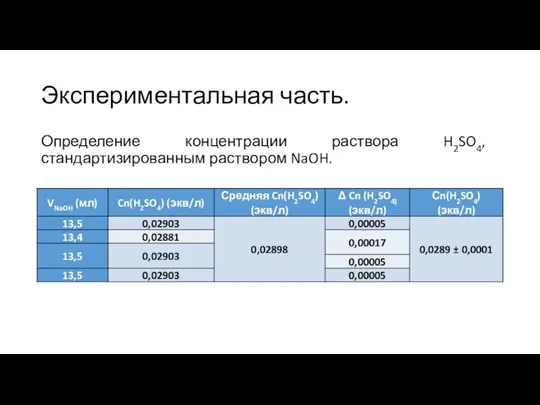
- 8. Экспериментальная часть. Определение концентрации раствора H2SO4, стандартизированным раствором NaOH.
- 9. Экспериментальная часть. Титрование образцов серной кислотой На массу образца [Gd(en)x][Fe(CN)6] массой 87,5 мг для оттитровки потребовалось
- 10. Результат.
- 12. Скачать презентацию
![Цель и задачи Определить количество этилендиамина, содержащееся в образцах соединения [Gd(en)x][Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1374905/slide-1.jpg)




![Экспериментальная часть. Титрование образцов серной кислотой На массу образца [Gd(en)x][Fe(CN)6] массой](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1374905/slide-8.jpg)

 Культуральные свойства микроорганизмов. Антибиотики. Методы определения антибиотикорезистентности бактерий
Культуральные свойства микроорганизмов. Антибиотики. Методы определения антибиотикорезистентности бактерий Природные источники углеводородов
Природные источники углеводородов Алканы
Алканы Модифицирование структуры полисахаридов гидрофобными заместителями: твердофазный синтез, исследование структуры и свойств
Модифицирование структуры полисахаридов гидрофобными заместителями: твердофазный синтез, исследование структуры и свойств Химический элемент сера
Химический элемент сера Презентация на тему «Биография Д.И. Менделеева» Работа Ученицы 9 – «А» класса СОШ № 1 Давыдовой Полины Под руководством Конд
Презентация на тему «Биография Д.И. Менделеева» Работа Ученицы 9 – «А» класса СОШ № 1 Давыдовой Полины Под руководством Конд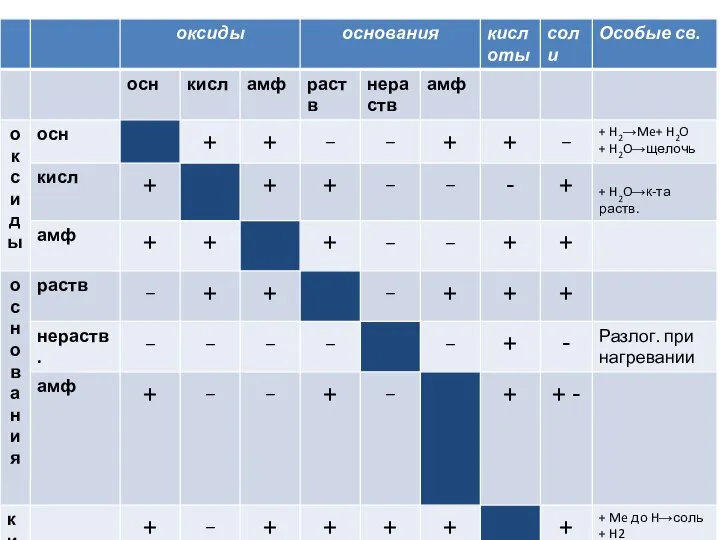 Оксиды, основания, кислоты
Оксиды, основания, кислоты Презентация по Химии "Консерви: користь та шкода" - скачать смотреть бесплатно
Презентация по Химии "Консерви: користь та шкода" - скачать смотреть бесплатно Железо, медь
Железо, медь Виды присадок к моторным топливам. Керосин
Виды присадок к моторным топливам. Керосин 27 февраля 2013
27 февраля 2013 Презентация по Химии "Вплив побутової хімії на здоров'я людини" - скачать смотреть бесплатно
Презентация по Химии "Вплив побутової хімії на здоров'я людини" - скачать смотреть бесплатно Дисперсные
Дисперсные  Строение, свойства и многообразие функций белков
Строение, свойства и многообразие функций белков Титриметрический анализ
Титриметрический анализ Феромагнетики До феромагнетики (ferrum - залізо) належать речовини, магнітна сприйнятливість яких позитивна і досягає значень. Н
Феромагнетики До феромагнетики (ferrum - залізо) належать речовини, магнітна сприйнятливість яких позитивна і досягає значень. Н Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Эндогенная серия. Карбонатитовая группа
Эндогенная серия. Карбонатитовая группа Презентация по Химии "РАЗРАБОТКИ УЛЬТРАДИСПЕРСНЫХ (НАНО-) МАТЕРИАЛОВ И НАНОТЕХНОЛОГИЙ В АТОМНОЙ ОТРАСЛИ" - скачать смотреть б
Презентация по Химии "РАЗРАБОТКИ УЛЬТРАДИСПЕРСНЫХ (НАНО-) МАТЕРИАЛОВ И НАНОТЕХНОЛОГИЙ В АТОМНОЙ ОТРАСЛИ" - скачать смотреть б Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Геохимия метасоматтческого процесса. (Лекция 7)
Геохимия метасоматтческого процесса. (Лекция 7) Номенклатура алканов
Номенклатура алканов алгоритм
алгоритм Контрольная работа по химическим реакциям
Контрольная работа по химическим реакциям Упражнения по теме «скорость химической реакции»
Упражнения по теме «скорость химической реакции» Химическая связь
Химическая связь Alkynes
Alkynes №10 зертханалық жұмыс Сірке қышқылы, қасиеттері, алу жолдары
№10 зертханалық жұмыс Сірке қышқылы, қасиеттері, алу жолдары