Содержание
- 2. Элементы главных подгрупп I и II групп — s-элементы S-элементы — это элементы, у которых заполняются
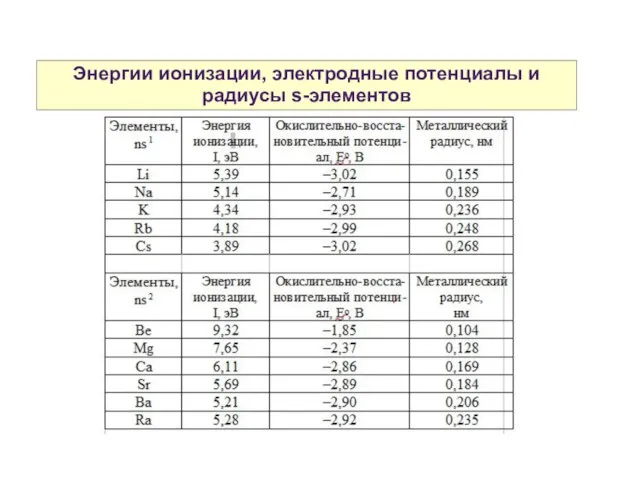
- 3. Энергии ионизации, электродные потенциалы и радиусы s-элементов
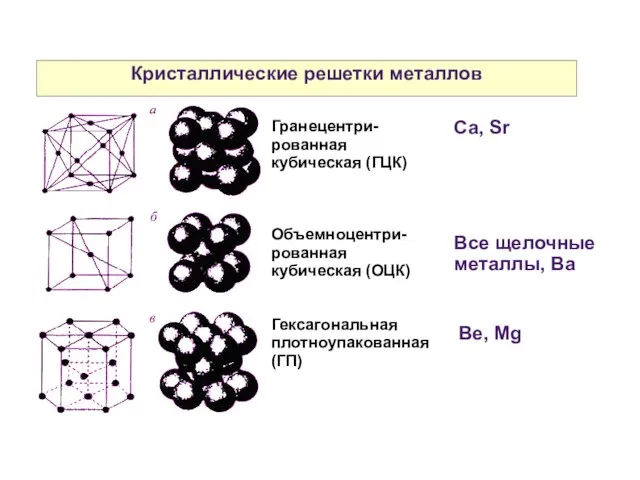
- 4. Кристаллические решетки металлов Гранецентри-рованная кубическая (ГЦК) Объемноцентри-рованная кубическая (ОЦК) Гексагональная плотноупакованная (ГП) Все щелочные металлы, Ba
- 5. Щелочные металлы — простые вещества Литий tºплав = 181°C ρ = 0,53 г/см3 Натрий tºплав =
- 6. Щелочноземельные металлы — простые вещества Бериллий tºплав = 1278°C Ρ = 1,85 г/см3 Магний tºплав =
- 7. Химические свойства s-металлов 1. На свежем разрезе поверхность блестящая, при нахождении а воздухе быстро тускнеет. 2.
- 8. Химические свойства s-металлов 6. Щелочные металлы с водой образуют щелочи и вытесняют из воды H2: Li
- 9. Химические свойства s-металлов 8. Реакционная способность щелочноземельных металлов уменьшается снизу вверх: Ba, Sr и Ca активно
- 10. Распространенность в природе s-металлов В природе встречаются исключительно в виде соединений! Галит NaCl Сильвинит КCl Сподумен
- 11. Распространенность в природе s-металлов Рубидий и цезий — рассеянные элементы, не образуют самостоятельных минералов, а входят
- 12. Распространенность в природе s-металлов Бериллий → бериллы: изумруд, аквамарин, морганит, гелиодор и др... Изумруд Be3Al2Si6O18 Гелиодор
- 13. Распространенность в природе s-металлов Целестин SrSO4 Барит ВaSO4 Стронцианит SrCO3 Витерит ВaСO3
- 14. Распространенность в природе s-металлов Mg2+ Ca2+ Na+ K+ и другие...
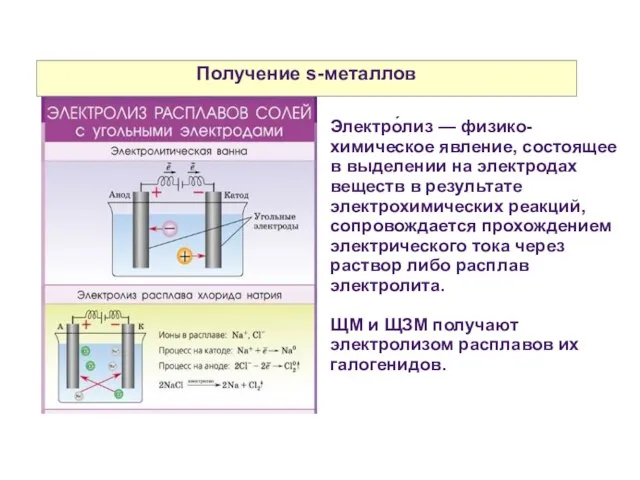
- 15. Получение s-металлов Электро́лиз — физико-химическое явление, состоящее в выделении на электродах веществ в результате электрохимических реакций,
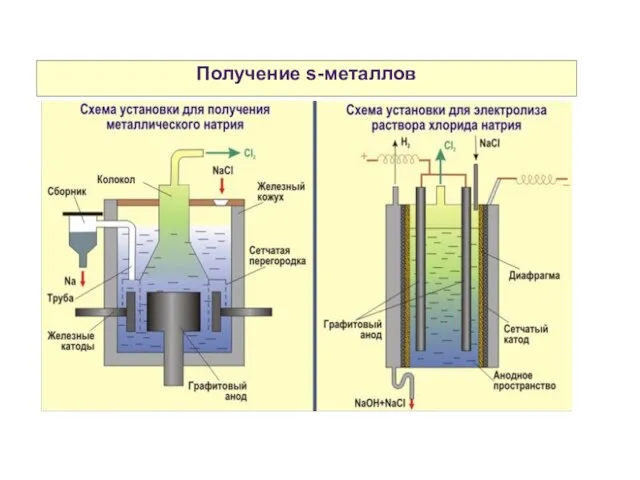
- 16. Получение s-металлов
- 17. Свойства соединений s-металлов 1. Оксиды и гидроксиды ЩМ и ЩЗМ имеют ярко выраженный оснОвный характер: реагируют
- 18. Свойства соединений s-металлов
- 19. Свойства соединений s-металлов 6. Гидриды s-металлов имеют ионное строение, высокие t°пл, называются солеподобными из-за сходства с
- 20. Свойства соединений s-металлов Вследствие низких значение EI атомы ЩМ и ЩЗМ и их соединения легко ионизуются
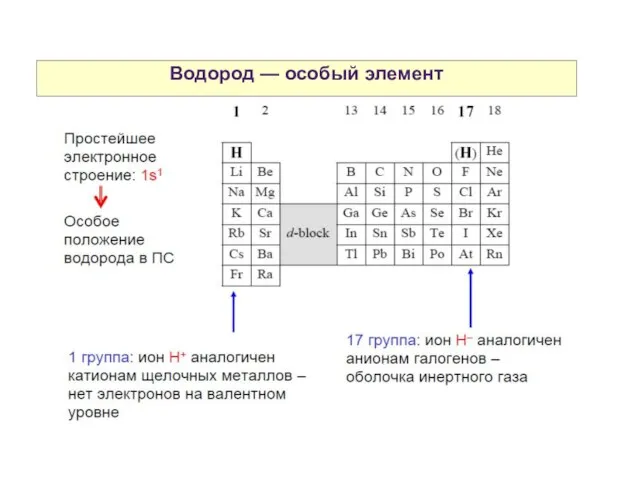
- 21. Водород — особый элемент
- 22. Изотопы водорода
- 23. Изотопы водорода
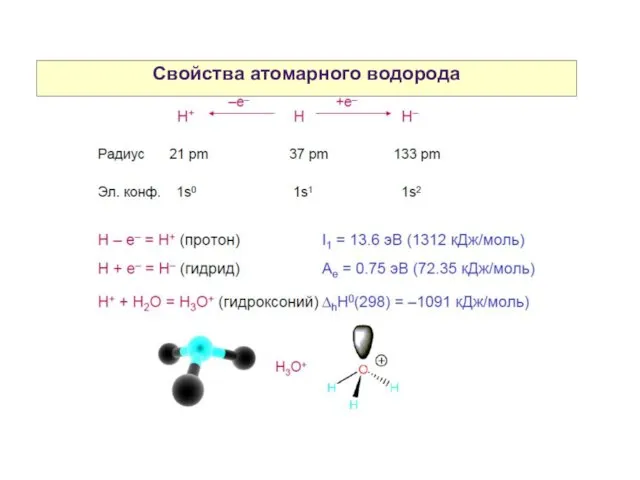
- 24. Свойства атомарного водорода
- 25. Получение и свойства водорода
- 26. Получение и свойства водорода
- 27. Образование химической связи
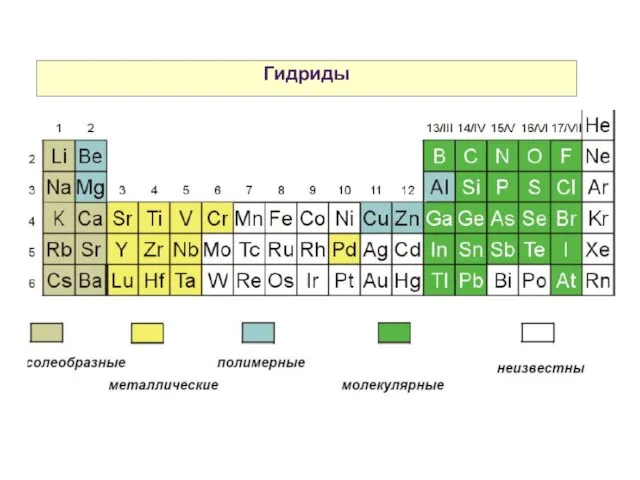
- 28. Гидриды
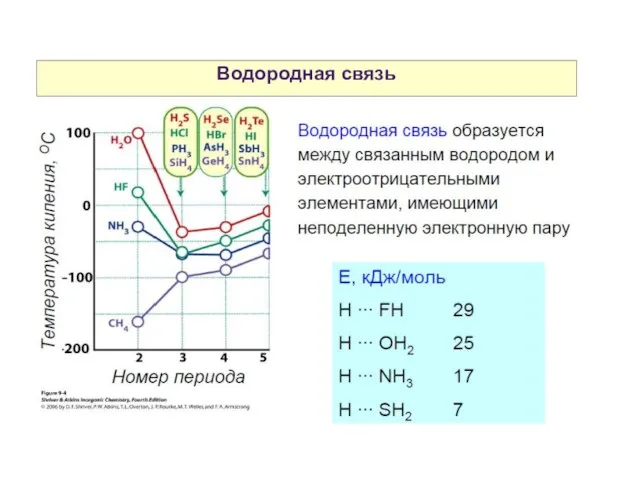
- 29. Водородная связь
- 30. Пероксид водорода
- 31. Пероксид водорода
- 33. Скачать презентацию






















 Титан (лат. Titanium; обозначается символом Ti)
Титан (лат. Titanium; обозначается символом Ti) Презентация по Химии "История открытия и экспериментального подтверждения периодического закона" - скачать смотреть
Презентация по Химии "История открытия и экспериментального подтверждения периодического закона" - скачать смотреть  Презентация по Химии "Алкены" - скачать смотреть бесплатно__
Презентация по Химии "Алкены" - скачать смотреть бесплатно__ Закон сохранения массы веществ
Закон сохранения массы веществ Презентация по химии Амины
Презентация по химии Амины Radiation-induced desorption of excited atoms from solid nitrogen
Radiation-induced desorption of excited atoms from solid nitrogen Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Acizii nucleici
Acizii nucleici Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Ртуть
Ртуть Трансляция. Активирование аминокислоты
Трансляция. Активирование аминокислоты Амфотерні оксиди та гідроксиди
Амфотерні оксиди та гідроксиди Альдегиды
Альдегиды Словарь архаизмов и историзмов 4 класс
Словарь архаизмов и историзмов 4 класс  Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины
Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины Бикомпонентные покрытия
Бикомпонентные покрытия Фракциялық айдау
Фракциялық айдау Презентация по Химии "Алканы, алкены, алкины: строение, изомерия и номенклатура" - скачать смотреть
Презентация по Химии "Алканы, алкены, алкины: строение, изомерия и номенклатура" - скачать смотреть  Свойства катализатора. Влияние массы катализатора на скорость реакции
Свойства катализатора. Влияние массы катализатора на скорость реакции Предмет физиологии центральной нервной системы
Предмет физиологии центральной нервной системы Определение температуры. Абсолютная температура
Определение температуры. Абсолютная температура Плавиковая кислота или фтористоводородная кислота
Плавиковая кислота или фтористоводородная кислота Классификация химических веществ
Классификация химических веществ Дифузія у побуті
Дифузія у побуті Окислительно-восстановительные реакции в неорганическом синтезе. (Тема 6)
Окислительно-восстановительные реакции в неорганическом синтезе. (Тема 6) Лекарственные средства, влияющие на афферентную иннервацию
Лекарственные средства, влияющие на афферентную иннервацию Продукт полимеризации стирола - полистирол
Продукт полимеризации стирола - полистирол История получения алюминия и его применение
История получения алюминия и его применение