Содержание
- 2. Характерно, что небольшие количества Кат ускоряют превращения больших количеств реагирующих веществ. Так на одной части Pt-Кат
- 3. Эффективность Кат часто характеризуют «числом оборотов», а именно числом молей реагентов n, превращенных одним молем Кат
- 4. ОБЩИЕ ЗАКОНОМЕРНОСТИ КАТАЛИЗА Все каталитические процессы – самопроизвольные реакции, протекающие в направлении убыли энергии Гиббса. При
- 5. Энергия активации каталитической реакции значительно меньше, чем той же реакции без катализатора. Например, энергия активации некатализируемой
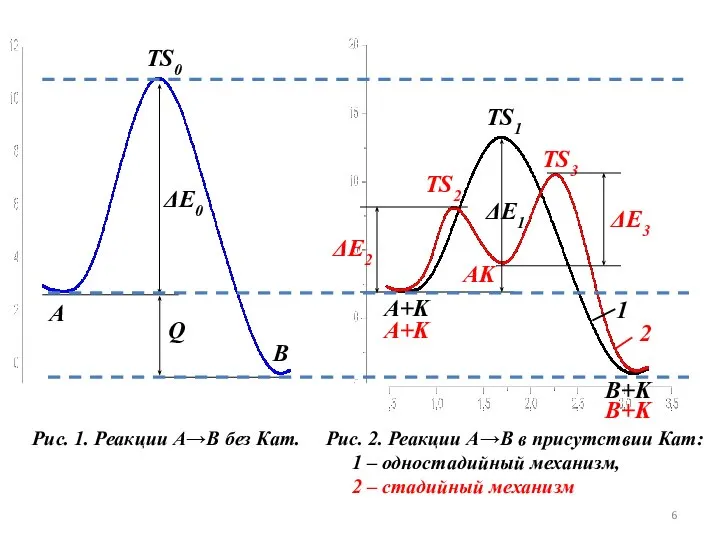
- 6. Рис. 1. Реакции А→В без Кат. TS0 ΔE0 TS1 TS2 TS3 ΔE1 ΔE2 ΔE3 A B
- 7. Одностадийные процессы катализа (ассоциативные, слитные) протекают по схеме: А + К → TS1 → В +
- 8. Энергии активации обеих стадий меньше, чем в случае реакции без Кат. (ΔЕ2, ΔЕ3 Таким образом, независимо
- 9. ГОМОГЕННЫЙ КАТАЛИЗ Гомогенный катализ можно разделить на: - кислотно-основной; металлокомплексный; окислительно-восстановительный; - гомогенный газофазный; - ферментативный.
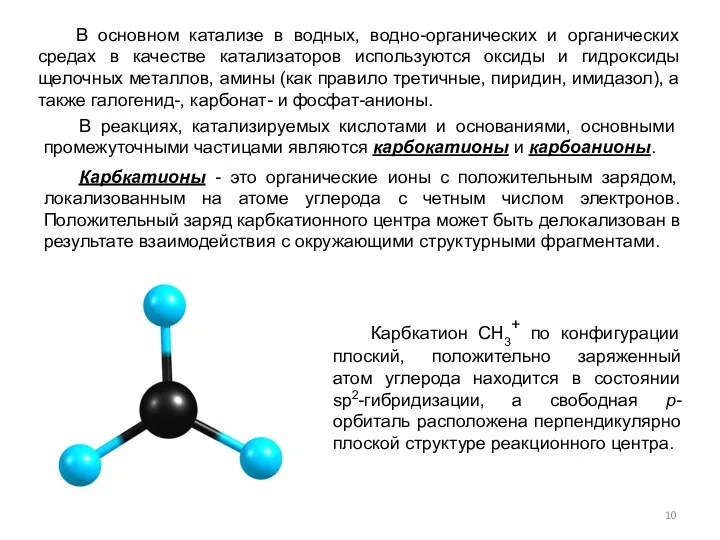
- 10. В основном катализе в водных, водно-органических и органических средах в качестве катализаторов используются оксиды и гидроксиды
- 11. Стабилизация алифатических карбкатионов осуществляется за счет индуктивного эффекта и эффекта сверхсопряжения (гиперконьюгации) и увеличивается в ряду
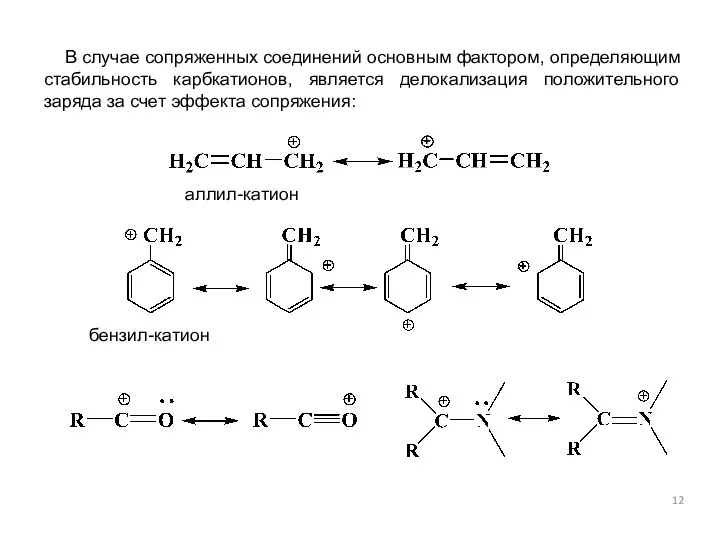
- 12. аллил-катион бензил-катион В случае сопряженных соединений основным фактором, определяющим стабильность карбкатионов, является делокализация положительного заряда за
- 13. Стабильность арилметильных катионов растет в ряду: В этом же ряду уменьшается их реакционная способность. При наличии
- 14. Образование карбкатионов осуществляется следующим образом: 1. Гетеролитическое расщепление σ-связи. Карбкатионы образуются главным образом в полярных растворителях,
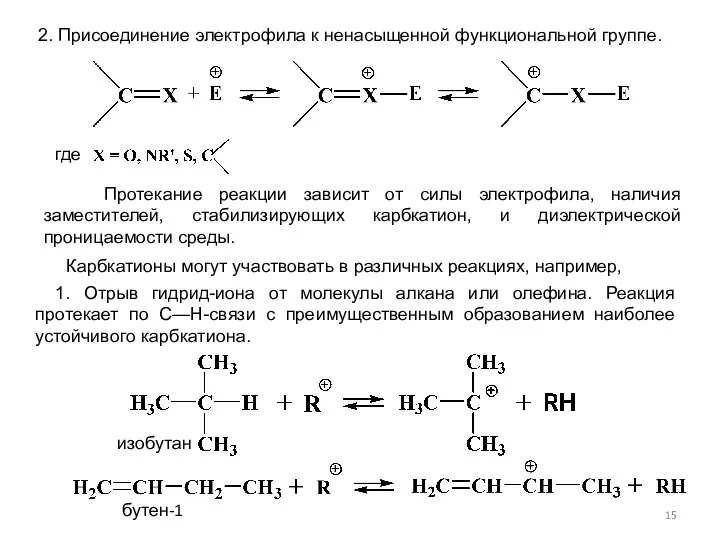
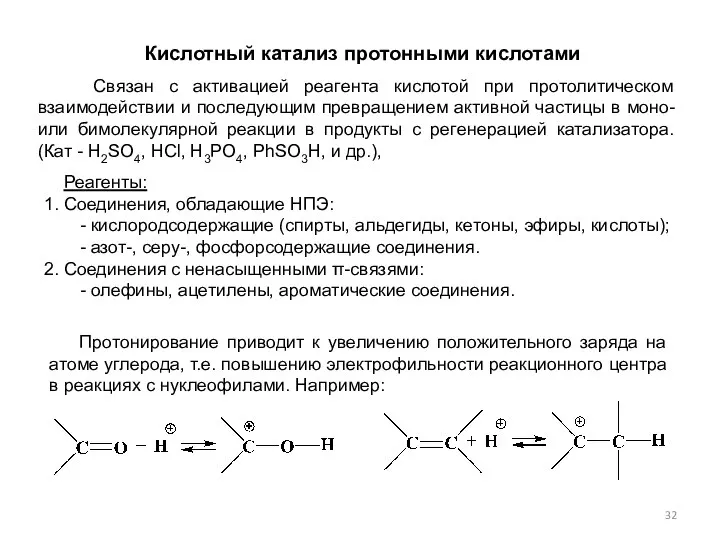
- 15. 2. Присоединение электрофила к ненасыщенной функциональной группе. где Протекание реакции зависит от силы электрофила, наличия заместителей,
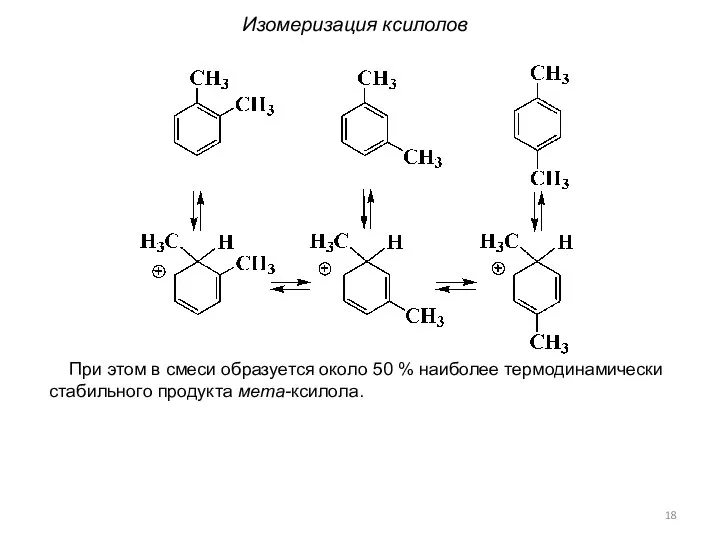
- 18. При этом в смеси образуется около 50 % наиболее термодинамически стабильного продукта мета-ксилола. Изомеризация ксилолов
- 19. 4. Взаимодействие карбкатионов с нуклеофилами: где X- = F-, Cl-, Br-, CN-, OH--, NH2- где HX
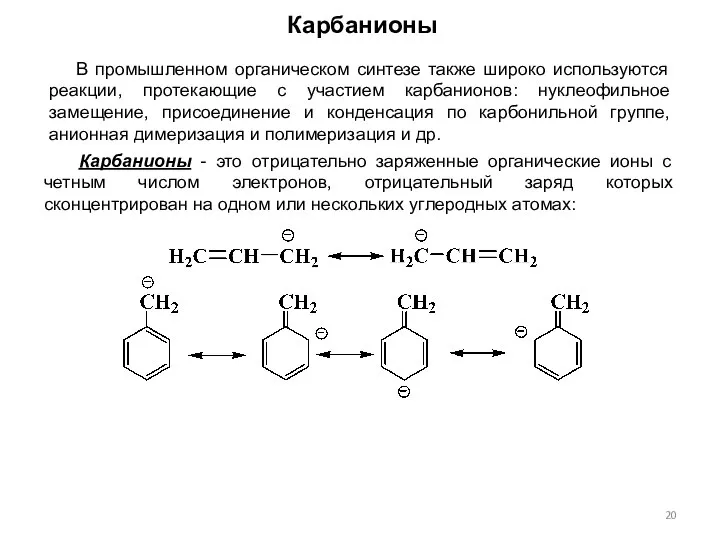
- 20. Карбанионы - это отрицательно заряженные органические ионы с четным числом электронов, отрицательный заряд которых сконцентрирован на
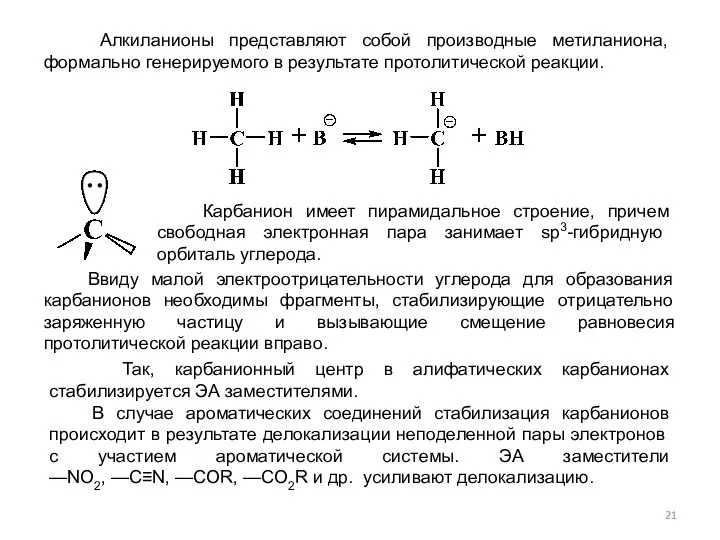
- 21. Алкиланионы представляют собой производные метиланиона, формально генерируемого в результате протолитической реакции. Ввиду малой электроотрицательности углерода для
- 22. Соединения этой группы существенно отличаются по реакционной способности от углеводородных карбанионов. Особую группу карбанионов образуют илиды
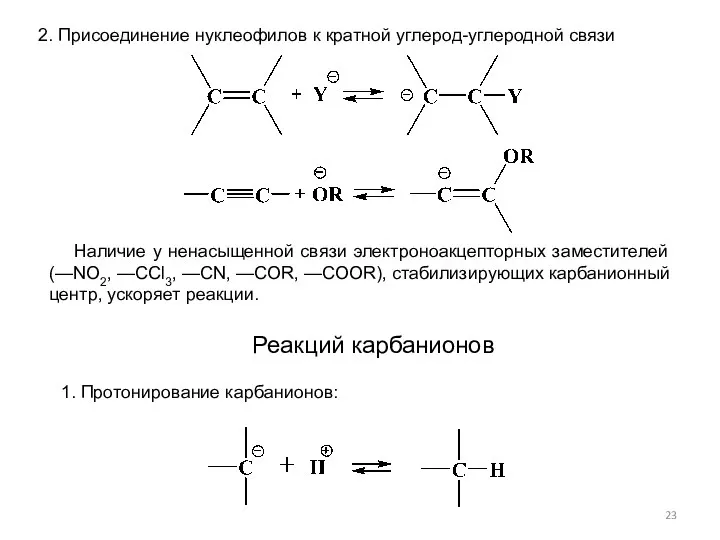
- 23. 2. Присоединение нуклеофилов к кратной углерод-углеродной связи Наличие у ненасыщенной связи электроноакцепторных заместителей (—NO2, —ССl3, —CN,
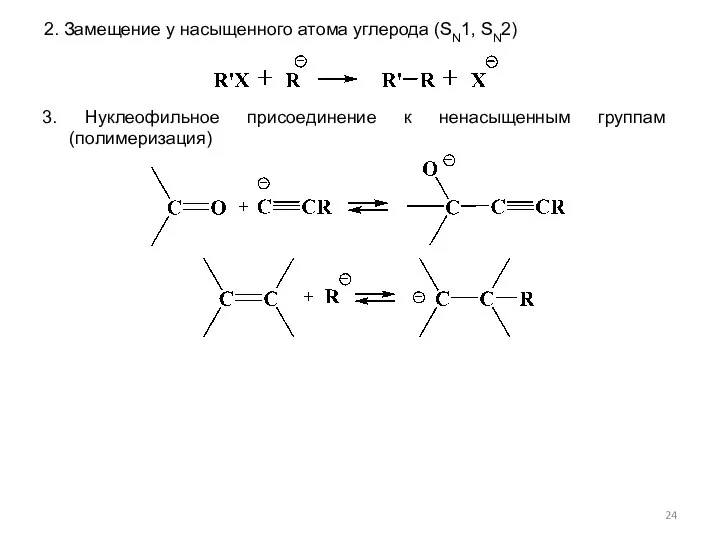
- 24. 2. Замещение у насыщенного атома углерода (SN1, SN2)
- 25. В промышленности многие органические реакции проводится в концентрированных растворах сильных минеральных кислот или оснований в воде,
- 26. Тогда константа кислотности индикатора в растворе будет равна , где и коэффициенты активности. Кислотность среды по
- 27. Имея набор структурно-подобных индикаторов, в качестве которых Гаммет использовал замещенные нитроанилины, можно определить кислотность среды в
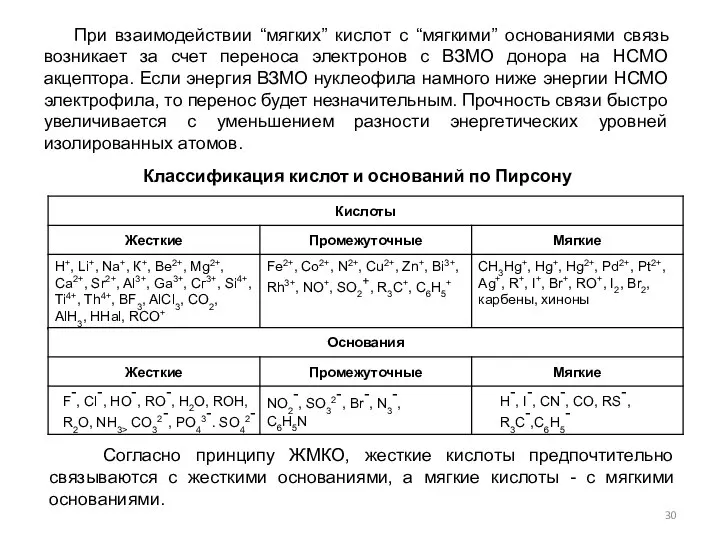
- 28. Теория жестких и мягких кислот и оснований Было показано, что легкость протекания кислотно-основной реакции зависит как
- 29. Жесткие основания - основания, в которых атом донора пары электронов имеет высшие занятые орбитали (ВЗМО) с
- 30. При взаимодействии “мягких” кислот с “мягкими” основаниями связь возникает за счет переноса электронов с ВЗМО донора
- 31. СОВРЕМЕННАЯ КЛАССИФИКАЦИЯ КИСЛОТ И ОСНОВАНИЙ Основана на типе орбиталей, принимающих участие в образовании межмолекулярных донорно-акцепторных связей
- 32. Кислотный катализ протонными кислотами Связан с активацией реагента кислотой при протолитическом взаимодействии и последующим превращением активной
- 33. Для насыщенной молекулы, имеющей НПЭ на гетероатоме Х:, при протонировании происходит образование группы (ХН+) с большей
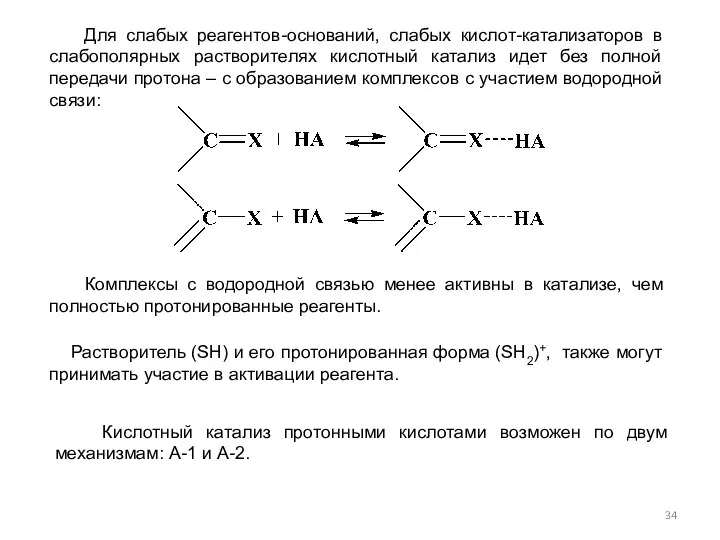
- 34. Для слабых реагентов-оснований, слабых кислот-катализаторов в слабополярных растворителях кислотный катализ идет без полной передачи протона –
- 35. Механизм А-1 заключается в мономолекулярном распаде протонированной молекулы реагента по σ-связи на лимитирующей стадии: (медленно) (быстро)
- 36. По механизму А-1 протекает нитрование некоторых ароматических соединений азотной кислотой, катализируемое серной кислотой. Механизм А-2 включает
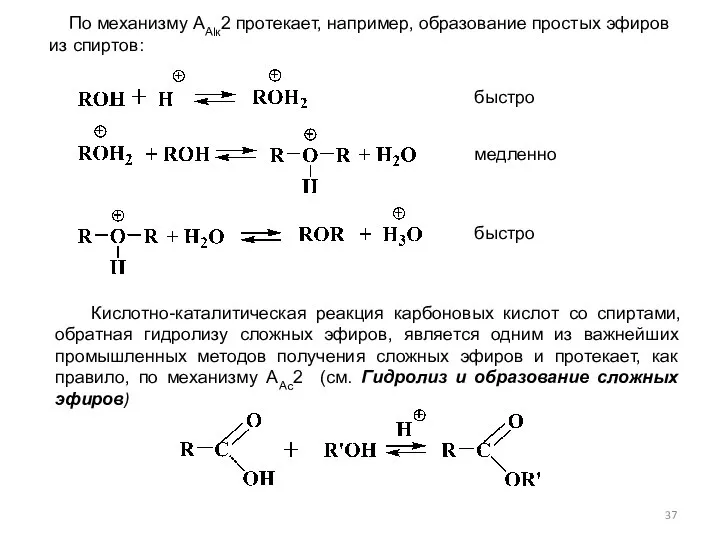
- 37. По механизму ААlк2 протекает, например, образование простых эфиров из спиртов: Кислотно-каталитическая реакция карбоновых кислот со спиртами,
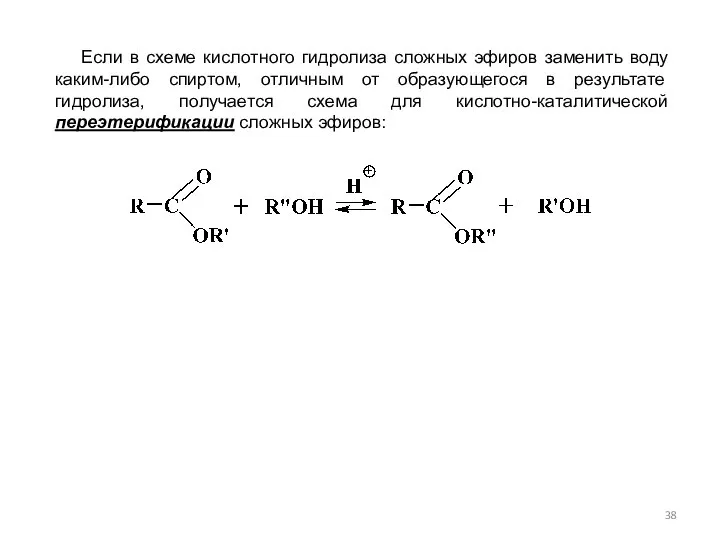
- 38. Если в схеме кислотного гидролиза сложных эфиров заменить воду каким-либо спиртом, отличным от образующегося в результате
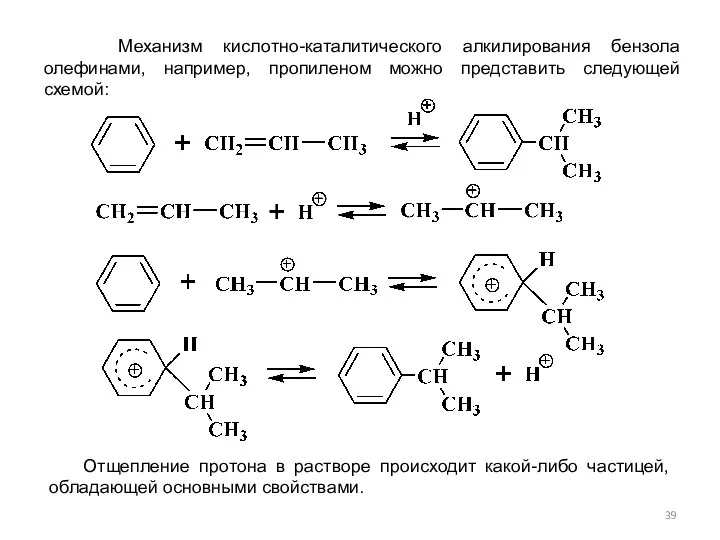
- 39. Механизм кислотно-каталитического алкилирования бензола олефинами, например, пропиленом можно представить следующей схемой: Отщепление протона в растворе происходит
- 40. Электрофильный катализ или катализ апротонными кислотами Заключается в активации реагента апротонной кислотой – кислотой Льюиса –
- 41. ОСНОВНОЙ КАТАЛИЗ ОК - ускорение реакций в щелочной среде или в присутствии различных оснований. Катализ основаниями,
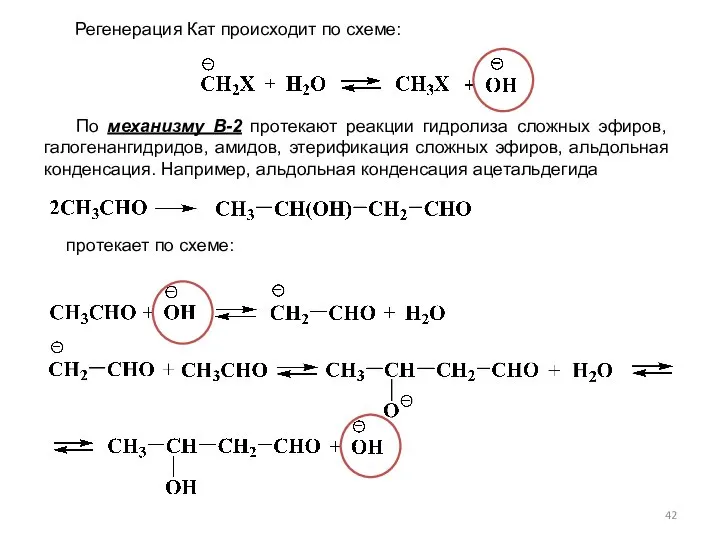
- 42. По механизму В-2 протекают реакции гидролиза сложных эфиров, галогенангидридов, амидов, этерификация сложных эфиров, альдольная конденсация. Например,
- 43. Нуклеофильный катализ – катализ основаниями, не связанный с кислотно-основным равновесием. Кат – ионы галогенов, оксианионы (OH-,
- 44. В сильно полярных растворителях устанавливается кислотно-основное равновесие: НА + Н2О ↔ Н3+О + А– А– +
- 45. Различают специфический и общий кислотно-основной катализ (КОК). Наблюдается, когда скорость реакции пропорциональна только концентрации иона ОН–
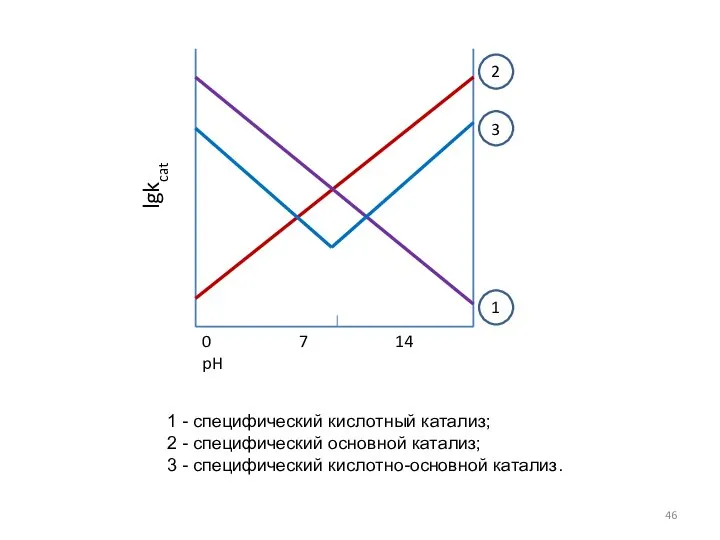
- 46. 0 7 14 pH lgkcat 1 2 3 1 - специфический кислотный катализ; 2 - специфический
- 47. Осуществляется всеми кислотами и основаниями Бренстеда. Для определения этого катализа используют специфичные буферные смеси, где концентрации
- 48. Недостатки гомогенного катализа: необходимость отделения Кат от реакционной массы: образование токсичных сточных вод; повышенный расход Кат
- 51. Разделы для самостоятельной проработки, 2013 Гомогенный металлокомплексный катализ. Лит. 1. Лебедев Н.Н., Манаков М.Н., Швец В.Ф.
- 53. Скачать презентацию

































 Органічні розчинники. 11 клас
Органічні розчинники. 11 клас Электролитическая диссоциация воды
Электролитическая диссоциация воды Тема: «Бишофит – новый старый антигололедный реагент» Авторы: Гончаревич Анастасия Клокова Татьян
Тема: «Бишофит – новый старый антигололедный реагент» Авторы: Гончаревич Анастасия Клокова Татьян Алканы. Получение и применение алканов
Алканы. Получение и применение алканов Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Значення хімічних процесів у природі
Значення хімічних процесів у природі H2O, Hg2+ CH3MgCI
H2O, Hg2+ CH3MgCI Карбонаты и фосфаты
Карбонаты и фосфаты Коллоидно-химический синтез квантовых точек на основе сульфидов свинца и кадмия
Коллоидно-химический синтез квантовых точек на основе сульфидов свинца и кадмия Микрофлора и биохимические реакции подземных вод
Микрофлора и биохимические реакции подземных вод Подгруппа мышьяка
Подгруппа мышьяка Комплексные соединения
Комплексные соединения Гормоны. Виды и классификация гормонов
Гормоны. Виды и классификация гормонов Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты Тұндыру әдістері
Тұндыру әдістері Самородные элементы
Самородные элементы Фармацевтическая химия
Фармацевтическая химия Презентация по Химии "Классификация углеводородов" - скачать смотреть
Презентация по Химии "Классификация углеводородов" - скачать смотреть  Получение и применение неметаллов
Получение и применение неметаллов Енергетичні напої користь чи шкода?
Енергетичні напої користь чи шкода?  Определение содержания растворенного кислорода в природной воде
Определение содержания растворенного кислорода в природной воде Геохимия природных процессов
Геохимия природных процессов Определение расхода воздуха на горение, количество и температуру продуктов
Определение расхода воздуха на горение, количество и температуру продуктов Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислорода
Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислорода Экспресс-методы решения задач по химии
Экспресс-методы решения задач по химии Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Галогены
Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Галогены Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Дисперсные системы Эмульсии. Пены. Порошки
Дисперсные системы Эмульсии. Пены. Порошки