Содержание
- 2. Информация о программе Дорогие друзья! Вы начали работу с обучающей программой «Основные классы неорганических веществ». Программа
- 3. Содержание программы Повторим! Таблица Общие химические свойства и способы получения основных классов неорганических веществ Тест Приложение
- 4. Повторим! Оксиды Основания Кислоты Соли
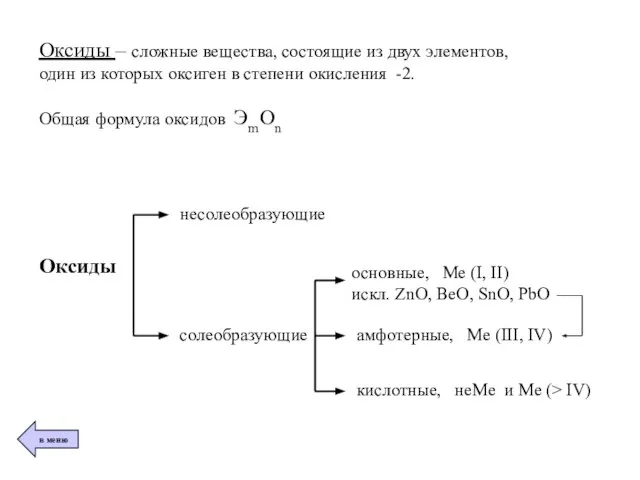
- 5. Оксиды – сложные вещества, состоящие из двух элементов, один из которых оксиген в степени окисления -2.
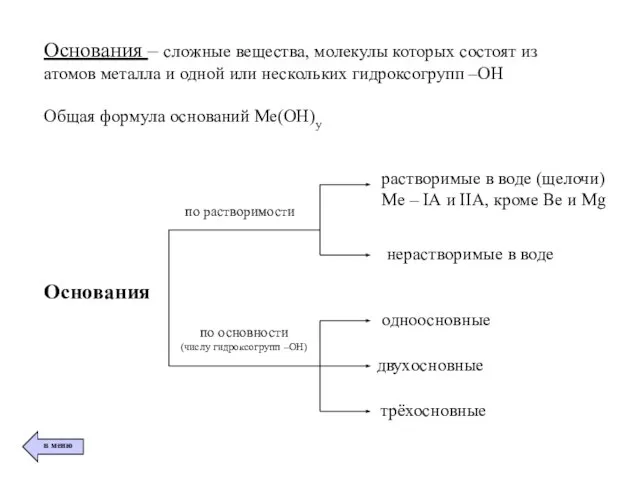
- 6. Основания – сложные вещества, молекулы которых состоят из атомов металла и одной или нескольких гидроксогрупп –ОН
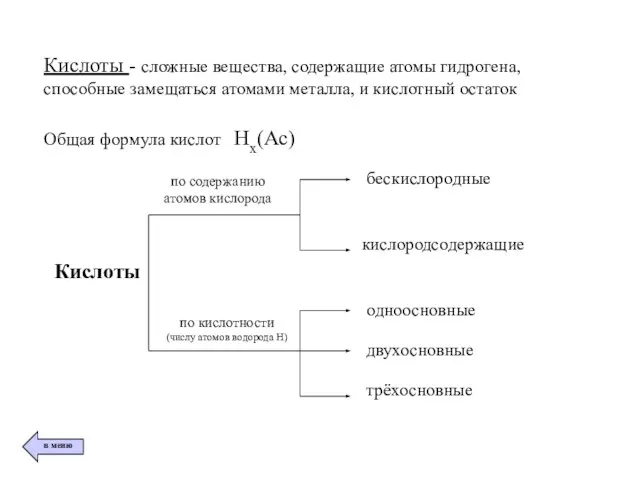
- 7. Кислоты - сложные вещества, содержащие атомы гидрогена, способные замещаться атомами металла, и кислотный остаток Общая формула
- 8. Соли - сложные вещества, которые являются продуктами замещения атомов гидрогена в молекулах кислот атомами металла или
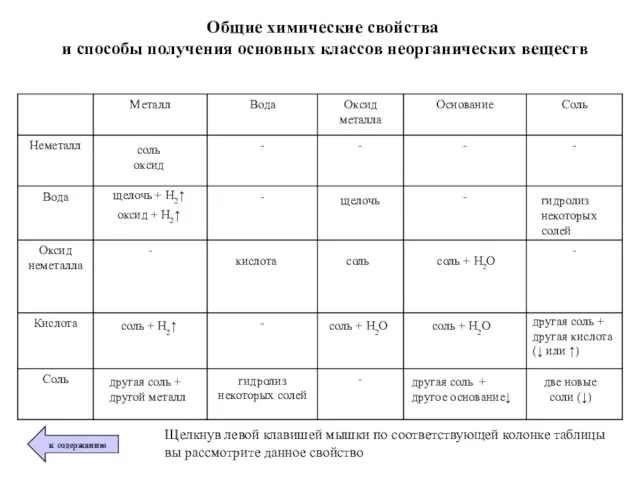
- 9. Общие химические свойства и способы получения основных классов неорганических веществ щелочь + Н2↑ оксид + Н2↑
- 10. 2. Ме + О2 → оксид металла 2Zn + О2 → 2ZnO 1. Me + неМе
- 11. Ме + Н2О → щелочь + Н2↑ Обратите внимание! Так взаимодействуют только щелочные (IA) и щелочноземельные
- 12. Оксид Ме + Н2О → щелочь Обратите внимание! Так взаимодействуют только оксиды щелочные (IA) и щелочноземельные
- 13. Возможность и характер протекания гидролиза соли определяется её составом. Соль, образованная сильным основанием и сильной кислотой,
- 14. Оксид неМе + Н2О → кислота * Исключение кремний (IV) оксид SiO2, который с водой не
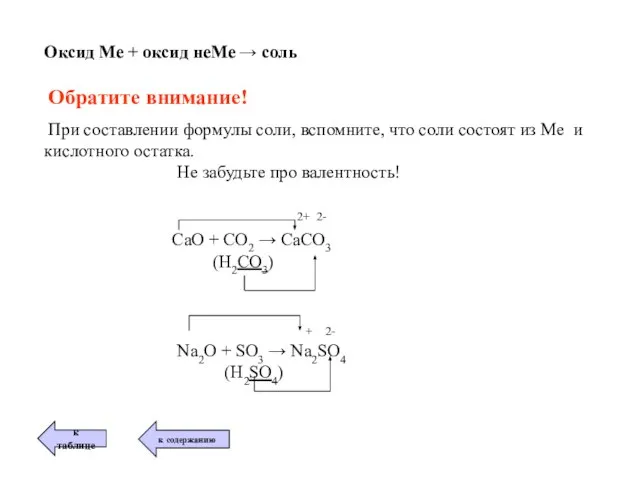
- 15. Оксид Ме + оксид неМе → соль Обратите внимание! При составлении формулы соли, вспомните, что соли
- 16. Основание + оксид неМе → соль + Н2О Обратите внимание! В реакцию вступают только растворимые в
- 17. Кислота + Ме → соль + Н2↑ Обратите внимание! Для реакции не брать азотную кислоту HNO3
- 18. Кислота + оксид Ме → соль + Н2О 2HCl + CaO → CaCl2 + H2O H2SO4
- 19. Основание + кислота → соль + Н2О (реакция нейтрализации) NaOH + HCl → NaCl + H2O
- 20. Соль + кислота → др. соль + другая кислота (↑ или ↓) Обратите внимание! Реакция обмена
- 21. Соль + Ме → др. соль + др. Ме Обратите внимание! * Реакция протекает в соответствии
- 22. Соль + основание → другая соль + другое основание ↓ Обратите внимание! * В реакцию ступают
- 23. Соль + соль → две новые соли (↓) Обратите внимание! Реакция обмена протекает до конца, если
- 24. Проверим! Этот тест поможет вам понять насколько вы усвоили химические свойства и способы получения основных классов
- 25. 2. При взаимодействии натрия с водой образуются а) водород и натрий оксид б) кислород и натрий
- 27. 4. Каким веществом надо подействовать на цинк хлорид ZnCl2, чтобы получить цинк гидроксид Zn(OH)2 г) КОН
- 28. 5. Реакция нейтрализации протекает при взаимодействии а) NaCl + AgNO3 б) NaOH + HNO3 в) K2O
- 29. 6. Барий хлорид BaCl2 взаимодействует с а) HNO3 б) H2SO4 в) HCl г) H2О
- 30. 7. Может вытеснить цинк из раствора его соли а) Fe б) Cu в) Al г) Na
- 31. 8. Реакция обмена протекает до конца между а) барий хлоридом и натрий нитратом б) цинк нитратом
- 32. 9. Водород выделяется при взаимодействии а) Cu + HNO3 в) Ag + HCl б) Zn +
- 33. 10. Натрий гидроксид при обычных условиях взаимодействует с г) водой а) карбон (IV) оксидом б)кальций оксидом
- 34. Поздравляю! Вы успешно справились с заданием! Желаю вам успехов в освоении химии – одна из интереснейших
- 35. Приложение 1. Ряд активности металлов (электрохимический ряд напряжения металлов Li K Ba Sr Ca Na Mg
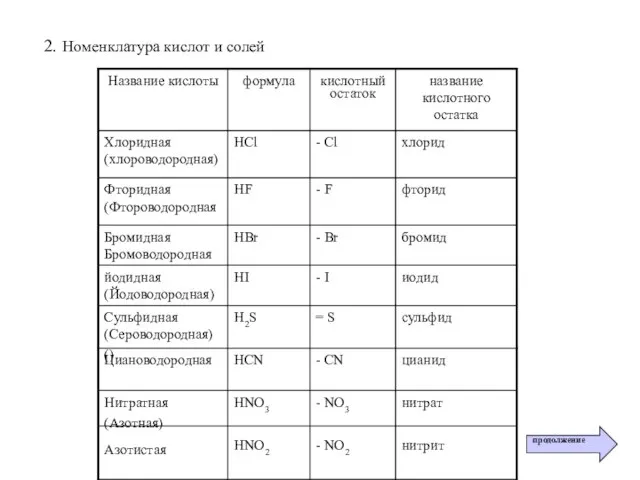
- 36. 2. Номенклатура кислот и солей продолжение
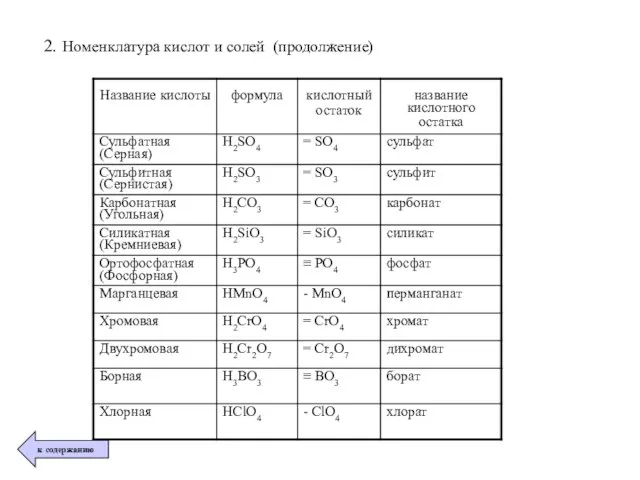
- 37. 2. Номенклатура кислот и солей (продолжение)
- 39. Скачать презентацию




























 Термохимия Типы энтальпии Теплоемкость Закон Кирхгофа Закон Гесса
Термохимия Типы энтальпии Теплоемкость Закон Кирхгофа Закон Гесса  Аттестационная работа. Методическая разработка по выполнению проекта Анализ содержания ионов железа (III) в пищевых продуктах
Аттестационная работа. Методическая разработка по выполнению проекта Анализ содержания ионов железа (III) в пищевых продуктах Закон Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона-Менделеева
Закон Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона-Менделеева Презентация по Химии "Получение сложнооксидных нано- и микроматериалов методом пиролиза полимерно-солевых композиций" - скач
Презентация по Химии "Получение сложнооксидных нано- и микроматериалов методом пиролиза полимерно-солевых композиций" - скач Минералы
Минералы Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно
Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно Функціональні матеріали в аналітичній хімії. Лекція 1
Функціональні матеріали в аналітичній хімії. Лекція 1 «Системно – деятельностный подход как механизм реализации ФГОС нового поколения» обучающий семинар МБОУ «СОШ №15», п.Аршан – 2015г
«Системно – деятельностный подход как механизм реализации ФГОС нового поколения» обучающий семинар МБОУ «СОШ №15», п.Аршан – 2015г Кристаллические и аморфные тела
Кристаллические и аморфные тела Проблемы и меры по защите окружающей среды ПМР
Проблемы и меры по защите окружающей среды ПМР Бионеорганическая химия. Жидкие среды организма. (Лекция 2)
Бионеорганическая химия. Жидкие среды организма. (Лекция 2) Лекарственное растительное сырье, содержащее производные простых фенолов
Лекарственное растительное сырье, содержащее производные простых фенолов Исследование состава и свойств минеральной воды Авторы:
Исследование состава и свойств минеральной воды Авторы:  Презентация Щелочные металлы
Презентация Щелочные металлы  Basic concepts and laws of chemistry
Basic concepts and laws of chemistry ХТС производства азотной кислоты
ХТС производства азотной кислоты Презентация по Химии "Вода" - скачать смотреть
Презентация по Химии "Вода" - скачать смотреть  Гидрогели на основе карбоксиметил целлюлозы
Гидрогели на основе карбоксиметил целлюлозы Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Золото. Свойство золота
Золото. Свойство золота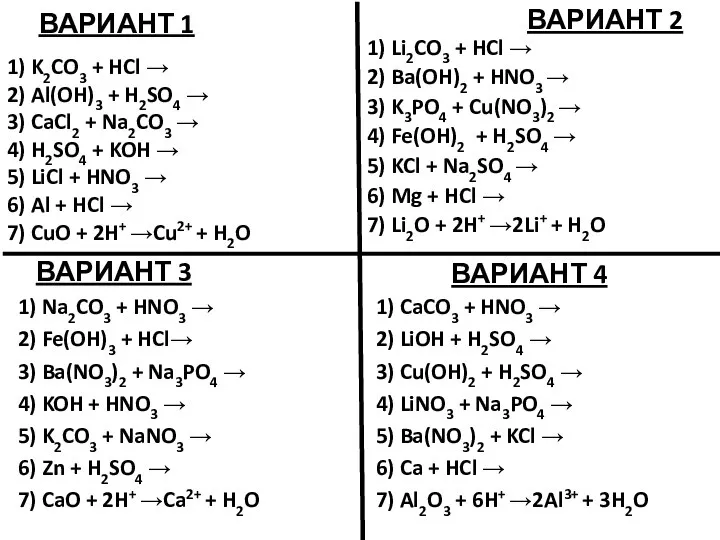 Уравнения возможных реакций. Задание
Уравнения возможных реакций. Задание Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Вещества преимущественно удушающего действия (пульмонотоксиканты)
Вещества преимущественно удушающего действия (пульмонотоксиканты) Моющие средства
Моющие средства Строение кристаллов
Строение кристаллов Тема урока: «Факторы, влияющие на скорость химических реакций».
Тема урока: «Факторы, влияющие на скорость химических реакций». Атомы и молекулы. Ионы
Атомы и молекулы. Ионы