Содержание
- 2. Химическая схема производства Сырьем является синтетический аммиак, кислород воздуха и вода. Протекают реакции: окисление аммиака кислородом
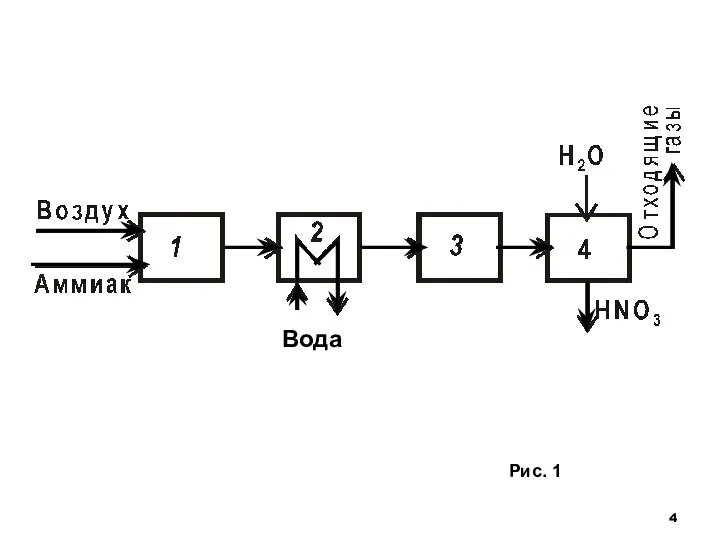
- 3. Исходя из химической схемы (1)-(3), функциональная схема включает подсистемы: окисления аммиака, последующее охлаждение газов (реакция (1)
- 4. Рис. 1 Вода
- 5. Подсистема окисление аммиака. Физико-химические свойства процесса Окисление аммиака - сложная каталитическая реакция. Аммиак окисляется по целевой
- 6. Условия процесса Реакция - быстрая, протекает во внешне-диффузионной области на внешней поверхности катализатора. Лимитирующая стадия –
- 7. ПЛАТИНОИДНЫЕ КАТАЛИЗАТОРНЫЕ СЕТКИ
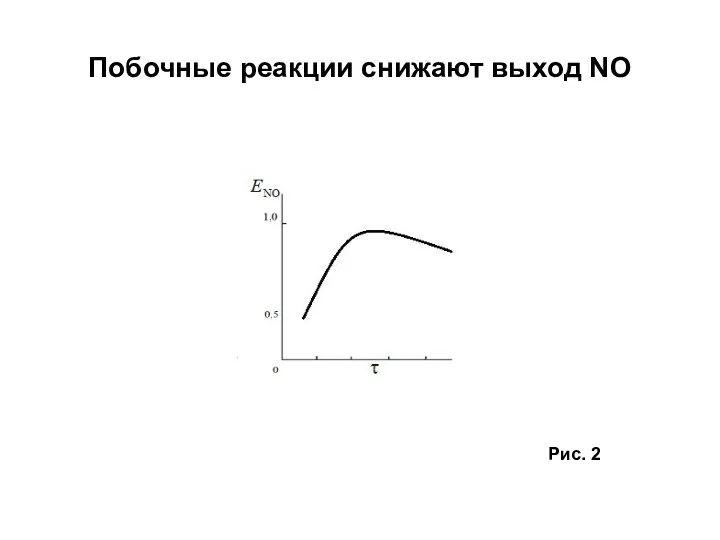
- 8. Побочные реакции снижают выход NO Рис. 2
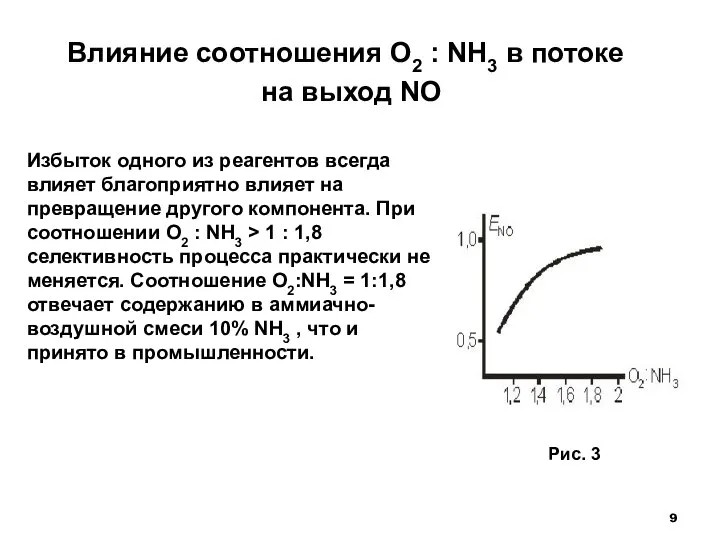
- 9. Влияние соотношения O2 : NH3 в потоке на выход NO Избыток одного из реагентов всегда влияет
- 10. Влияние давления и температуры на процесс С ростом давления возрастают концентрации компонентов и увеличивается общая скорость
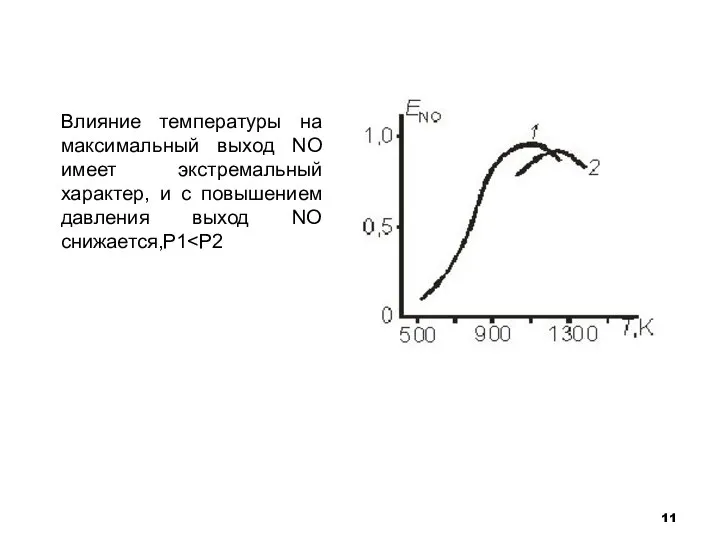
- 11. Влияние температуры на максимальный выход NO имеет экстремальный характер, и с повышением давления выход NO снижается,Р1
- 12. Итак, давление влияет отрицательно на процесс окисления аммиака: падает выход NO, нужно больше селективного катализатора, а
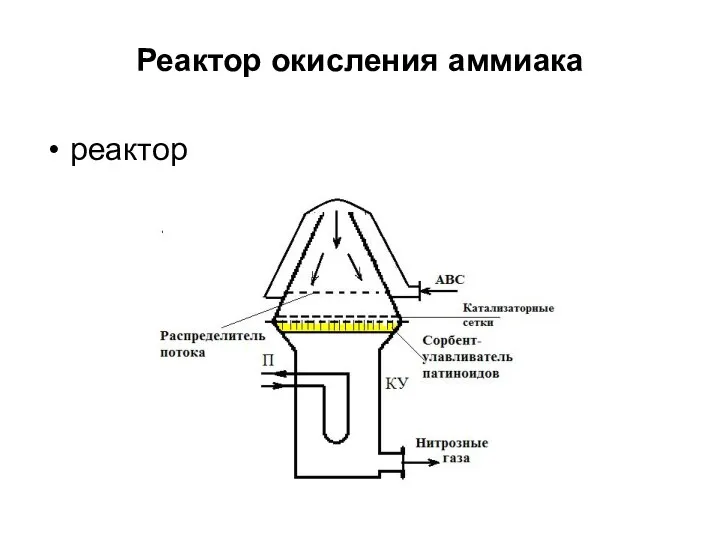
- 13. Реактор окисления аммиака реактор
- 14. Подсистема окисления оксида азота Физико-химические свойства процесса - гомогенная обратимая экзотермическая реакция: 2NO + O2 2NO2
- 15. Подсистема абсорбции оксидов азота Физико-химические основы процесса Диоксид азота взаимодействует с водой по схеме: 2NO2 +
- 16. Это гетерогенный процесс в системе «Г-Ж». По сравнению со стадией диффузии NO2 (полярный, кислый оксид) химическая
- 17. Из уравнения следует, что скорость поглощения диоксида азота водными растворами азотной кислоты определяется температурой, давлением, концентрацией
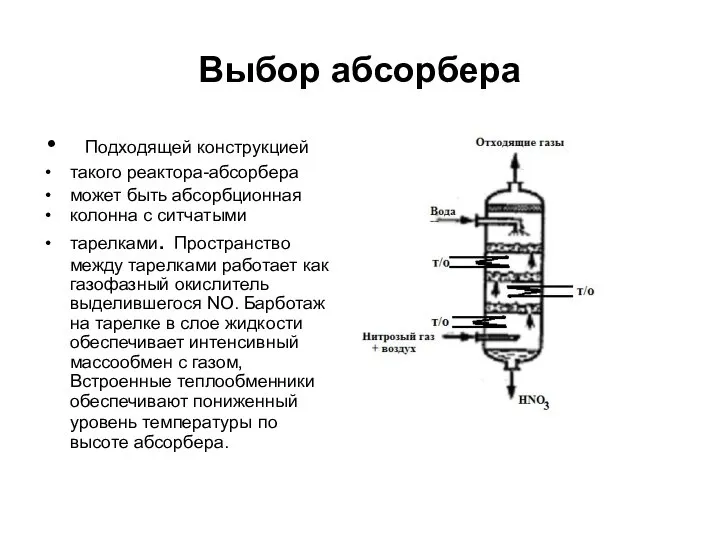
- 18. Выбор абсорбера Подходящей конструкцией такого реактора-абсорбера может быть абсорбционная колонна с ситчатыми тарелками. Пространство между тарелками
- 19. Суммарно в абсорбционной колонне протекает превращение, описываемое следующим брутто-уравнением как сумма уравнений (3) и (4): 4NO2
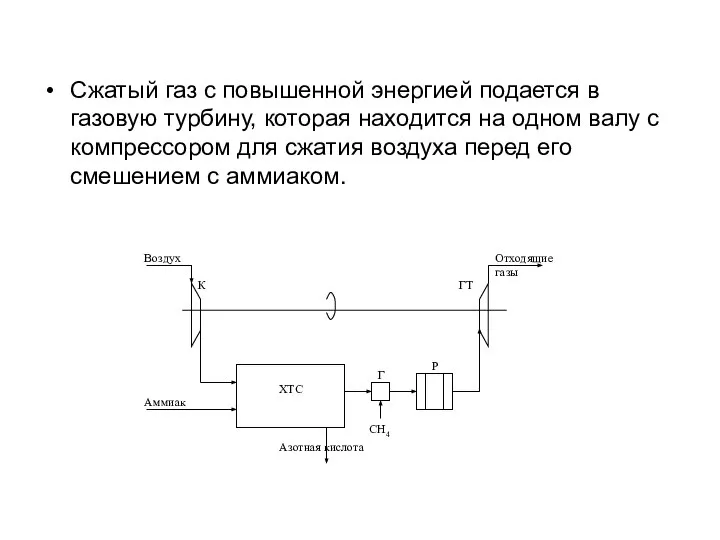
- 20. Энерготехнология в производстве HNO3 Газы после абсорбции находятся под повышенным давлением, потенциал которого можно использовать в
- 21. Сжатый газ с повышенной энергией подается в газовую турбину, которая находится на одном валу с компрессором
- 22. Очистка отходящего газа от оксидов азота (высокотемпературная каталитическая) Реактор каталитической очистки при использовании природного газа в
- 24. Скачать презентацию














 Номенклатура классов неорганических соединений
Номенклатура классов неорганических соединений Химические элементы в клетках живых организмов Автор: учитель химии МКОУ «Касторенская СОШ №1», п.г.т. Касторное Парамонов А.Ю.,
Химические элементы в клетках живых организмов Автор: учитель химии МКОУ «Касторенская СОШ №1», п.г.т. Касторное Парамонов А.Ю., Презентация по Химии "Вода как жизнь" - скачать смотреть бесплатно
Презентация по Химии "Вода как жизнь" - скачать смотреть бесплатно Гибридизация орбиталей и строение молекул этана, этилена и ацетилена
Гибридизация орбиталей и строение молекул этана, этилена и ацетилена Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Physical chemistry of nanostructured systems.( lecture no. 7)
Physical chemistry of nanostructured systems.( lecture no. 7) Эколого-геохимическая оценка состояния компонентов природной среды особо охраняемых территорий. Парк «Смоленское Поозерье»
Эколого-геохимическая оценка состояния компонентов природной среды особо охраняемых территорий. Парк «Смоленское Поозерье» Углерод и его соединения
Углерод и его соединения Кремний
Кремний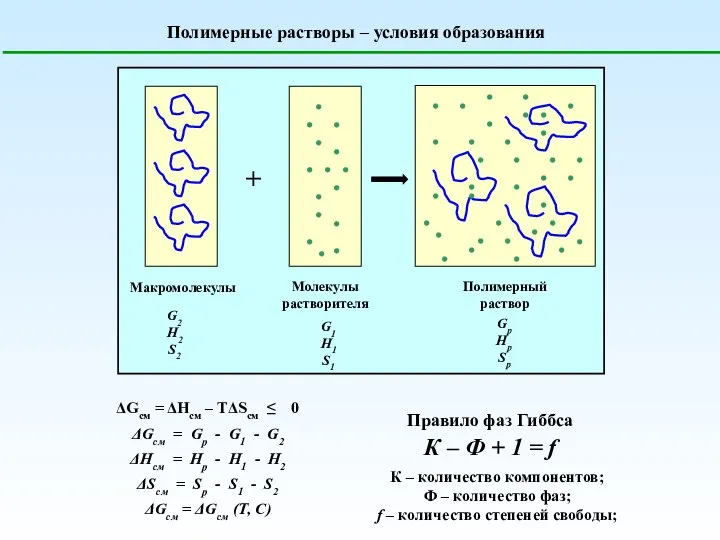 Полимерные растворы – условия образования
Полимерные растворы – условия образования Углерод
Углерод Катализаторы для синтеза лекарственных препаратов и их строительных блоков
Катализаторы для синтеза лекарственных препаратов и их строительных блоков Основы органической химии
Основы органической химии Химическое загрязнение акваторий. Основные термины и определения
Химическое загрязнение акваторий. Основные термины и определения Виникнення процесу горіння. Самозаймання речовин та матеріалів. Особливості самозаймання. Хімічне самозаймання. (Розділ 2.5.8)
Виникнення процесу горіння. Самозаймання речовин та матеріалів. Особливості самозаймання. Хімічне самозаймання. (Розділ 2.5.8) Олигосахариды и полисахариды
Олигосахариды и полисахариды Разработка способа получения аллантоина
Разработка способа получения аллантоина Химия және медицина
Химия және медицина Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Классическая теория гармонического кристалла. Гармоническое приближение. Адиабатическое приближение
Классическая теория гармонического кристалла. Гармоническое приближение. Адиабатическое приближение Синтез наноматериалов золь-гель методом. (Лекция 5)
Синтез наноматериалов золь-гель методом. (Лекция 5) Презентация по химии Стекло
Презентация по химии Стекло  Циклоалканы
Циклоалканы Химерні та трансгенні організми
Химерні та трансгенні організми  Прибор “октис-2”
Прибор “октис-2” Витамины и авитаминоз - презентация_
Витамины и авитаминоз - презентация_ Идентификация органических веществ
Идентификация органических веществ Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров)