Содержание
- 2. Вопросы для самостоятельного изучения Промышленные катализаторы гидрогенизационых процессов в нефтепереработке и нефтехимии. Дезактивация катализаторов в каталитических
- 3. Учебно-методическое обеспечение дисциплины 1. Крылов О.В. Гетерогенный катализ М.: ИКЦ «Академкнига», 2004,-679 с. 2. Боресков Г.К.
- 4. Лекция 1 Краткий исторический очерк. Основные этапы развития катализа. Феноменология катализа. Роль катализа в современной химической
- 5. Основные определения КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами.
- 6. Краткий исторический очерк И. Берцелиус (1837): «Известные вещества оказывают при соприкосновении с другими веществами такое влияние
- 7. Виды катализа В зависимости от того, находится катализатор в той же фазе, что и реагирующие вещества,
- 8. Механизм гетерогенного катализа Механизм гетерогенного катализа включает пять стадий, причем все они обратимы. 1. Диффузия реагирующих
- 9. Сопутствующие материалы Промоторы (или активаторы) - вещества, повышающие активность катализатора. При этом промоторы могут сами и
- 10. Энергетический барьер Все каталитические реакции - самопроизвольный процесс, т.е. протекают в направлении убыли энергии Гиббса -
- 11. Нахождение величины энергии активации Е Чтобы найти величину энергии активации Е, изучают скорость реакции при разной
- 12. Энергетическая диаграмма реакции Энергетическая диаграмма реакции типа А : В; а - без катализатора, б -
- 13. ОСНОВНЫЕ ТИПЫ ГЕТЕРОГЕННЫХ КАТАЛИЗАТОРОВ В гетерогенном катализе (Г.к.) как и в др. областях катализа, выделяют два
- 14. КАТАЛИЗАТОРЫ-ПОЛУПРОВОДНИКИ Согласно электронной теории Г. к., каталитическая активность полупроводников связана с объемной концентрацией носителей тока (электронов
- 15. Основные полупроводниковые катализаторы - соединения элементов VI гр. Периодической системы (О, S, Se, Те) с переходными
- 16. ИЗМЕНЕНИЕ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ОКСИДОВ ПЕРЕХОДНЫХ МЕТАЛЛОВ В РЕАКЦИИ ОБМЕНА КАТАЛИЗАТОРЫ-ПОЛУПРОВОДНИКИ
- 17. КАТАЛИЗАТОРЫ-МЕТАЛЛЫ Металлы обычно значительно активнее оксидов и обладают более универсальным каталитическим действием, хотя, как правило, менее
- 18. Металлы, находящиеся в конце переходных периодов, имеют в d-оболочке дырки (отсутствие электронов), что облегчает их участие
- 19. В реакциях с участием Н2 наиболее активны металлы, на поверхности которых происходит его хемосорбция с диссоциацией
- 20. КАТАЛИЗ НА ТВЕРДЫХ КИСЛОТАХ И ОСНОВАНИЯХ Для катализаторов кислотно-основного типа специфика твердого тела не выражена так
- 21. Смешанные катализаторы В реакциях кислотно-основного типа (крекинг, дегидратация, изомеризация и др.) высокой активностью обладают катализаторы, состоящие
- 23. Скачать презентацию
Вопросы для самостоятельного изучения
Промышленные катализаторы гидрогенизационых процессов в нефтепереработке и
Вопросы для самостоятельного изучения
Промышленные катализаторы гидрогенизационых процессов в нефтепереработке и
Дезактивация катализаторов в каталитических реакторах.
Методы исследования состава и структуры поверхности катализаторов.
Структура механических катализаторов. Кластеры.
Закономерности подбора катализаторов для разных реакций.
Синтез Фишера – Тропша, конструкция реакторных устройств.
Реакторы синтеза метанола и получение из него бензина.
Учебно-методическое обеспечение дисциплины
1. Крылов О.В. Гетерогенный катализ М.: ИКЦ «Академкнига»,
Учебно-методическое обеспечение дисциплины
1. Крылов О.В. Гетерогенный катализ М.: ИКЦ «Академкнига»,
2. Боресков Г.К. Гетерогенный катализ М.: Наука 1984.-520 с.
3. Саттерфилд Н. Практический курс гетерогенного катализа М.: Мир,1984.-520 с.
4. Ахметов С.А. Технология глубокой переработки нефти и газа. Уфа.: Гилем, 2002.-671 с.
5. Стефогло Е.Ф. Газожидкостные реакторы с суспендированным катализатором. Новосибирск: Наука, 1990,-232 с.
6. Дидушинский А.Я. Основы проектирования каталитических реакторов. М.: Химия, 1972,-376 с.
7. Радченко Е.Д., Нефедов Б.К., Алиев Р.Р. Катализаторы процессов углубленной переработки нефти. М.: Химия, 1992.-207 с.
8. Вольтер Б.В., Сальников И.Б. Устойчивость режимов работы химических реакторов. М.: Химия, 1981.-200 с.
9. Соколов В.Н., Бушков М.Д. Химические реакторы. Л.: 1980.-60 с.
10. Сороко В.Е., Масленникова И.С., Луцко Ф.Н. Основы химической технологии: Управление химико-технологическими процессами. СПб. 2004.214с.
11. Капустин В.М., Сюняев З.И. Дисперсные состояния в каталитических системах нефтепереработки. М.: Химия 1992.-151 с
12. Радченко Е.Д., Чукин Г.Д.. Алиев Р.Р. Цеолитсодержащие катализаторы в нефтепереработке. М.: Химия 1993.-278 с
Лекция 1
Краткий исторический очерк.
Основные этапы развития катализа.
Феноменология катализа.
Роль
Лекция 1
Краткий исторический очерк.
Основные этапы развития катализа.
Феноменология катализа.
Роль
Важнейшие понятия и термины катализа.
Гетерогенный и гомогенный катализ.
Роль гетерогенного катализа в процессах нефтехимии и нефтепереработки.
Основные определения
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в
Основные определения
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в
Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Каталитические реакции - реакции, протекающие в присутствии катализаторов.
Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) - при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного - снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия.
Катализаторы, замедляющие химическую реакцию, называются ингибиторами.
Краткий исторический очерк
И. Берцелиус (1837): «Известные вещества оказывают при соприкосновении с
Краткий исторический очерк
И. Берцелиус (1837): «Известные вещества оказывают при соприкосновении с
М. Фарадей (1840). «Каталитические явления можно объяснить известными свойствами материи, не снабжая ее при этом никакой новой силой».
П. Рашиг (1906): «Катализ представляет вызываемое внешними причинами изменение строения молекулы, имеющее следствием изменение химических свойств».
Э. Абель (1913): «Я пришел к выводу, что катализ осуществляется в результате реакции, а не простого присутствия вещества».
Л. Гурвич (1916): «Каталитически действующие тела, притягивая к себе движущиеся молекулы гораздо сильнее, чем тела, лишенные каталитического действия, тем самым увеличивают силу удара, попадающих на их поверхность молекул».
Г. К. Боресков (1968): «Когда-то катализ рассматривался как особое, немного таинственное явление, со специфическими законами, раскрытие которых должно было сразу в общей форме решить задачу подбора. Сейчас мы знаем, что это не так. Катализ по своей сущности - химическое явление. Изменение скорости реакции при каталитическом воздействии обусловлено промежуточным химическим взаимодействием реагирующих веществ с катализатором».
Виды катализа
В зависимости от того, находится катализатор в той же фазе,
Виды катализа
В зависимости от того, находится катализатор в той же фазе,
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
Н О + I = H O + IO
Н O + IO = Н O + O + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела - катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель. Механизм гетерогенного катализа сложнее, чем у гомогенного.
Механизм гетерогенного катализа
Механизм гетерогенного катализа включает пять стадий, причем все они
Механизм гетерогенного катализа
Механизм гетерогенного катализа включает пять стадий, причем все они
1. Диффузия реагирующих веществ к поверхности твердого вещества.
2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их.
3. Химическая реакция между реагирующими молекулами.
4. Десорбция продуктов с поверхности катализатора.
5. Диффузия продукта с поверхности катализатора в общий поток.
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Сопутствующие материалы
Промоторы (или активаторы) - вещества, повышающие активность катализатора. При этом
Сопутствующие материалы
Промоторы (или активаторы) - вещества, повышающие активность катализатора. При этом
Каталитические яды - посторонние примеси в реакционной смеси, приводящие к частичной или полной потере активности катализатора. Так, следы мышьяка, фосфора вызывают быструю потерю катализатором V2O5 активности (контактный метод производства H2SO4 ).
Энергетический барьер
Все каталитические реакции - самопроизвольный процесс, т.е. протекают в
Энергетический барьер
Все каталитические реакции - самопроизвольный процесс, т.е. протекают в
Известно, что молекулы неионогены вступают в реакцию гораздо реже, чем сталкиваются друг с другом. Аррениус объяснил этот факт, предположив, что молекулы могут реагировать лишь в том случае, если в момент столкновения они обладают запасом энергии не ниже некоторой критической величины. В этом случае они называются «активными молекулами».
А. Резчик, 1945 г. « Для описания каталитических реакций существует теория абсолютных скоростей реакций, начало которой было положено теоретическими исследованиями Поляни в 1931 г.».
Закон химической кинетики, известный под названием закона Аррениуса (1889). Закон связывает константу скорости реакции с некоторой характерной для данной реакции энергетической характеристикой, называемой энергией активации Е.
где k0 - константа, или предэкспоненциальный множитель;
R - газовая постоянная, равная 1,987 кал/град*моль
(8,31 Дж/град*моль)', Т - температура в градусах шкалы Кельвина;
е - основание натуральных логарифмов.
(1)
Нахождение величины энергии активации Е
Чтобы найти величину энергии активации Е, изучают
Нахождение величины энергии активации Е
Чтобы найти величину энергии активации Е, изучают
(2)
строят график зависимости Ln(k) от 1/Т и определяют угловой коэффициент, который равен Е/R. Обычно используют не натуральные, а десятичные логарифмы .
(3)
(Последнее число - модуль перевода натуральных логарифмов в десятичные, умноженный на величину R = l.987.)
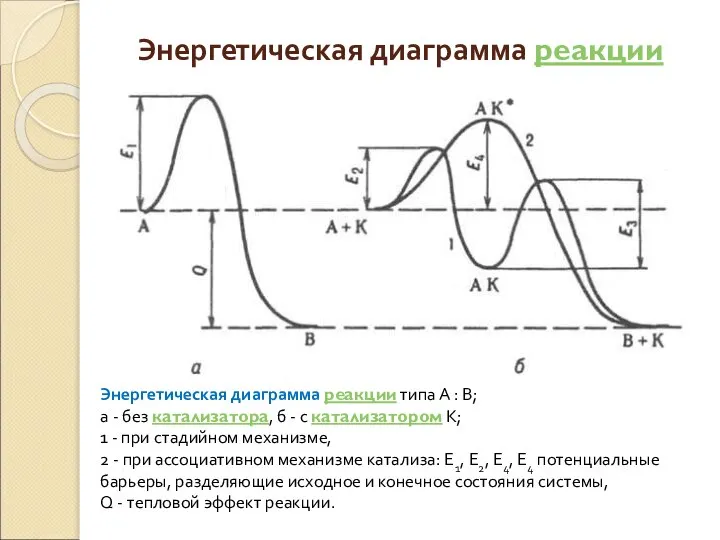
Энергетическая диаграмма реакции
Энергетическая диаграмма реакции типа А : В;
а -
Энергетическая диаграмма реакции
Энергетическая диаграмма реакции типа А : В;
а -
1 - при стадийном механизме,
2 - при ассоциативном механизме катализа: E1, E2, E4, E4 потенциальные барьеры, разделяющие исходное и конечное состояния системы,
Q - тепловой эффект реакции.
ОСНОВНЫЕ ТИПЫ ГЕТЕРОГЕННЫХ КАТАЛИЗАТОРОВ
В гетерогенном катализе (Г.к.) как и в
ОСНОВНЫЕ ТИПЫ ГЕТЕРОГЕННЫХ КАТАЛИЗАТОРОВ
В гетерогенном катализе (Г.к.) как и в
окислительно-восстановительные, при которых роль катализатора сводится к участию в переносе неспаренных электронов, и кислотно-основные, при которых взаимодействие катализатора с реагирующими веществами сопровождается переходом протона или электронных пар. Окислительно-восстановительный катализ происходит на поверхности металлов или полупроводников, т.е. веществ, способных передавать или принимать неспаренные электроны от реагирующих молекул.
Кислотно-основные реакции протекают на поверхности твердых кислот или оснований, способных передавать или принимать протон от реагентов или же способных к химическому взаимдействию с реагентами без разделения пары электронов.
КАТАЛИЗАТОРЫ-ПОЛУПРОВОДНИКИ
Согласно электронной теории Г. к., каталитическая активность полупроводников связана с объемной
КАТАЛИЗАТОРЫ-ПОЛУПРОВОДНИКИ
Согласно электронной теории Г. к., каталитическая активность полупроводников связана с объемной
где : е-электрон катализатора, - свободная дырка.
Поскольку объемная концентрация носителей тока зависит от положения уровня Ферми и изменяется при всяком сдвиге последнего, предполагалась возможность регулирования каталитической активности полупроводника смещением уровня Ферми. Дальнейшие исследования, однако, не подтвердили существования электронного равновесия между поверхностью и объемом катализатора-полупроводника в условиях Г. к. Экспериментально установлен ряд корреляций каталитической активности полупроводников с проводимостью п- или р-типа с их свойствами. В частности, известна корреляция константы скорости Г. к. с шириной запрещенной зоны :
где а и b- эмпирии, постоянные.
4
Основные полупроводниковые катализаторы - соединения элементов VI гр. Периодической системы (О,
Основные полупроводниковые катализаторы - соединения элементов VI гр. Периодической системы (О,
Напр., Мо в оксидах может иметь степени окисления Мо2 + , Мо3 + , Мо4 + , Мо5+ и Мо6+, поэтому он легко окисляется и восстанавливается в условиях Г. к., обеспечивая тем самым каталитический цикл. Важно также наличие у поверхностных атомов переходных металлов низкоэнергетических d-орбиталей разной симметрии. Это позволяет связать каталитическую активность их оксидов и сульфидов с электронной конфигурацией орбиталей, а также с возможностью образования промежуточных поверхностных соединений типа комплексных.
КАТАЛИЗАТОРЫ-ПОЛУПРОВОДНИКИ
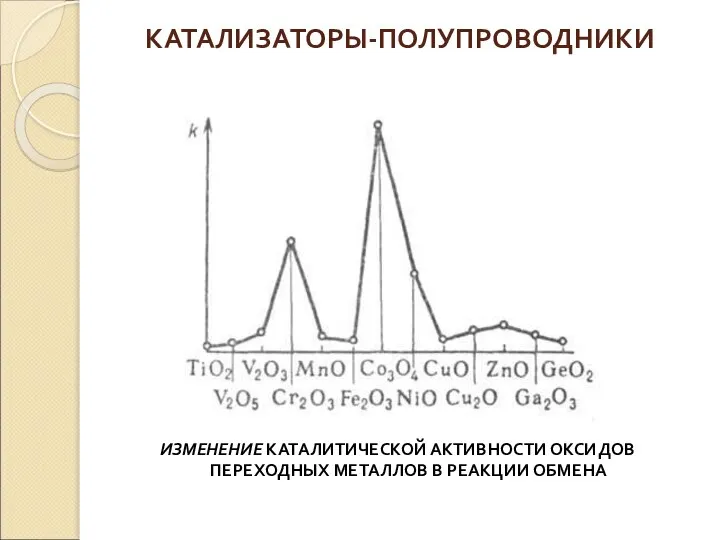
ИЗМЕНЕНИЕ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ОКСИДОВ ПЕРЕХОДНЫХ МЕТАЛЛОВ В РЕАКЦИИ ОБМЕНА
КАТАЛИЗАТОРЫ-ПОЛУПРОВОДНИКИ
ИЗМЕНЕНИЕ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ОКСИДОВ ПЕРЕХОДНЫХ МЕТАЛЛОВ В РЕАКЦИИ ОБМЕНА
КАТАЛИЗАТОРЫ-ПОЛУПРОВОДНИКИ
КАТАЛИЗАТОРЫ-МЕТАЛЛЫ
Металлы обычно значительно активнее оксидов и обладают более универсальным каталитическим действием,
КАТАЛИЗАТОРЫ-МЕТАЛЛЫ
Металлы обычно значительно активнее оксидов и обладают более универсальным каталитическим действием,
Металлы, находящиеся в конце переходных периодов, имеют в d-оболочке дырки (отсутствие
Металлы, находящиеся в конце переходных периодов, имеют в d-оболочке дырки (отсутствие
КАТАЛИЗАТОРЫ-МЕТАЛЛЫ
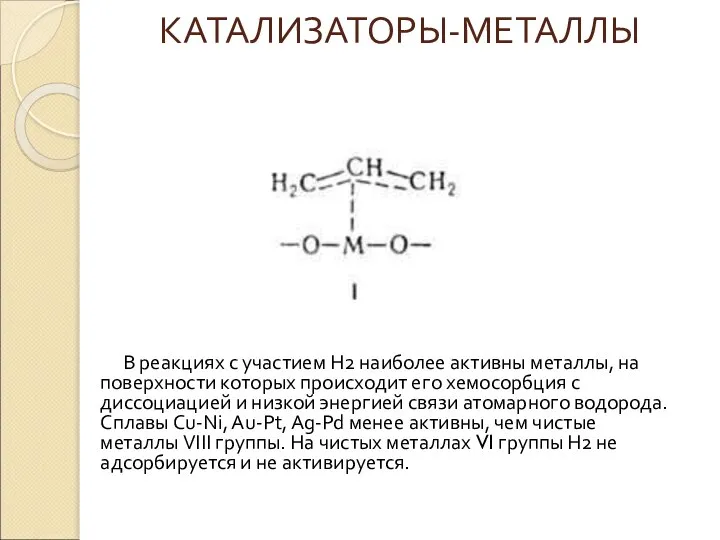
В реакциях с участием Н2 наиболее активны металлы, на поверхности которых
В реакциях с участием Н2 наиболее активны металлы, на поверхности которых
КАТАЛИЗАТОРЫ-МЕТАЛЛЫ
КАТАЛИЗ НА ТВЕРДЫХ КИСЛОТАХ
И ОСНОВАНИЯХ
Для катализаторов кислотно-основного типа специфика твердого
КАТАЛИЗ НА ТВЕРДЫХ КИСЛОТАХ
И ОСНОВАНИЯХ
Для катализаторов кислотно-основного типа специфика твердого
Смешанные катализаторы
В реакциях кислотно-основного типа (крекинг, дегидратация, изомеризация и др.) высокой
Смешанные катализаторы
В реакциях кислотно-основного типа (крекинг, дегидратация, изомеризация и др.) высокой

















 Химические методы определения U, Pu, Th
Химические методы определения U, Pu, Th Метасоматический процесс
Метасоматический процесс Теоретические и экспериментальные методы исследования в химии
Теоретические и экспериментальные методы исследования в химии Карбон кыш
Карбон кыш Титрування. Хімічний посуд в титриметричному аналізі
Титрування. Хімічний посуд в титриметричному аналізі Полезные продукты на основе 4-хлоризотиазолов
Полезные продукты на основе 4-хлоризотиазолов Органическая химия. Глицерин
Органическая химия. Глицерин Синтетичні лікарські препарати
Синтетичні лікарські препарати  Семь чудес света и роль металлов в их создании
Семь чудес света и роль металлов в их создании Принципы защиты от коррозии
Принципы защиты от коррозии Полярные электронные эффекты в органических соединениях
Полярные электронные эффекты в органических соединениях Хроматографія. Мікрогетерогенні дисперсні системи
Хроматографія. Мікрогетерогенні дисперсні системи Радиохимия аспиранты
Радиохимия аспиранты Неорганические вещества. Минеральные соли и кислоты
Неорганические вещества. Минеральные соли и кислоты Требование к оформлению отчета лабораторной работы
Требование к оформлению отчета лабораторной работы Структура основных тканей зуба. (Лекция 2)
Структура основных тканей зуба. (Лекция 2) Презентация по Химии "карбон кышкылдары" - скачать смотреть
Презентация по Химии "карбон кышкылдары" - скачать смотреть  Влияние растворителя на процесс комплексообразования
Влияние растворителя на процесс комплексообразования Изохинолин туындыларының дәрілік заттарын талдау
Изохинолин туындыларының дәрілік заттарын талдау Виды твердых тел
Виды твердых тел Конденсированные пятичленные гетероциклы с одним гетероатомом. Индол
Конденсированные пятичленные гетероциклы с одним гетероатомом. Индол В мире минералов и горных пород
В мире минералов и горных пород Нафтопереробна промисловість України
Нафтопереробна промисловість України  Виды присадок к моторным топливам
Виды присадок к моторным топливам Презентация по Химии "Вода для жизни!" - скачать смотреть бесплатно
Презентация по Химии "Вода для жизни!" - скачать смотреть бесплатно Строение электронной оболочки атома
Строение электронной оболочки атома Теория растворов (лекция 1)
Теория растворов (лекция 1) Презентация по Химии "Химический КВН" - скачать смотреть
Презентация по Химии "Химический КВН" - скачать смотреть