Содержание
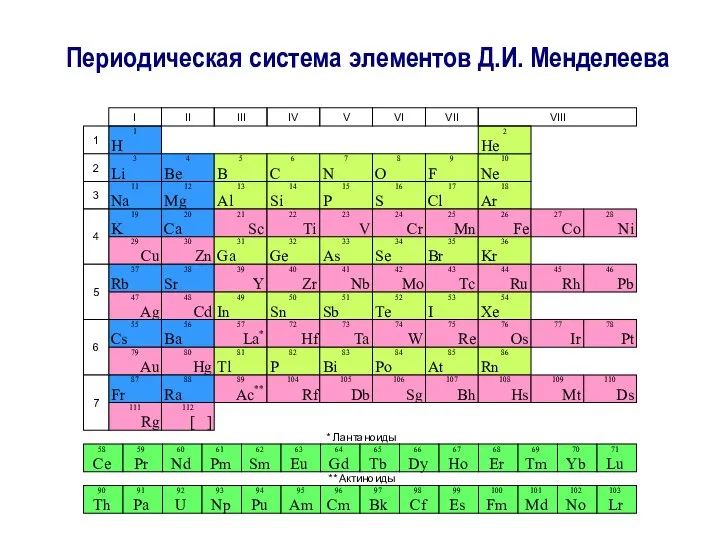
- 2. Периодическая система элементов Д.И. Менделеева
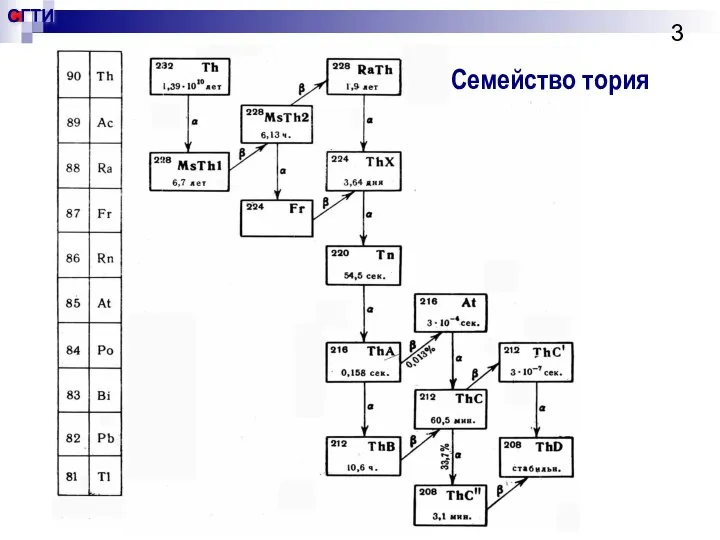
- 3. Семейство тория
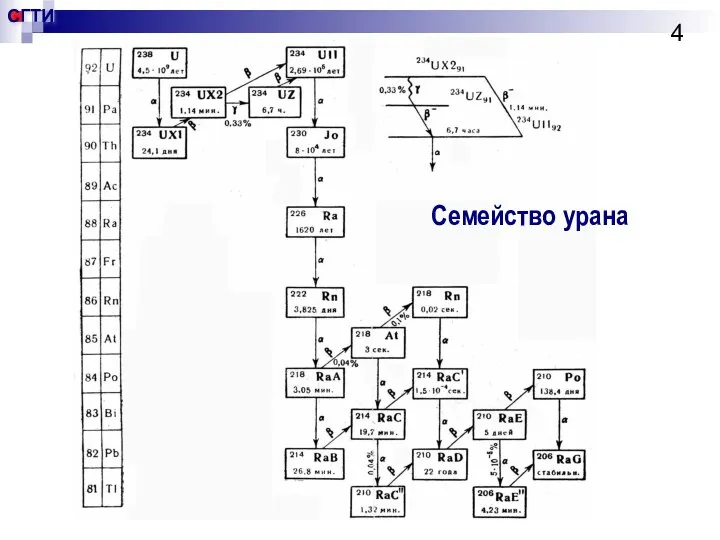
- 4. Семейство урана
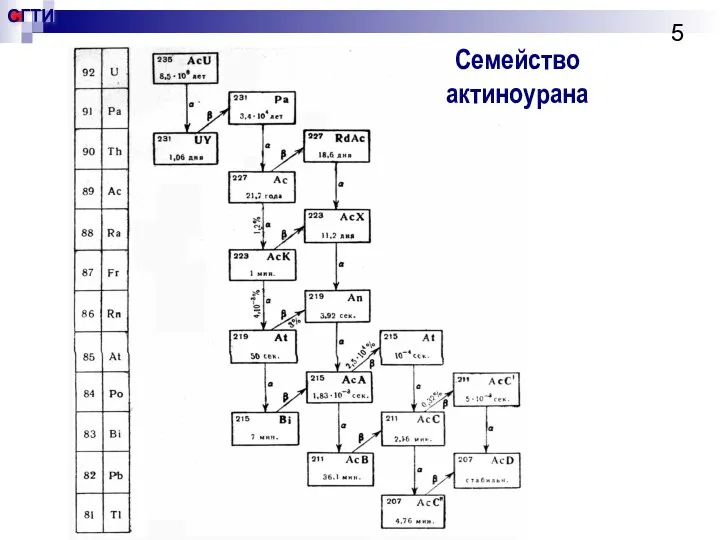
- 5. Семейство актиноурана
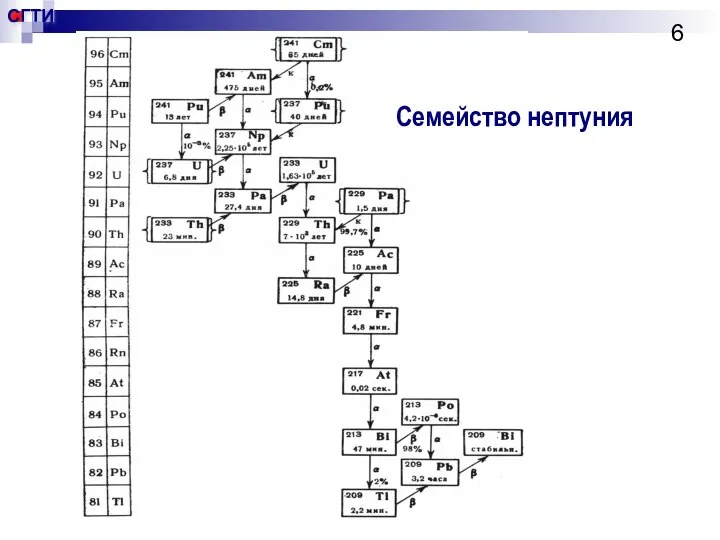
- 6. Семейство нептуния
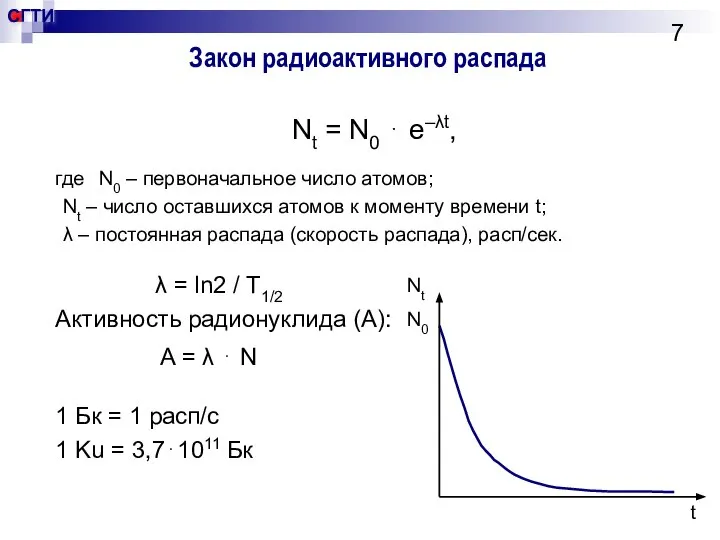
- 7. Закон радиоактивного распада Nt = N0 ⋅ e–λt, где N0 – первоначальное число атомов; Nt –
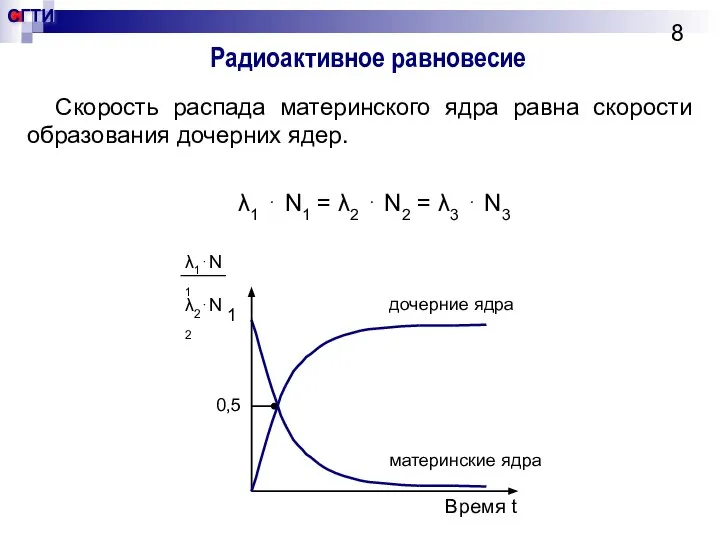
- 8. Радиоактивное равновесие Скорость распада материнского ядра равна скорости образования дочерних ядер. λ1 ⋅ N1 = λ2
- 9. Пример Вычислить активность 1 г. U-238, свободного от продуктов распада и сравнить с активностью такого же
- 10. Пример Ответ:
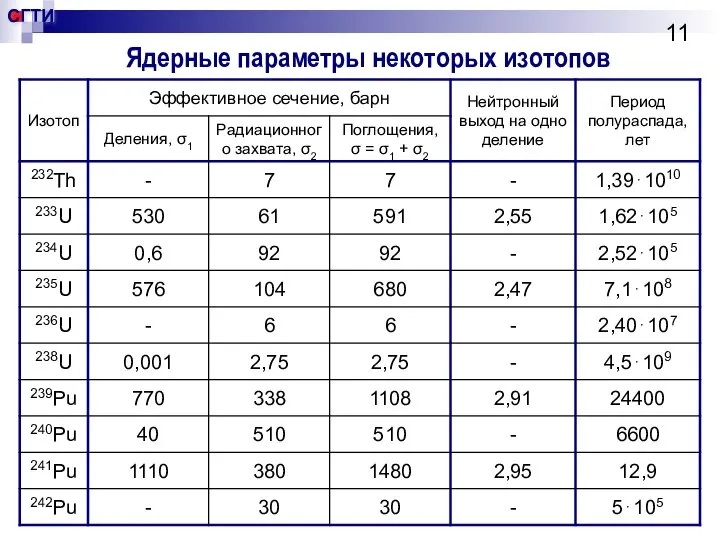
- 11. Ядерные параметры некоторых изотопов
- 12. Эффективное сечение захвата Эффективное сечение захвата может меняться от 10–20 до 10–32 см2/атом. Истинная площадь сечения
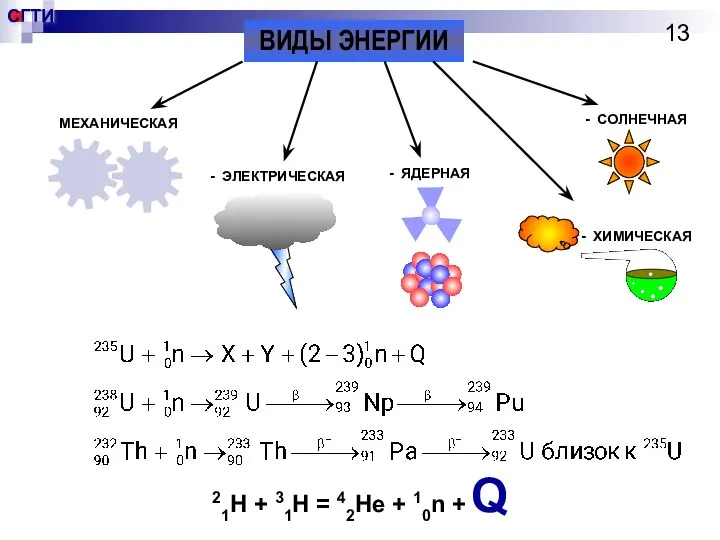
- 13. ВИДЫ ЭНЕРГИИ МЕХАНИЧЕСКАЯ - ЭЛЕКТРИЧЕСКАЯ - ЯДЕРНАЯ - СОЛНЕЧНАЯ - ХИМИЧЕСКАЯ 21H + 31H = 42He
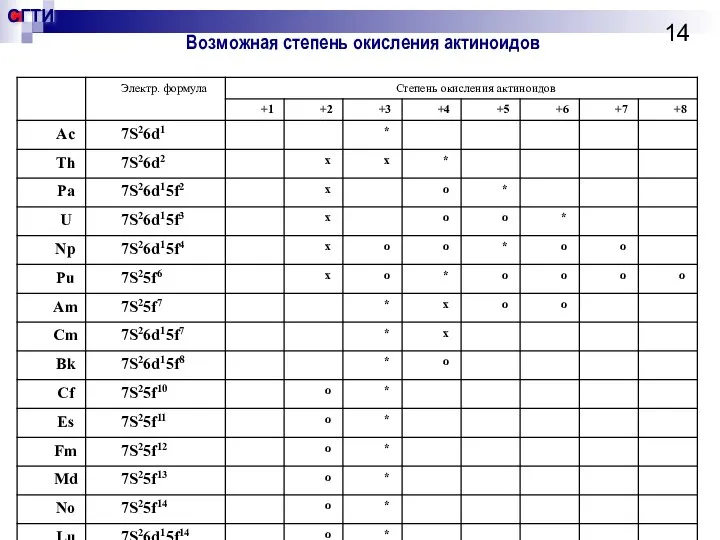
- 14. Возможная степень окисления актиноидов
- 15. Общая характеристика актиноидных элементов 1 Наиболее устойчивая степень окисления растет от Ac до U, а затем
- 16. Химические и физико-химические свойства урана и его соединений Уран открыт Клапротом в 1789 году. Известно 14
- 17. Уран металлический t пл. = 1132 0С t кип. = 3818 0С d = 19,05 г/см3
- 18. Химические свойства урана 6s26p66d1 5 f3 7s2
- 19. Соединения урана Оксиды: UO, UO2, U3O8, UO3, UO4 · 2H2O
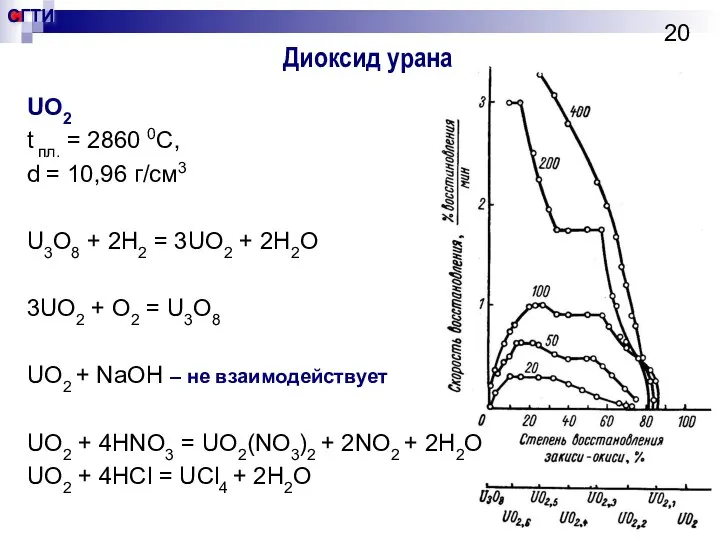
- 20. Диоксид урана UO2 t пл. = 2860 0С, d = 10,96 г/см3 U3O8 + 2H2 =
- 21. Октаоксид триурана U3O8 или UO2 · 2UO3 , или UO3 · U2O5 Имеет 4 модификации α,
- 22. Триоксид урана UO3 имеет 6 кристаллических модификаций
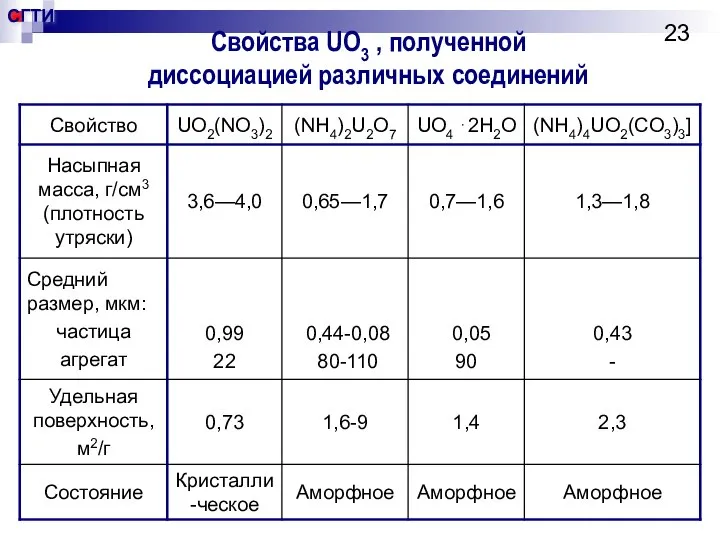
- 23. Свойства UO3 , полученной диссоциацией различных соединений
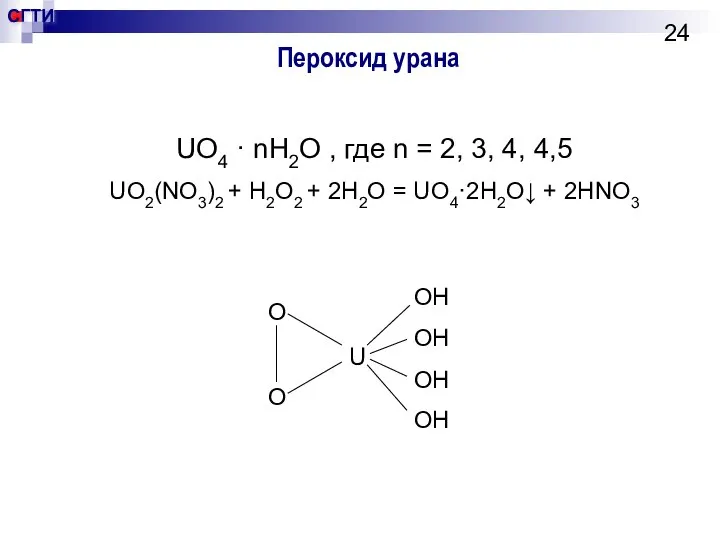
- 24. Пероксид урана UO4 · nH2O , где n = 2, 3, 4, 4,5 UO2(NO3)2 + H2O2
- 25. Фториды урана
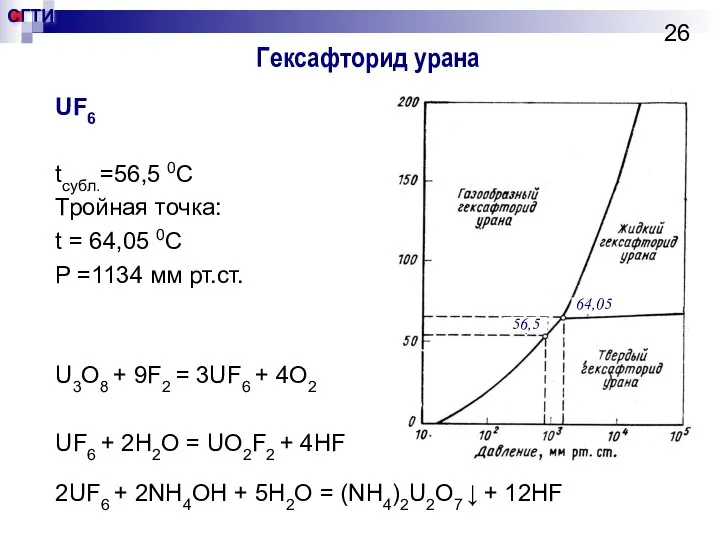
- 26. Гексафторид урана UF6 tсубл.=56,5 0С Тройная точка: t = 64,05 0С P =1134 мм рт.ст. U3O8
- 27. Водные растворы урана В щелочной среде: Получение уранатов: 2UO2(NO3)2 + 6NH4OH = (NH4)2U2O7↓ + 4NH4NO3 +
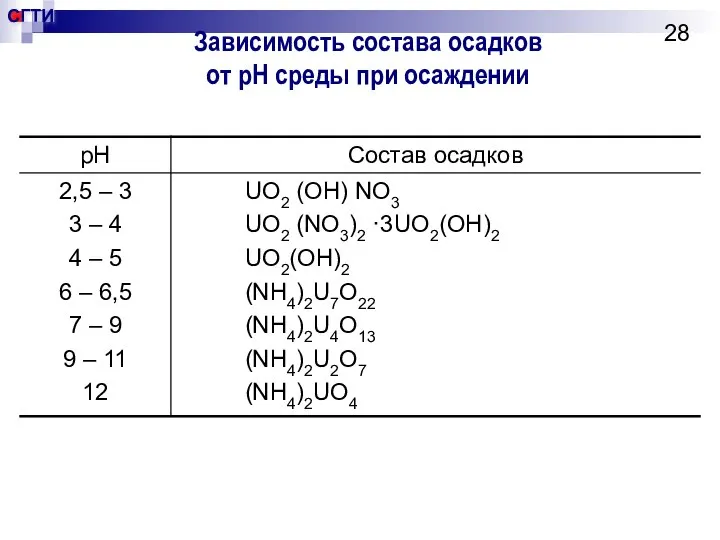
- 28. Зависимость состава осадков от pH среды при осаждении
- 29. Соли уранила UO2(NO3)2·6H2O UO2CO3 - труднорастворим UO2C2O4·3H2O – растворимость (0,47%) UO2 (CH3 COO)2 – растворимость (7,7
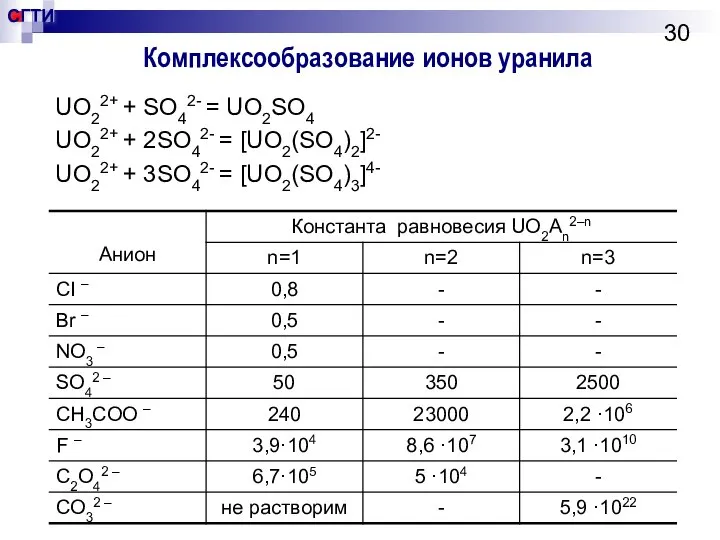
- 30. Комплексообразование ионов уранила UO22+ + SO42- = UO2SO4 UO22+ + 2SO42- = [UO2(SO4)2]2- UO22+ + 3SO42-
- 31. Методы выделения и разделения радионуклидов 1 Соосаждение 2 Ионообменный 3 Хроматографический 4 Экстракционный 5 Электрохимический
- 32. Соосаждение Это процесс, в котором микрокомпонент увлекается из раствора макрокомпонентом – носителем. Применяется в том случае,
- 33. Изоморфизм Изоморфными являются одинаковые по химическому составу вещества, сходных по свойствам химических элементов, которые кристаллизуются в
- 34. 4 Гриммовские смешанные кристаллы - изоморфизм по Гримму-Гольдшмидту (Г-Г). Возникновение участков кристаллов одного компонента в другом.
- 35. ЗАКОН ХЛОПИНА Если два вещества являются изоморфными или изодиморфными и концентрация одного из них мала, то
- 36. Уравнение Гендерсона и Кречека Более удобное для практических целей выражение: х/у=Д(Х-х)/(У-у); где: Х и х -
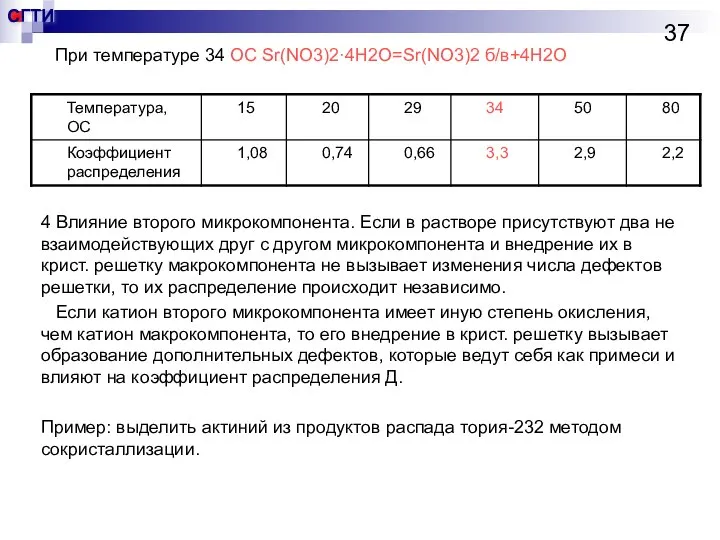
- 37. При температуре 34 OC Sr(NO3)2·4H2O=Sr(NO3)2 б/в+4H2O 4 Влияние второго микрокомпонента. Если в растворе присутствуют два не
- 38. АДСОРБЦИЯ Виды адсорбции: молекулярная и ионная. Молекулярная адсорбция происходит за счет сил Ван-дер-Ваальса и подчиняется законам
- 39. АДСОРБЦИЯ Ионная адсорбция происходит на: мелкокристаллических осадках, активированном угле, ионообменных материалах, частицах суспензий и коллоидов, силикагелях
- 40. I – кристалл ; II – внутренняя часть двойного слоя (потенциал определяющая адсорбция); III – внутренняя
- 41. Пример разделения на адсорбционном носителе Пример: Отделить Th-234 от U-238 и продуктов его распада методом адсорбционного
- 42. Экстракционный метод разделения Метод основан на различии в устойчивости констант комплексообразования разделяемых радионуклидов с экстрагентом. Классификация
- 43. Фосфорорганические экстрагенты
- 44. Механизмы экстракции различными классами экстрагентов экстракция нейтральными экстрагентами . Для нейтральных ФОС характерно наличие высокого дипольного
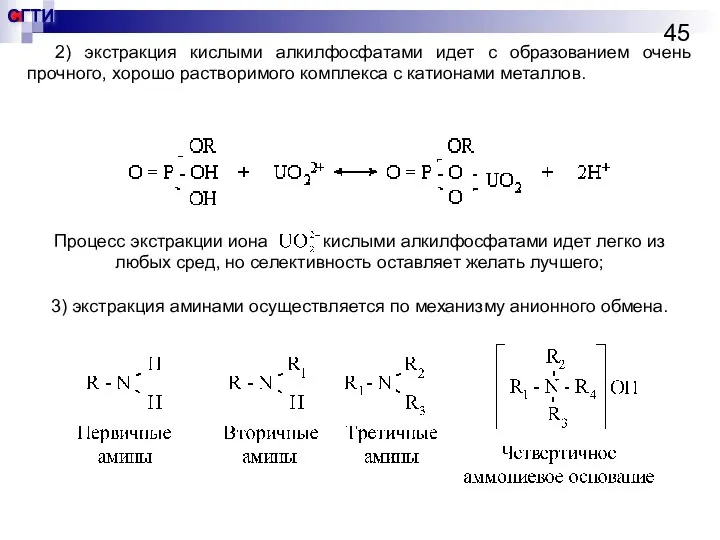
- 45. 2) экстракция кислыми алкилфосфатами идет с образованием очень прочного, хорошо растворимого комплекса с катионами металлов. Процесс
- 46. Экстракция аминами Экстракция аминами протекает в течение нескольких секунд и только тогда, когда водная фаза содержит
- 47. Равновесие экстракции Пример экстракции нейтральным экстрагентом Константа равновесия: Связь константы равновесия с коэффициентом распределения D: -
- 48. Факторы, влияющие на коэффициент распределения урана Так как процесс экзотермический, то повышение температуры будет смещать равновесие
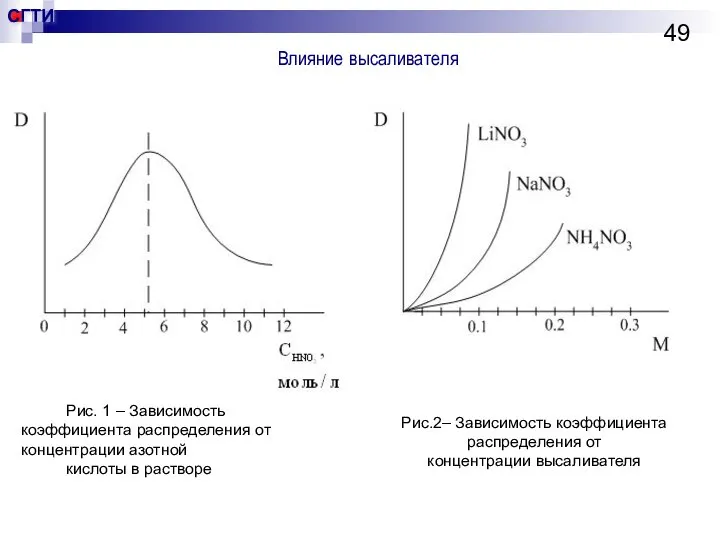
- 49. Влияние высаливателя Рис. 1 – Зависимость коэффициента распределения от концентрации азотной кислоты в растворе Рис.2– Зависимость
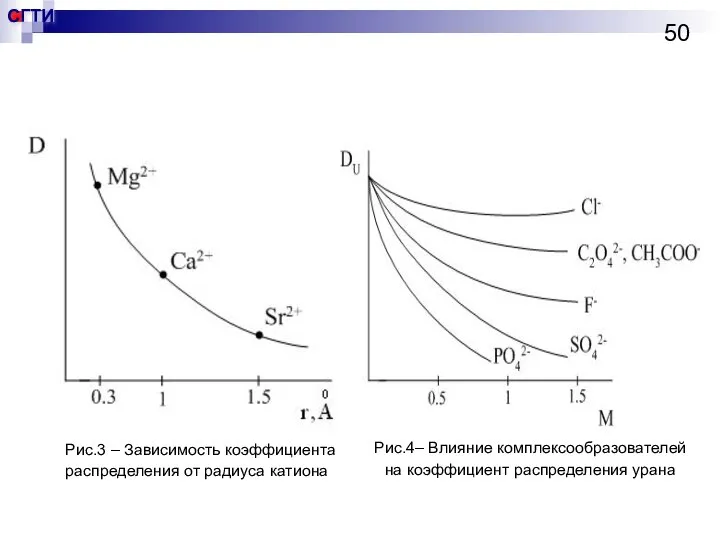
- 50. Рис.3 – Зависимость коэффициента распределения от радиуса катиона Рис.4– Влияние комплексообразователей на коэффициент распределения урана
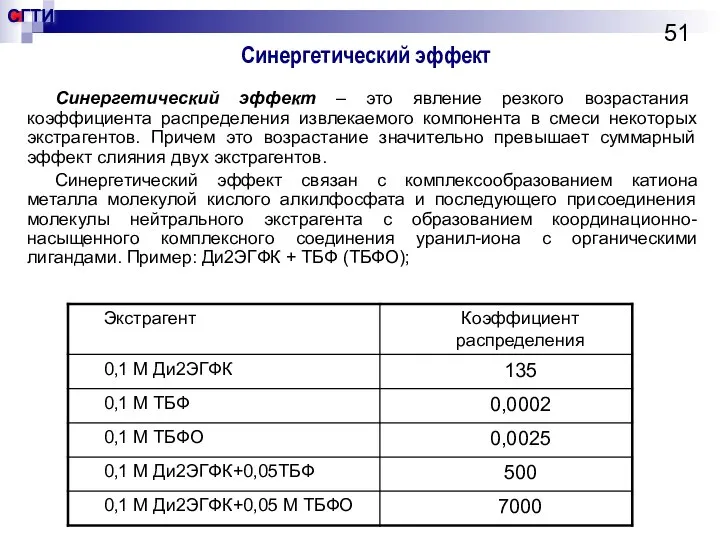
- 51. Синергетический эффект Синергетический эффект – это явление резкого возрастания коэффициента распределения извлекаемого компонента в смеси некоторых
- 52. Кинетика экстракции Равенство потоков вещества в водной и органической фазах: Схема массопереноса из водной фазы в
- 53. Ионообменный метод разделения Метод разделения основан на различии в устойчивости связей сорбируемого иона с ионитом. Ионит
- 54. Классификация ионитов по Никольскому Рис. 1 – Зависимость обменной емкости от рН раствора По степени диссоциации
- 55. Равновесие ионного обмена Катионный обмен Анионный обмен Переведем анионит в Сl-форму:
- 56. Селективность ионного обмена Селективность ионного обмена определяется двумя факторами: 1) валентностью и радиусом обменивающихся ионов в
- 57. с высоким удельным зарядом. Карбоксильные группы слабокислого катионита из-за малых размеров имеют сильное поле и удерживают
- 58. Кинетика ионного обмена Внешнедиффузионная область где К - константа скорости; - концентрация сорбируемого иона в растворе;
- 59. Так как практически для всех реакций ионного обмена скорость химической реакции высока, а зерно ионита имеет
- 60. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ВЫДЕЛЕНИЯ ЦЕМЕНТАЦИЯ; ЭЛЕКТРОЛИЗ; ЭЛЕКТРОМИГРАЦИЯ. Метод цементации включает протекание двух реакций: окисления металла электрода и
- 61. Метод электролиза Возможность выделения радионуклида на электроде определяется соотношением его критического потенциала осаждения и потенциала водородного
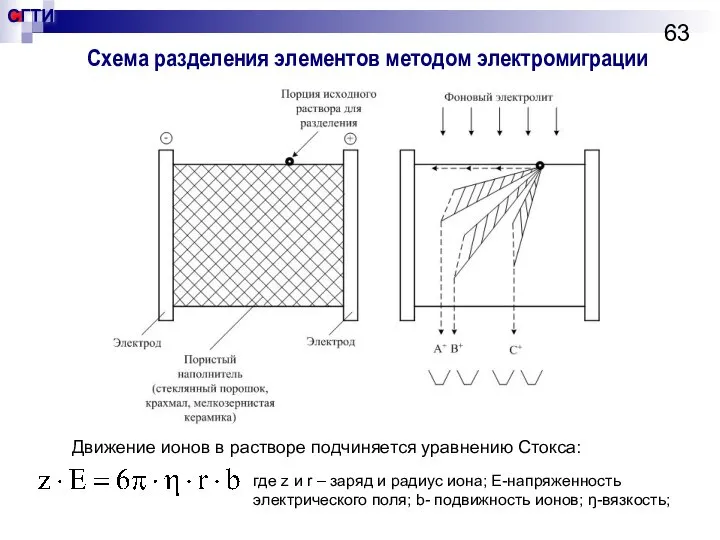
- 62. Метод электромиграции Основан на различии в скоростях движения ионов в электрическом поле. В свою очередь подвижность
- 63. Схема разделения элементов методом электромиграции Движение ионов в растворе подчиняется уравнению Стокса: где z и r
- 65. Скачать презентацию








































 Көміртек
Көміртек Оксиды, свойства и способы получения
Оксиды, свойства и способы получения Аттестационная работа. Мини-проекты на уроках химии. 8 класс
Аттестационная работа. Мини-проекты на уроках химии. 8 класс Поделочный камень родонит
Поделочный камень родонит Сурьма Работу выполнила: Ученица 9»Г» класса Ваулина Оксана
Сурьма Работу выполнила: Ученица 9»Г» класса Ваулина Оксана Интернет-тренажеры
Интернет-тренажеры Презентация по Химии "Железо20031" - скачать смотреть бесплатно
Презентация по Химии "Железо20031" - скачать смотреть бесплатно Понятие о спиртах
Понятие о спиртах Пиридин. Строение пиридина
Пиридин. Строение пиридина Железо и его соединения
Железо и его соединения ХІМІЯ В КОСМЕТИЦІ
ХІМІЯ В КОСМЕТИЦІ  Особенности коррозии в морской воде
Особенности коррозии в морской воде Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Значение органической химии Кондрашов Алексей | 9 А класс
Значение органической химии Кондрашов Алексей | 9 А класс  Химическая связь и строение органических соединений
Химическая связь и строение органических соединений Способы количественного определения белка
Способы количественного определения белка Введение в биохимию. Значение биохимии для врача. Химия белка
Введение в биохимию. Значение биохимии для врача. Химия белка Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни
Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни Гидролиз солей урок химии (11 класс) частный случай реакции ионного обмена одно из химических свойств солей
Гидролиз солей урок химии (11 класс) частный случай реакции ионного обмена одно из химических свойств солей История появления стекла и все сведения о нем Цель: 1.Узнать о теории происхождения стекла. 2..Изучить состав стекла. 3.Ознакоми
История появления стекла и все сведения о нем Цель: 1.Узнать о теории происхождения стекла. 2..Изучить состав стекла. 3.Ознакоми Презентация по химии Гидролиз
Презентация по химии Гидролиз  Феноли (бензенол)
Феноли (бензенол) Предмет и задачи биохимии. Белки. (Лекция 1)
Предмет и задачи биохимии. Белки. (Лекция 1) Лигандообменные равновесия и процессы. Строение комплексных соединений
Лигандообменные равновесия и процессы. Строение комплексных соединений Основные понятия и законы химии
Основные понятия и законы химии Карбоновые кислоты
Карбоновые кислоты Многоатомные спирты
Многоатомные спирты Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия
Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия