Содержание
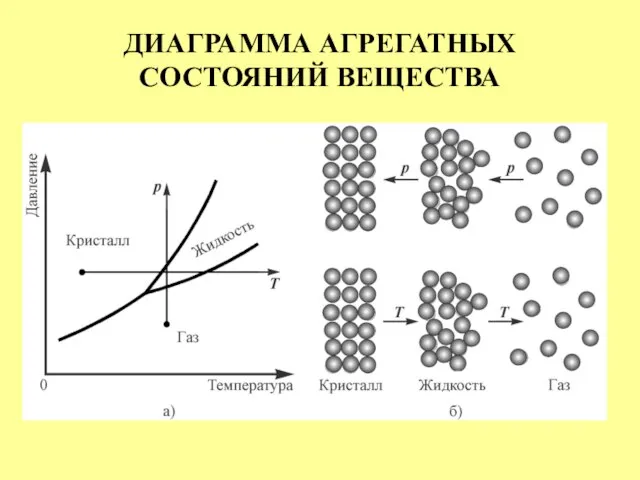
- 3. ДИАГРАММА АГРЕГАТНЫХ СОСТОЯНИЙ ВЕЩЕСТВА
- 4. ДИАГРАММА АГРЕГАТНЫХ СОСТОЯНИЙ ВЕЩЕСТВА
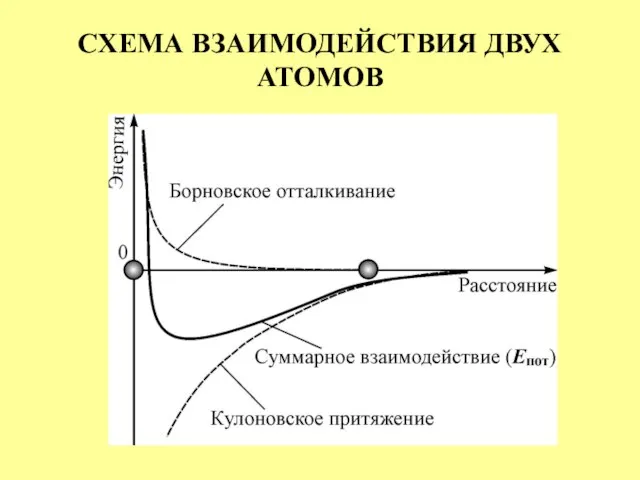
- 5. СХЕМА ВЗАИМОДЕЙСТВИЯ ДВУХ АТОМОВ
- 6. Объединение атомов в молекулу происходит самопроизвольно благодаря взаимной поляризации. Сила кулоновского притяжения атомов обратно пропорциональна R5,
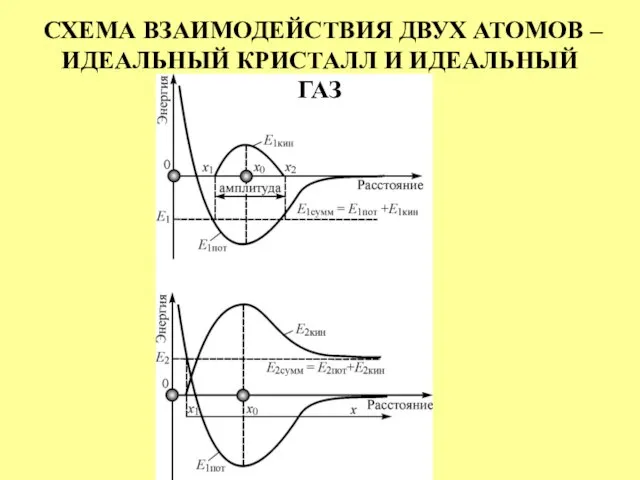
- 7. СХЕМА ВЗАИМОДЕЙСТВИЯ ДВУХ АТОМОВ – ИДЕАЛЬНЫЙ КРИСТАЛЛ И ИДЕАЛЬНЫЙ ГАЗ
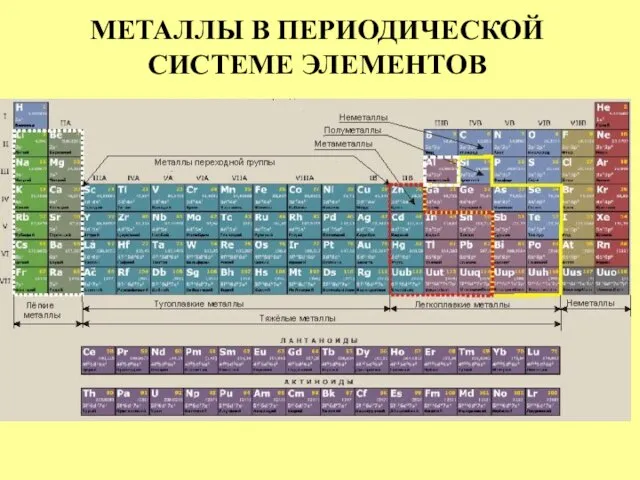
- 8. МЕТАЛЛЫ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ ЭЛЕМЕНТОВ
- 9. МЕТАЛЛЫ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ ЭЛЕМЕНТОВ
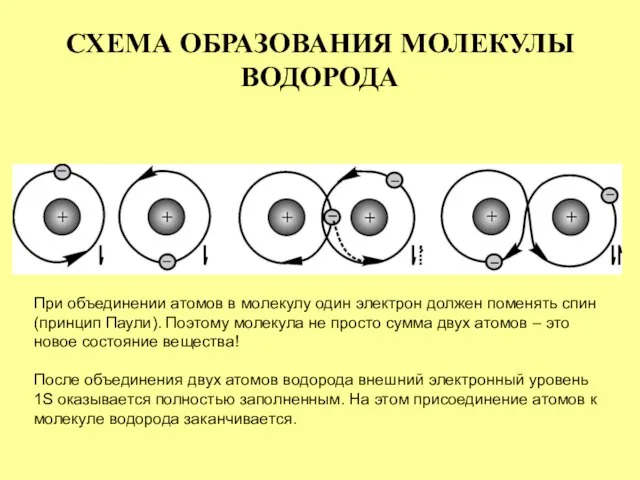
- 10. СХЕМА ОБРАЗОВАНИЯ МОЛЕКУЛЫ ВОДОРОДА При объединении атомов в молекулу один электрон должен поменять спин (принцип Паули).
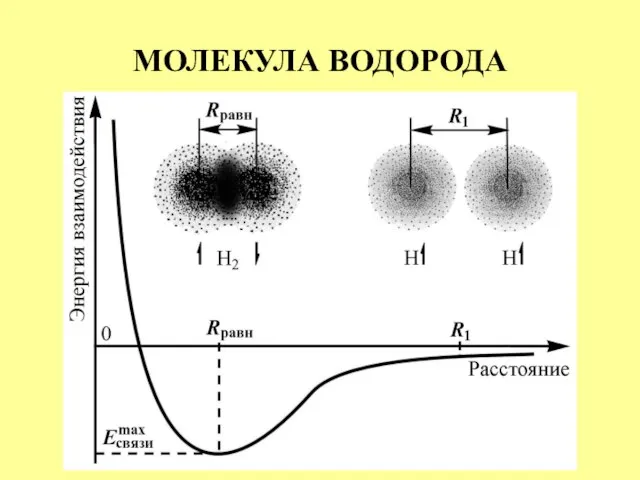
- 11. МОЛЕКУЛА ВОДОРОДА
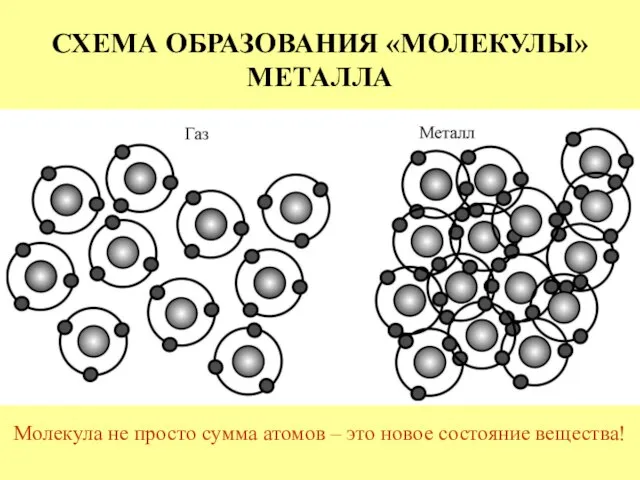
- 12. СХЕМА ОБРАЗОВАНИЯ «МОЛЕКУЛЫ» МЕТАЛЛА Молекула не просто сумма атомов – это новое состояние вещества!
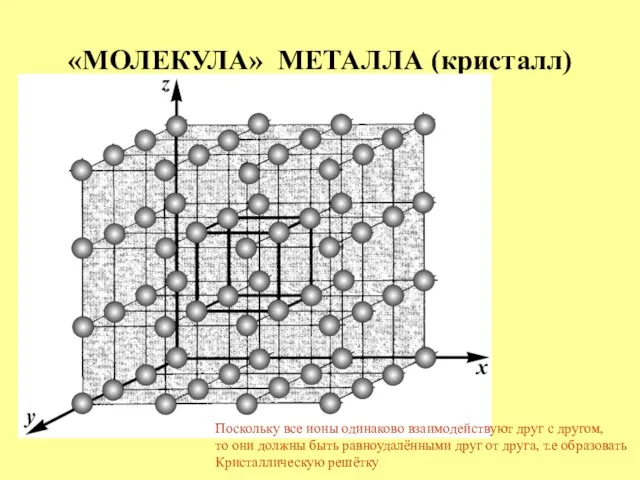
- 13. «МОЛЕКУЛА» МЕТАЛЛА (кристалл) Поскольку все ионы одинаково взаимодействуют друг с другом, то они должны быть равноудалёнными
- 14. Модель П. Друде Кристаллическая решётка металлов состоит из двух подсистем: 1) остова, образованного положительными ионами; 2)
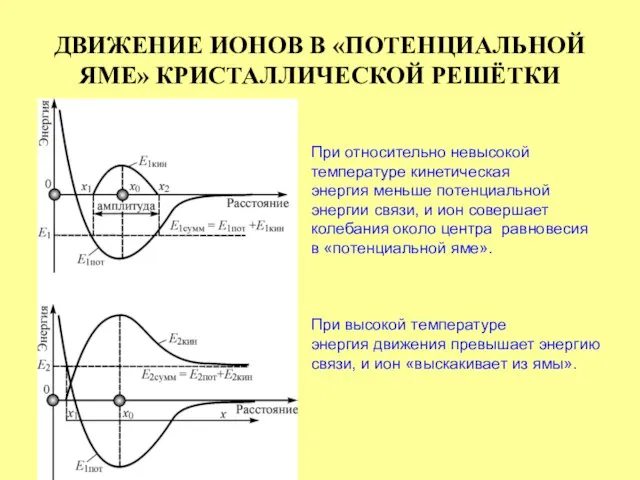
- 15. ДВИЖЕНИЕ ИОНОВ В «ПОТЕНЦИАЛЬНОЙ ЯМЕ» КРИСТАЛЛИЧЕСКОЙ РЕШЁТКИ При относительно невысокой температуре кинетическая энергия меньше потенциальной энергии
- 16. ОБРАЗОВАНИЕ ТЕРМИЧЕСКИХ ВАКАНСИЙ И «ДЕФЕКТНЫХ» ИОНОВ Дефекты Френкеля Дефекты Шоттки При нагреве до температуры плавления концентрация
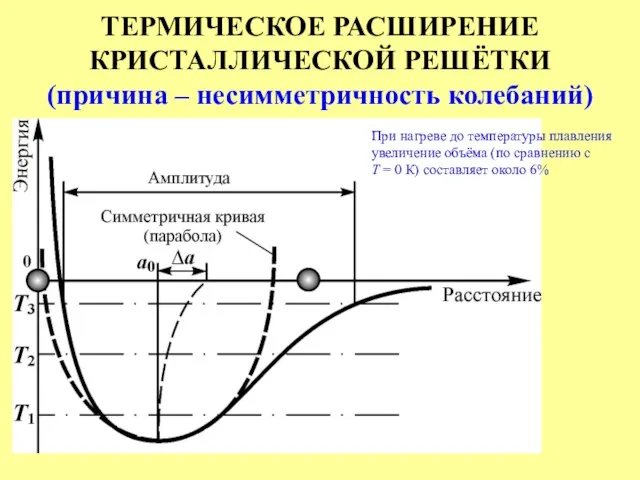
- 17. ТЕРМИЧЕСКОЕ РАСШИРЕНИЕ КРИСТАЛЛИЧЕСКОЙ РЕШЁТКИ (причина – несимметричность колебаний) При нагреве до температуры плавления увеличение объёма (по
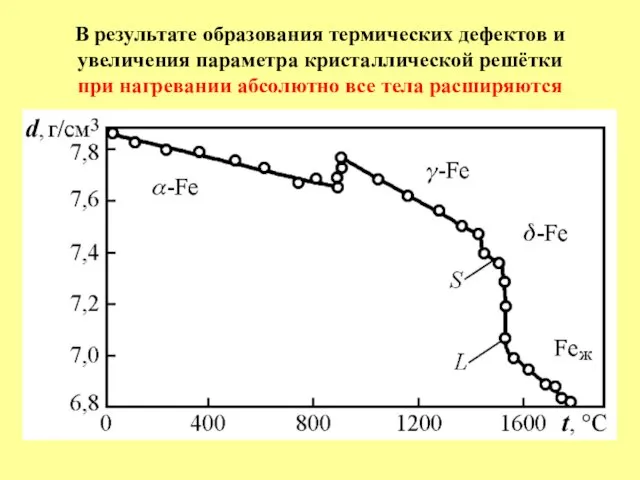
- 18. В результате образования термических дефектов и увеличения параметра кристаллической решётки при нагревании абсолютно все тела расширяются
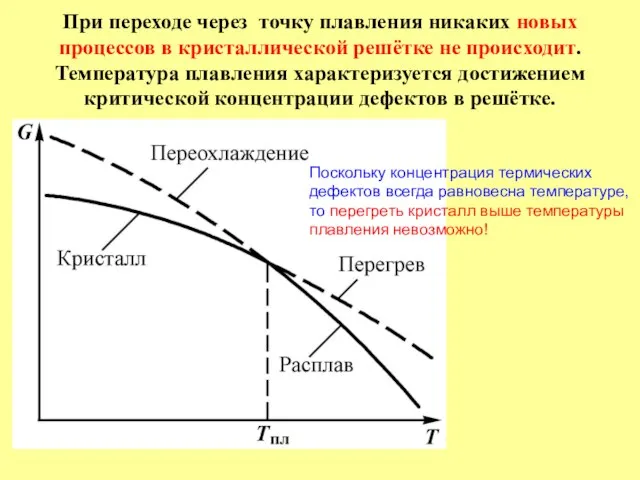
- 19. При переходе через точку плавления никаких новых процессов в кристаллической решётке не происходит. Температура плавления характеризуется
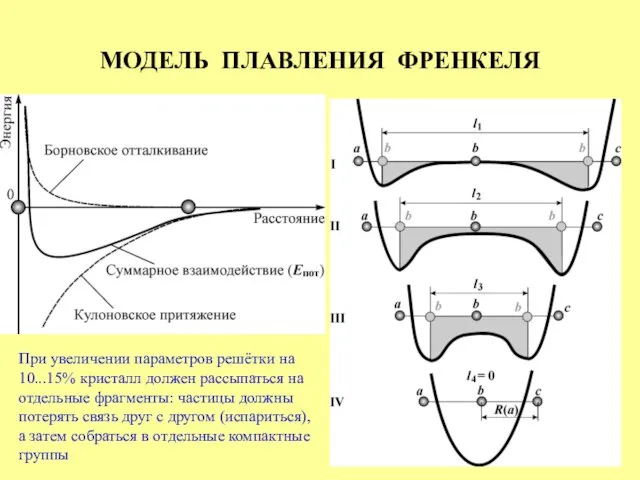
- 20. МОДЕЛЬ ПЛАВЛЕНИЯ ФРЕНКЕЛЯ При увеличении параметров решётки на 10...15% кристалл должен рассыпаться на отдельные фрагменты: частицы
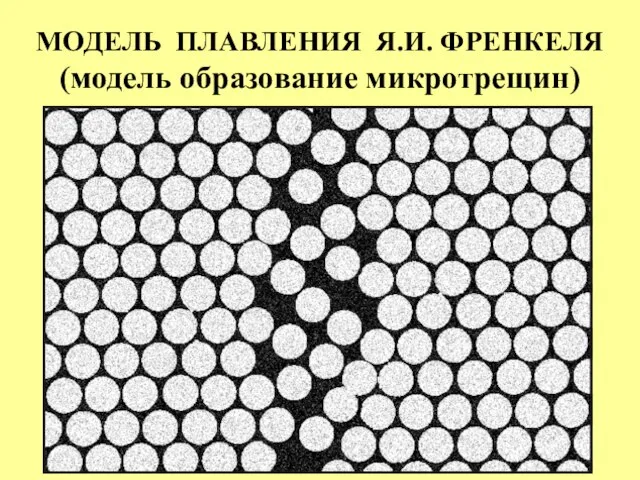
- 21. МОДЕЛЬ ПЛАВЛЕНИЯ Я.И. ФРЕНКЕЛЯ (модель образование микротрещин)
- 22. МОДЕЛЬ СТУКТУРЫ РАСПЛАВЛЕННЫХ МЕТАЛЛОВ (модель сиботаксисов)
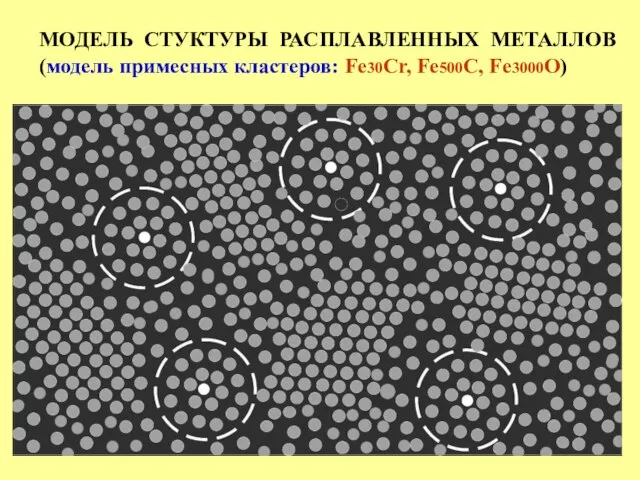
- 23. МОДЕЛЬ СТУКТУРЫ РАСПЛАВЛЕННЫХ МЕТАЛЛОВ (модель примесных кластеров: Fe30Cr, Fe500C, Fe3000O)
- 24. МОДЕЛЬ СТУКТУРЫ ПЕРЕГРЕТЫХ РАСПЛАВЛЕННЫХ МЕТАЛЛОВ Вблизи температуры плавления Значительно перегретый расплав (статистическая жидкость)
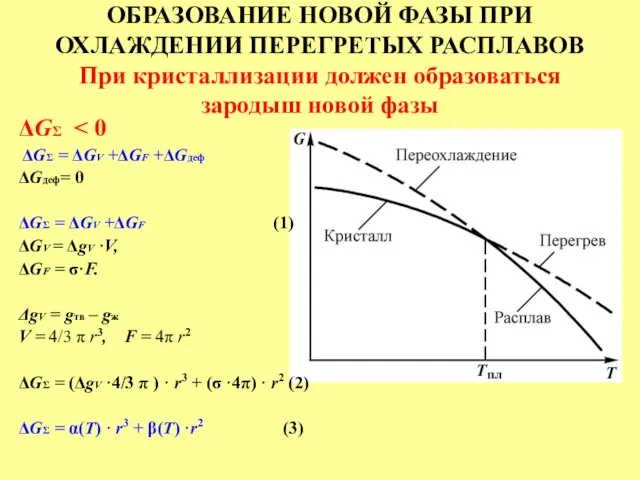
- 25. ОБРАЗОВАНИЕ НОВОЙ ФАЗЫ ПРИ ОХЛАЖДЕНИИ ПЕРЕГРЕТЫХ РАСПЛАВОВ При кристаллизации должен образоваться зародыш новой фазы ΔGΣ ΔGΣ
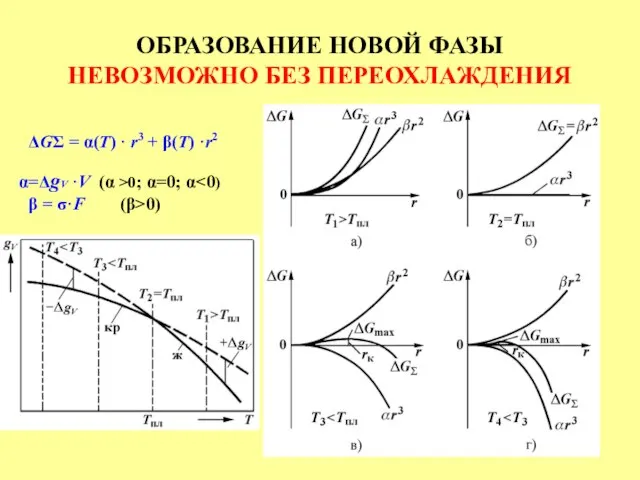
- 26. ОБРАЗОВАНИЕ НОВОЙ ФАЗЫ НЕВОЗМОЖНО БЕЗ ПЕРЕОХЛАЖДЕНИЯ ΔGΣ = α(Τ) · r3 + β(Τ) ·r2 =ΔgV ·V
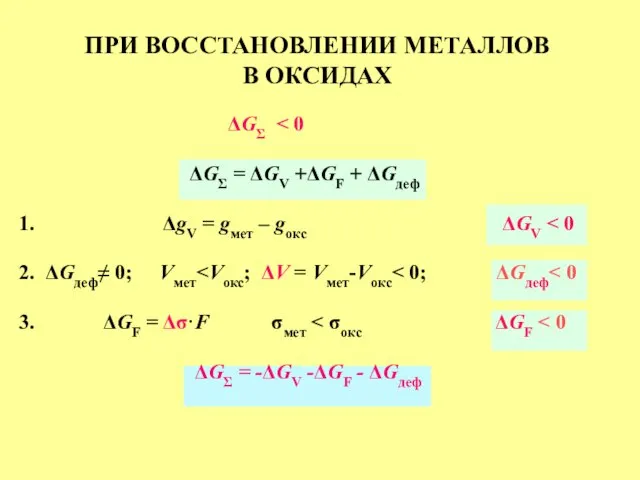
- 27. ПРИ ВОССТАНОВЛЕНИИ МЕТАЛЛОВ В ОКСИДАХ ΔGΣ ΔGΣ = ΔGV +ΔGF + ΔGдеф 1. ΔgV = gмет
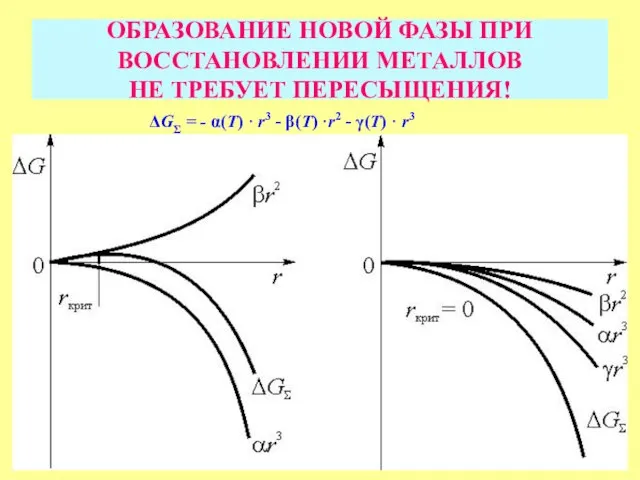
- 28. ОБРАЗОВАНИЕ НОВОЙ ФАЗЫ ПРИ ВОССТАНОВЛЕНИИ МЕТАЛЛОВ НЕ ТРЕБУЕТ ПЕРЕСЫЩЕНИЯ! ΔGΣ = - α(Τ) · r3 -
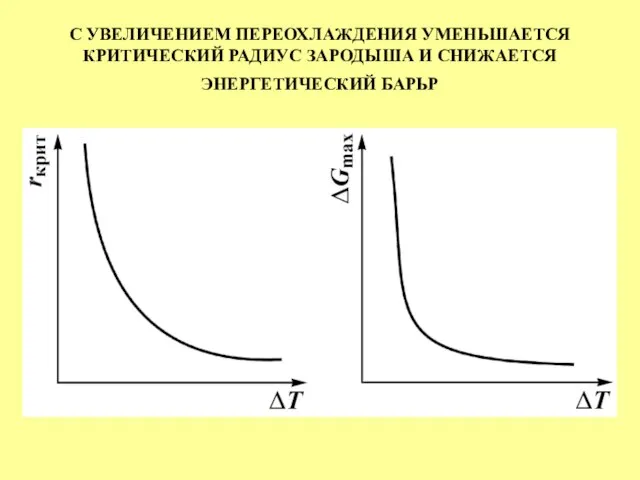
- 29. С УВЕЛИЧЕНИЕМ ПЕРЕОХЛАЖДЕНИЯ УМЕНЬШАЕТСЯ КРИТИЧЕСКИЙ РАДИУС ЗАРОДЫША И СНИЖАЕТСЯ ЭНЕРГЕТИЧЕСКИЙ БАРЬР
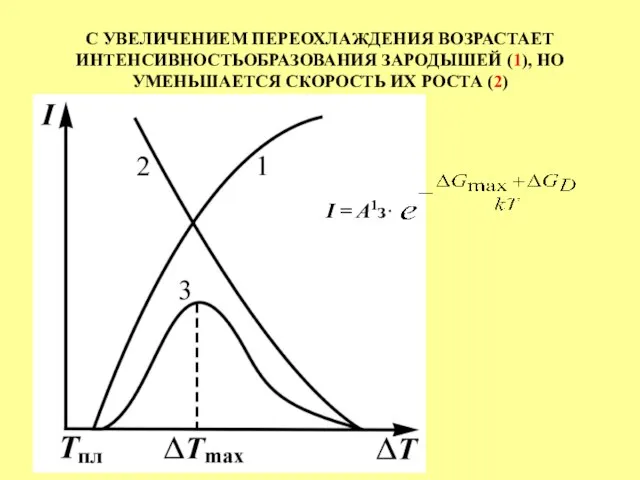
- 30. С УВЕЛИЧЕНИЕМ ПЕРЕОХЛАЖДЕНИЯ ВОЗРАСТАЕТ ИНТЕНСИВНОСТЬОБРАЗОВАНИЯ ЗАРОДЫШЕЙ (1), НО УМЕНЬШАЕТСЯ СКОРОСТЬ ИХ РОСТА (2) I = A1з·
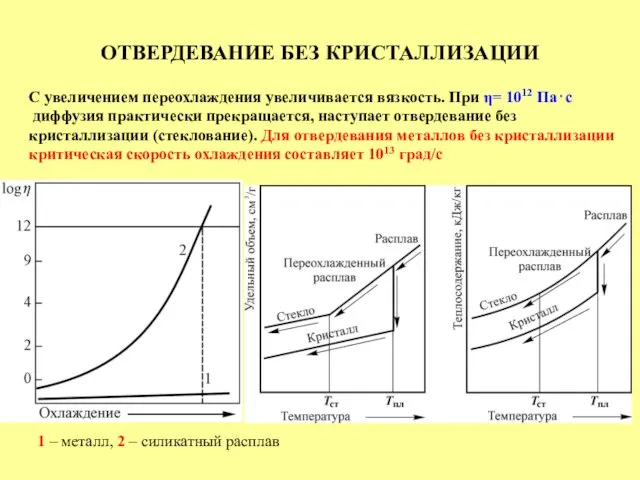
- 31. ОТВЕРДЕВАНИЕ БЕЗ КРИСТАЛЛИЗАЦИИ С увеличением переохлаждения увеличивается вязкость. При η= 1012 Па⋅с диффузия практически прекращается, наступает
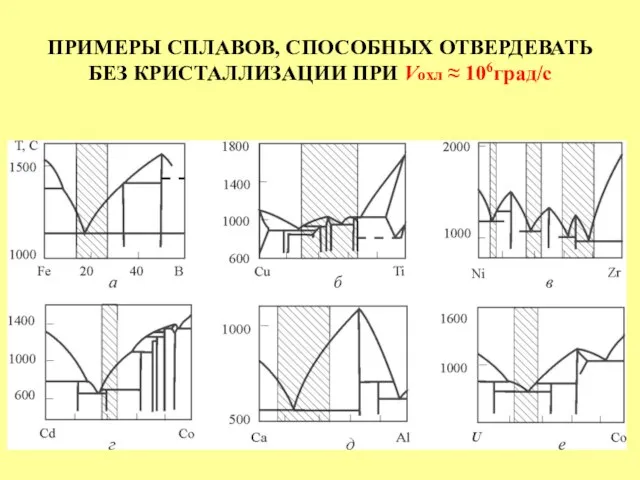
- 32. ПРИМЕРЫ СПЛАВОВ, СПОСОБНЫХ ОТВЕРДЕВАТЬ БЕЗ КРИСТАЛЛИЗАЦИИ ПРИ Vохл ≈ 106град/с
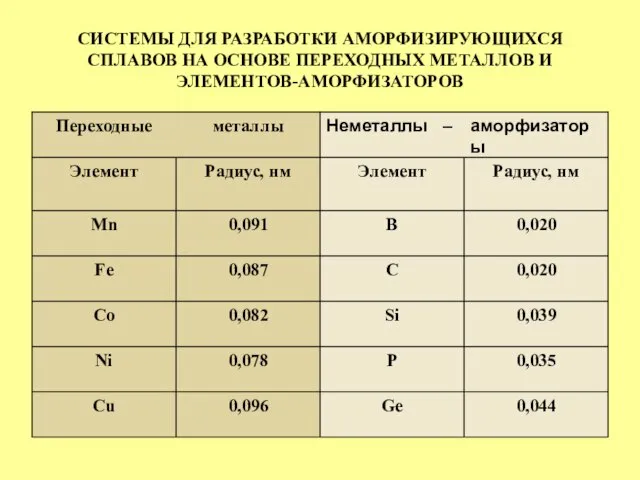
- 33. СИСТЕМЫ ДЛЯ РАЗРАБОТКИ АМОРФИЗИРУЮЩИХСЯ СПЛАВОВ НА ОСНОВЕ ПЕРЕХОДНЫХ МЕТАЛЛОВ И ЭЛЕМЕНТОВ-АМОРФИЗАТОРОВ
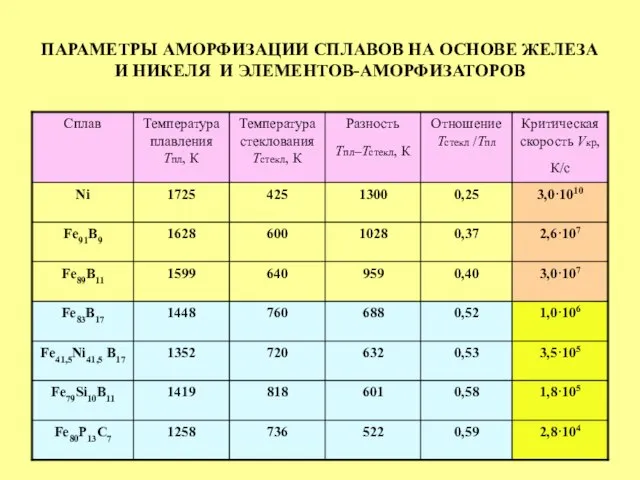
- 34. ПАРАМЕТРЫ АМОРФИЗАЦИИ СПЛАВОВ НА ОСНОВЕ ЖЕЛЕЗА И НИКЕЛЯ И ЭЛЕМЕНТОВ-АМОРФИЗАТОРОВ
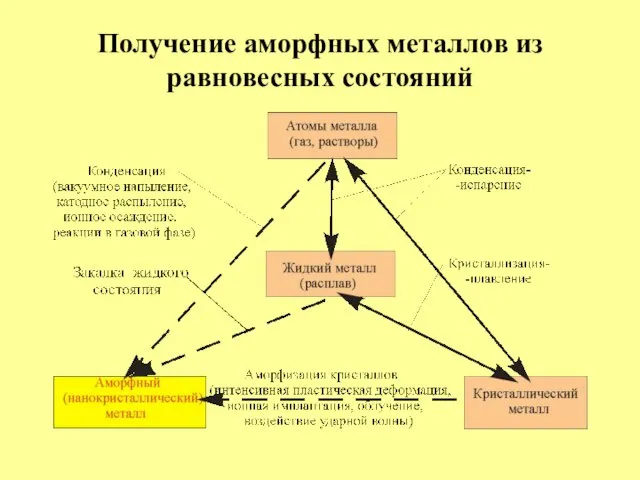
- 35. Получение аморфных металлов из равновесных состояний
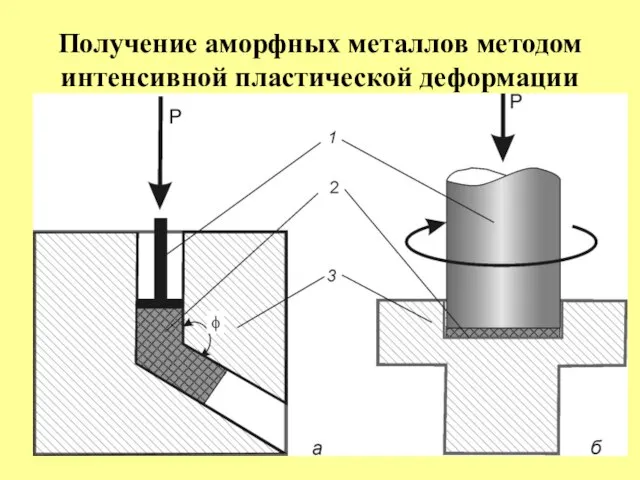
- 36. Получение аморфных металлов методом интенсивной пластической деформации
- 38. Скачать презентацию








 Пластмаси, синтетичні каучуки Підготували учениці 11-б класу Оренбургська Марина та Козаренко Таїсія
Пластмаси, синтетичні каучуки Підготували учениці 11-б класу Оренбургська Марина та Козаренко Таїсія  Общая фармакология
Общая фармакология Углерод и его соединения
Углерод и его соединения Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени
Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени Урок розв’язування задач
Урок розв’язування задач Ароматичні аміни
Ароматичні аміни Фосфор
Фосфор Углеводы
Углеводы Химическая связь
Химическая связь Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.  11 хб
11 хб  Нефелиновые сиениты. Щелочные породы
Нефелиновые сиениты. Щелочные породы Презентация по Химии "Фосфорные удобрения" - скачать смотреть
Презентация по Химии "Фосфорные удобрения" - скачать смотреть  Алкины
Алкины Метаболизм источников энергии
Метаболизм источников энергии Химические волокна
Химические волокна Конструкционные полимеры: классификация, достижения и проблемы
Конструкционные полимеры: классификация, достижения и проблемы Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия
Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия Поліетелен. Застосування поліетилену
Поліетелен. Застосування поліетилену Аммиак
Аммиак Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі
Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі Мило. Мийні засоби
Мило. Мийні засоби Виды присадок к моторным топливам. Керосин
Виды присадок к моторным топливам. Керосин Обобщение и систематизация знаний по теме Химическая связь и строение атома
Обобщение и систематизация знаний по теме Химическая связь и строение атома Химическая промышленность
Химическая промышленность Регуляция обмена веществ
Регуляция обмена веществ Протеины: плюсы и минусы
Протеины: плюсы и минусы Биохимия печени
Биохимия печени