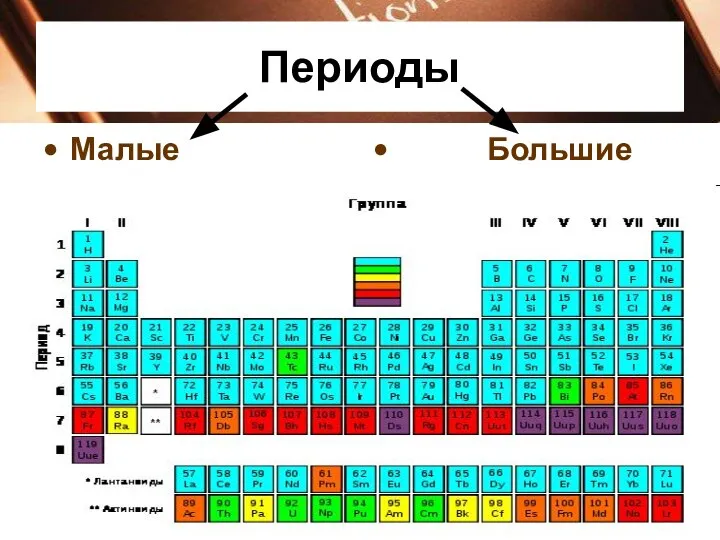
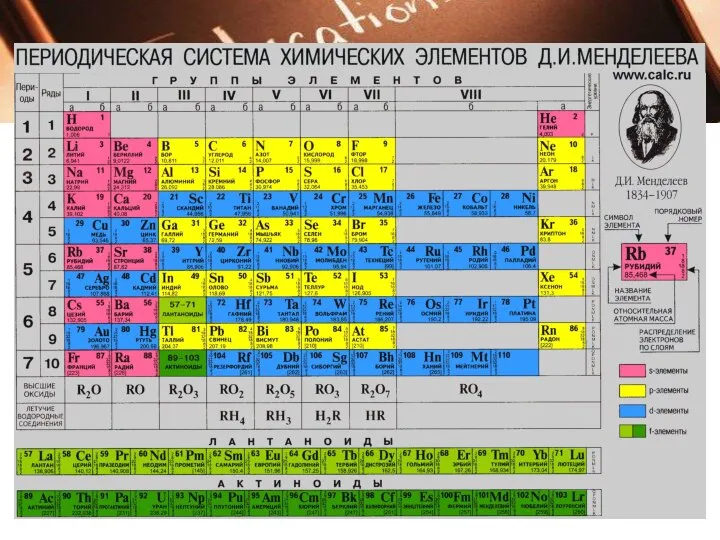
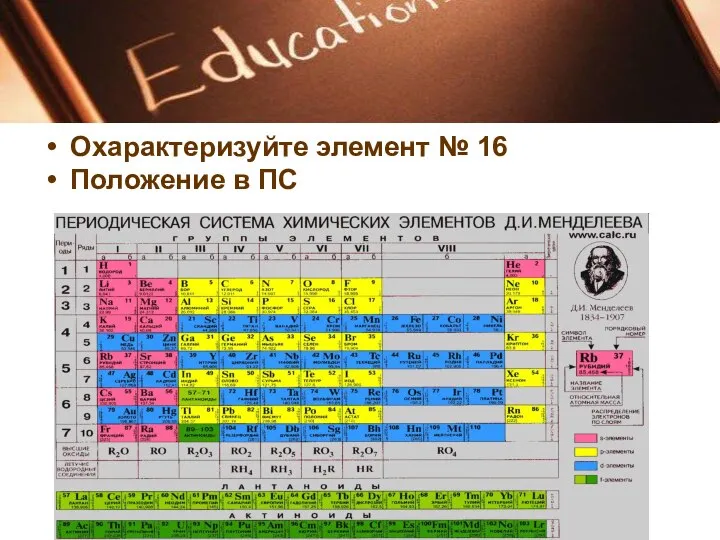
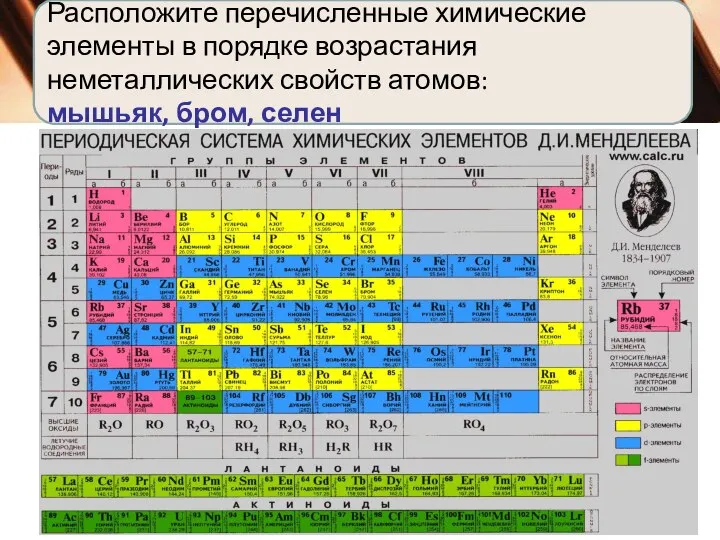
В периодах слева направо:
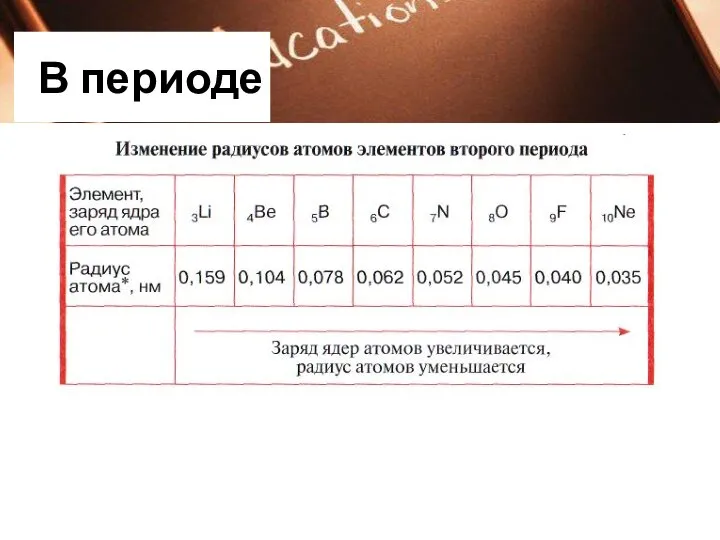
Заряд ядер атомов увеличивается;
число занятых электронами энергетических уровней
в
атомах не изменяется;
число электронов на внешнем энергетическом уровне атомов (валентных) увеличивается от 1 до 8;
радиус атомов уменьшается;
прочность связи электронов внешнего уровня (валент
ных) с ядром увеличивается;
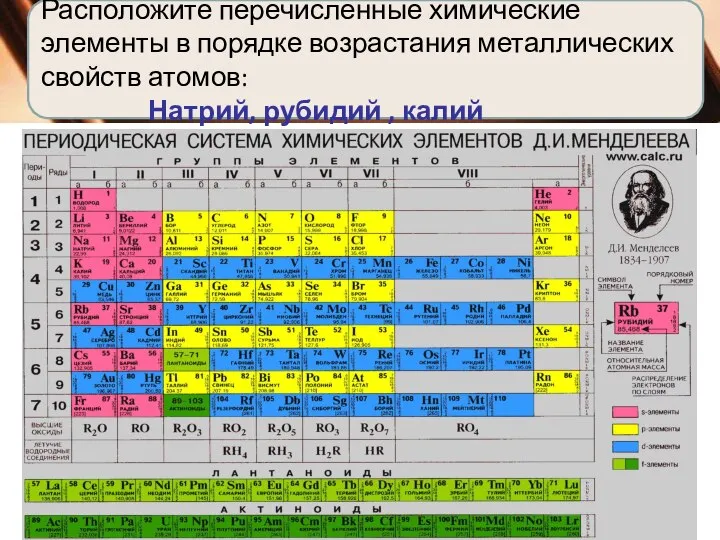
металлические свойства атомов элементов убывают;
неметаллические свойства атомов элементов усиливаются.
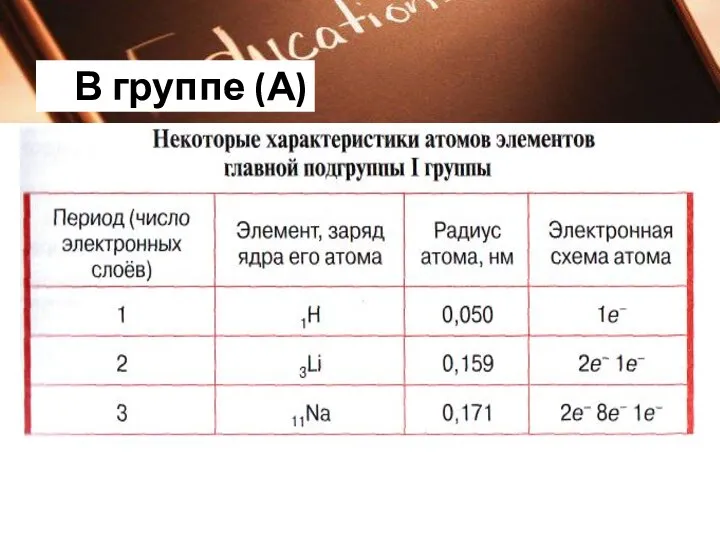
Начало каждого периода совпадает с началом заполнения нового электронного слоя.
Каждый период начинается элементом, атомы которого
образуют вещество — металл, а заканчивается элементом,
атомы которого образуют вещество — благородный газ.
В периоде








 Пластмаси, синтетичні каучуки Підготували учениці 11-б класу Оренбургська Марина та Козаренко Таїсія
Пластмаси, синтетичні каучуки Підготували учениці 11-б класу Оренбургська Марина та Козаренко Таїсія  Общая фармакология
Общая фармакология Углерод и его соединения
Углерод и его соединения Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени
Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени Урок розв’язування задач
Урок розв’язування задач Ароматичні аміни
Ароматичні аміни Фосфор
Фосфор Углеводы
Углеводы Химическая связь
Химическая связь Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.  11 хб
11 хб  Нефелиновые сиениты. Щелочные породы
Нефелиновые сиениты. Щелочные породы Презентация по Химии "Фосфорные удобрения" - скачать смотреть
Презентация по Химии "Фосфорные удобрения" - скачать смотреть  Алкины
Алкины Метаболизм источников энергии
Метаболизм источников энергии Химические волокна
Химические волокна Конструкционные полимеры: классификация, достижения и проблемы
Конструкционные полимеры: классификация, достижения и проблемы Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия
Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия Поліетелен. Застосування поліетилену
Поліетелен. Застосування поліетилену Аммиак
Аммиак Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі
Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі Мило. Мийні засоби
Мило. Мийні засоби Виды присадок к моторным топливам. Керосин
Виды присадок к моторным топливам. Керосин Обобщение и систематизация знаний по теме Химическая связь и строение атома
Обобщение и систематизация знаний по теме Химическая связь и строение атома Химическая промышленность
Химическая промышленность Регуляция обмена веществ
Регуляция обмена веществ Протеины: плюсы и минусы
Протеины: плюсы и минусы Биохимия печени
Биохимия печени