Содержание
- 2. Цели и задачи работы Цель нашей работы: Получить гидроксид никеля (II) Изучить физические и химические свойства
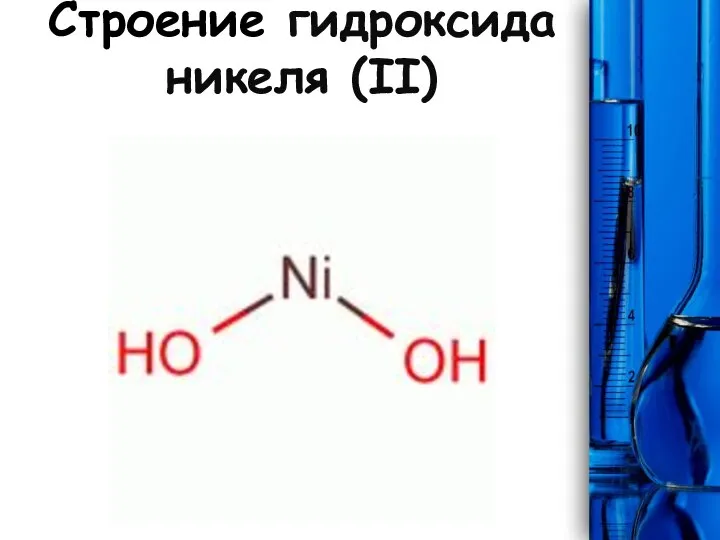
- 3. Строение гидроксида никеля (II)
- 4. Физические свойства Гидроксид никеля(II) образует светло-зелёные кристаллы тригональной сингонии, пространственная группа P 3m1, параметры ячейки a
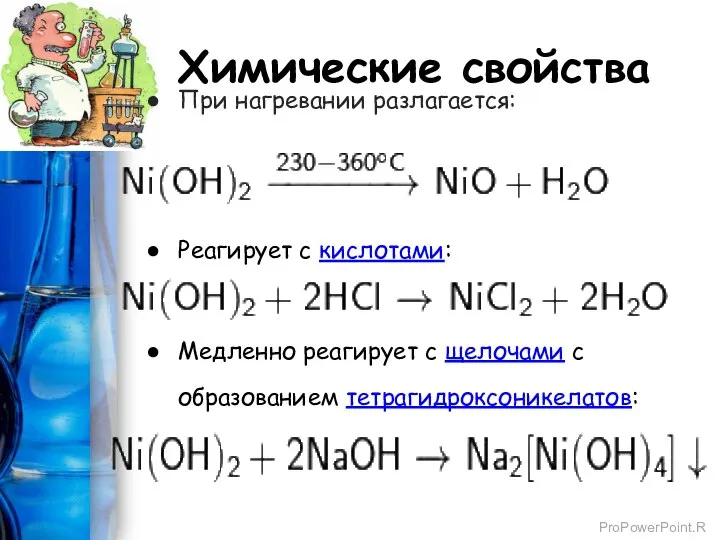
- 5. Химические свойства При нагревании разлагается: Реагирует с кислотами: Медленно реагирует с щелочами с образованием тетрагидроксоникелатов:
- 6. Химические свойства С растворами аммиака образует комплексные аммины: Является слабым восстановителем:
- 7. Применение Никель является компонентом многих сплавов - жаропрочных, сплавов сопротивления (нихром: 60% Ni + 40% Cr),
- 8. Что нам нужно для работы?
- 9. 5 г Ni(NO3)2 ∙6H2O растворяем в горячей воде (50мл) Хорошо перемешиваем и осаждаем горячим раствором щелочи
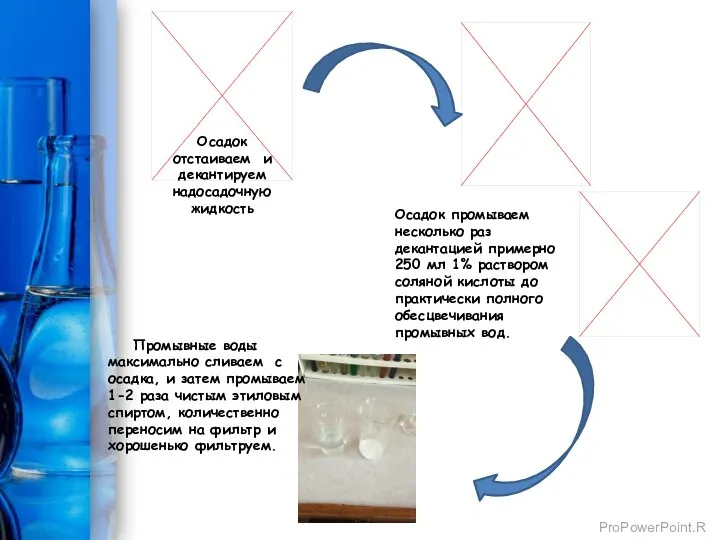
- 10. Осадок отстаиваем и декантируем надосадочную жидкость Осадок промываем несколько раз декантацией примерно 250 мл 1% раствором
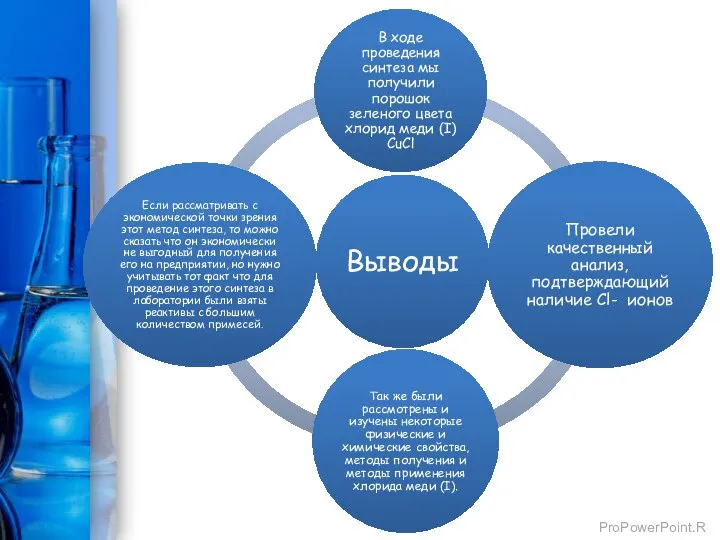
- 11. mнавески(CuO) = 50(г.) M(CuO) = 63,55 + 16 = 79,55(г/моль). M(CuCl2) = 63,55 + 70,9 =
- 12. Качественные реакции Мы провели качественную реакцию, чтобы доказать наличие в растворе Сl-. 2CuCl + 2AgNO3= 2AgCl↓
- 13. Изучение различных свойств CuI и CuBr CuI используется в засеве облаков, изменение количества или типа осаждения
- 16. Скачать презентацию









 Марказит (лучистый колчедан, капельное серебро)
Марказит (лучистый колчедан, капельное серебро) Строение атома
Строение атома Комплесные соединения
Комплесные соединения Реакционная способность альдегидов и кетонов
Реакционная способность альдегидов и кетонов Учитель: Мельникова И.В.
Учитель: Мельникова И.В.  Free Radical Polymerization
Free Radical Polymerization Неметаллы. Сера. 9 класс
Неметаллы. Сера. 9 класс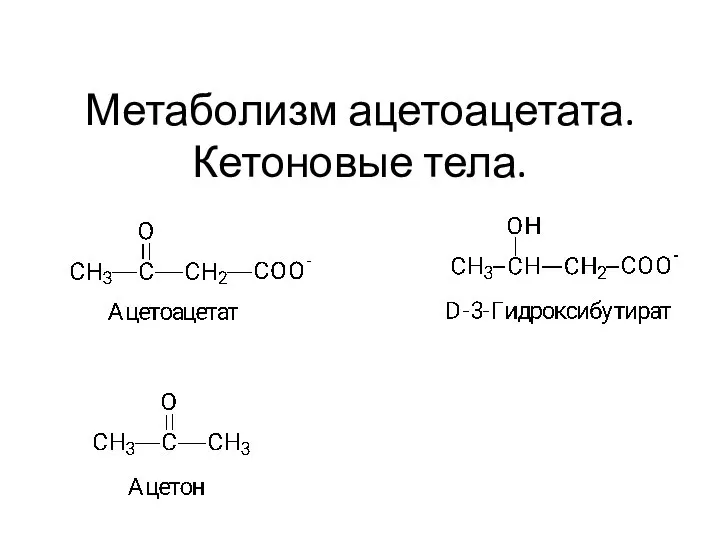 Метаболизм ацетоацетата. Кетоновые тела.Тема 10
Метаболизм ацетоацетата. Кетоновые тела.Тема 10 Ферменты и гормоны Урок химии в 10 классе естественнонаучного профиля Автор: учитель химии Ким Н.В. МБОУ «СОШ №6» г. Нягани ХМАО
Ферменты и гормоны Урок химии в 10 классе естественнонаучного профиля Автор: учитель химии Ким Н.В. МБОУ «СОШ №6» г. Нягани ХМАО Развитие органической химии
Развитие органической химии Введение. Классификация минеральных удобрений
Введение. Классификация минеральных удобрений Роль металів в житті людини
Роль металів в житті людини Получение наночастиц железа
Получение наночастиц железа Теоретическое описание полных сечений реакций при столкновениях 4,6He + 28Si и 6,7,9,11Li + 28Si
Теоретическое описание полных сечений реакций при столкновениях 4,6He + 28Si и 6,7,9,11Li + 28Si Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция
Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция Железо и его соединения.
Железо и его соединения. Производство серной кислоты и аммиака (11 класс)
Производство серной кислоты и аммиака (11 класс) Первичная переработка-ХТТ и В
Первичная переработка-ХТТ и В Закономерности в таблице Д. И. Менделеева
Закономерности в таблице Д. И. Менделеева Устойчивость и резистентность вредных организмов к пестицидам и пути ее преодоления. (Лекция 4)
Устойчивость и резистентность вредных организмов к пестицидам и пути ее преодоления. (Лекция 4) Щёлочноземельные металлы. Выполнила: Ученица 9 Б класса МОУ СОШ № 172 Мошкова Любовь.
Щёлочноземельные металлы. Выполнила: Ученица 9 Б класса МОУ СОШ № 172 Мошкова Любовь. Химиядан сұрақтар
Химиядан сұрақтар Общие свойства d-металлов
Общие свойства d-металлов Отдельные классы дисперсных систем
Отдельные классы дисперсных систем Как меняется термическая устойчивость и реакционная способность связей Э-C и Э-O-Э в ряду Э=Si, Ge, Sn, Pb
Как меняется термическая устойчивость и реакционная способность связей Э-C и Э-O-Э в ряду Э=Si, Ge, Sn, Pb Фосфор. История открытия
Фосфор. История открытия Алкалоидтар. Алкалоидтар негіздік қасиет
Алкалоидтар. Алкалоидтар негіздік қасиет Способы разделения смесей
Способы разделения смесей