Получение, собирание и распознавание газов. Решение экспериментальных задач по теме Металлы и неметаллы
Содержание
- 2. Тема: Получение, собирание и распознавание газов. Решение экспериментальных задач по теме «Металлы и неметаллы» Цели: а)
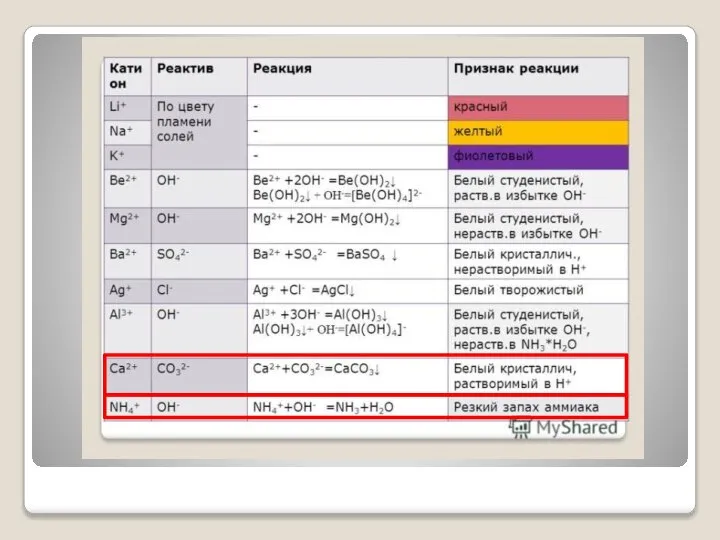
- 3. Ход занятия Техника безопасности Получение кислорода разложением пероксида водорода H2O2 2 H2O+ O2 ↑ 2 MnO2
- 4. Вывод: при каталитическом разложении перекиси водорода выделяется…………………, который мы собрали методами…………………… и………………... При внесении в стакан
- 5. III. Получение водорода взаимодействием гидроксида натрия и алюминия Вывод: При взаимодействии алюминия с гидроксидом натрия выделяется……………
- 6. IV. Получение аммиака при взаимодействии гидроксида кальция и хлорида аммония Ca(OH)2+ NH4Cl CaCl2+2NH4OH 2 2NH3 ↑
- 7. Вывод: При взаимодействии……………..и………….образуется гидроксид аммония, который распадается на ……….и………… Свободный аммиак через…………поступает в пробирку с водой
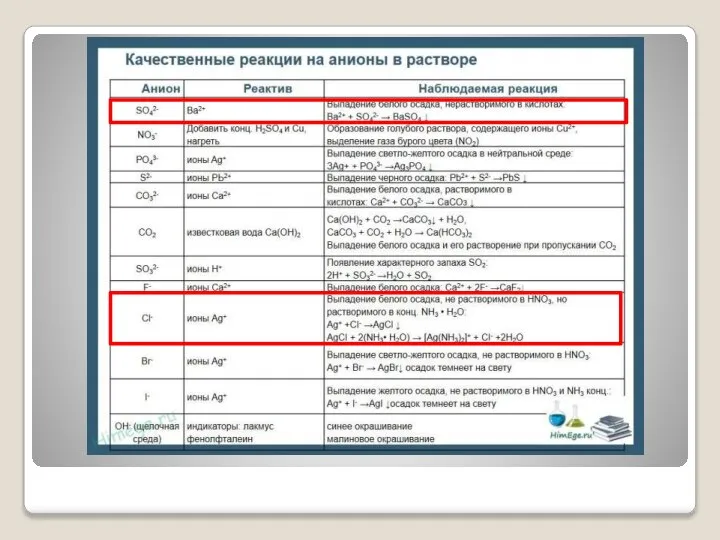
- 8. V. Получение углекислого газа и исследование его свойств CaCO3+ HCl CaCl2+H2CO3 2 H2O CO2↑ Вывод: При
- 9. VI. Осуществите экспериментальным путем цепочку превращений металла и его соединений Cu→CuO→Cu(NO3)2 1) Cu + CuO 2)
- 10. VII. В трех пробирках даны кристаллические вещества А) сульфат аммония Б) карбонат кальция В) хлорид железа
- 13. VIII. Получите из соли меди ее гидроксид, а затем – оксид Вывод: При взаимодействии ……………..с…………образуется гидроксид
- 15. Скачать презентацию










 Презентация по Химии "БЕНЗОЛ" - скачать смотреть
Презентация по Химии "БЕНЗОЛ" - скачать смотреть  Проверка знаний по теме «Химическая организация клетки. Неорганические вещества»
Проверка знаний по теме «Химическая организация клетки. Неорганические вещества» Периодический закон. Периодическая система элементов. (Лекция 2)
Периодический закон. Периодическая система элементов. (Лекция 2) Биопластики: область применения
Биопластики: область применения Ph воды
Ph воды Хімія в медицині
Хімія в медицині  Металлическая связь
Металлическая связь Презентация по Химии "Полімери" - скачать смотреть бесплатно
Презентация по Химии "Полімери" - скачать смотреть бесплатно Основные понятия и законы химии
Основные понятия и законы химии Щелочноземельные металлы
Щелочноземельные металлы Алкины. Этин (Ацетилен)
Алкины. Этин (Ацетилен) Электролиз. Правила электролиза
Электролиз. Правила электролиза Агрохимия растений
Агрохимия растений Роль металів у житті людини Підготувала учениця 10-А класу Бутрак Анастасія
Роль металів у житті людини Підготувала учениця 10-А класу Бутрак Анастасія  Химия в разных науках
Химия в разных науках Эколого-биохимическая характеристика почв и подорожника большого (Plantago Major) из районов г. Самары
Эколого-биохимическая характеристика почв и подорожника большого (Plantago Major) из районов г. Самары Химические элементы
Химические элементы Презентація на тему: “Мінеральні добрива” Підготував: Учень 10-А класу Матвійчук Роман
Презентація на тему: “Мінеральні добрива” Підготував: Учень 10-А класу Матвійчук Роман  Слайд-шоу. Коррозия металлов и сплавов
Слайд-шоу. Коррозия металлов и сплавов Allgemeine Chemie für PharmazeutInnen
Allgemeine Chemie für PharmazeutInnen Термодинамика фазовых превращений
Термодинамика фазовых превращений Тема: Главная беда – вредная еда! Авторы: Оводова А., Коршикова А. Научный руководитель: Еньшина И.В.
Тема: Главная беда – вредная еда! Авторы: Оводова А., Коршикова А. Научный руководитель: Еньшина И.В. Введение в современную биотехнологию . «нет ничего более практичного, чем хорошая теория» кто-то из великих физиков Планк ил
Введение в современную биотехнологию . «нет ничего более практичного, чем хорошая теория» кто-то из великих физиков Планк ил Что объединяет эти вещества?
Что объединяет эти вещества? Растворы. Первичные понятия
Растворы. Первичные понятия Органическая химия в вопросах и ответах для самоподготовки. Подготовка к экзамену
Органическая химия в вопросах и ответах для самоподготовки. Подготовка к экзамену Обмен нуклеотидов
Обмен нуклеотидов Организация дипептида
Организация дипептида