Содержание
- 2. Поверхностные явления – эффекты и особенности поведения веществ, которые наблюдаются на поверхности раздела фаз. Поверхностные явления
- 3. Молекулы на поверхности стремятся «втянуться» внутрь – поверхность раздела уменьшается, а поверхностная энергия увеличивается. Поверхностная энергия
- 4. Физический смысл поверхностного натяжения Энергетическая трактовка: поверхностное натяжение равно работе, затраченной на образование единицы поверхности: Силовое
- 5. Благодаря поверхностному натяжению капля жидкости в свободном падении принимает сферическую форму.
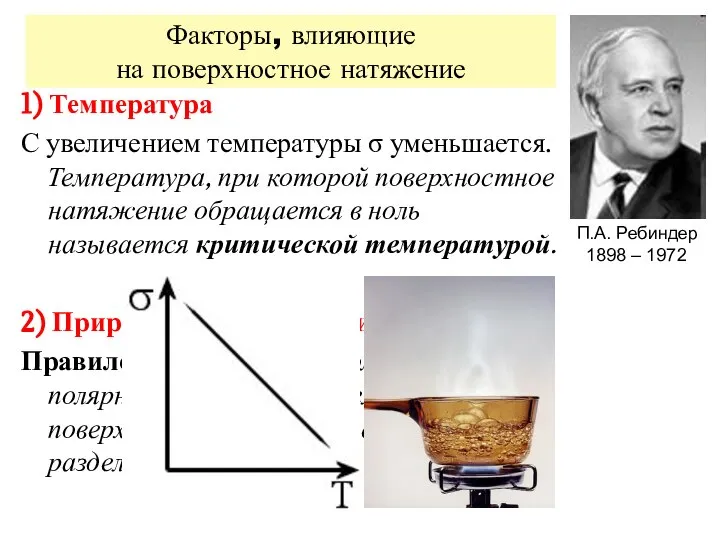
- 6. Факторы, влияющие на поверхностное натяжение 1) Температура С увеличением температуры σ уменьшается. Температура, при которой поверхностное
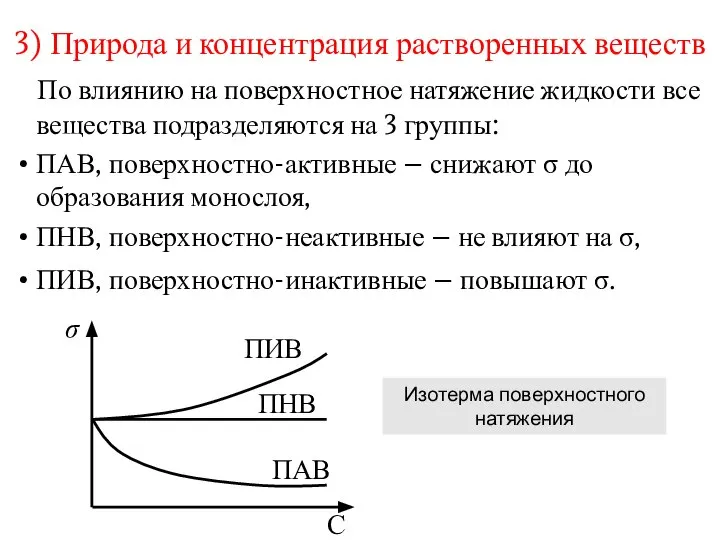
- 7. 3) Природа и концентрация растворенных веществ По влиянию на поверхностное натяжение жидкости все вещества подразделяются на
- 8. ПИВ - неорганические вещества (электролиты) Ионы хорошо гидратируются, поэтому втягиваются в глубину раствора и усиливают полярные
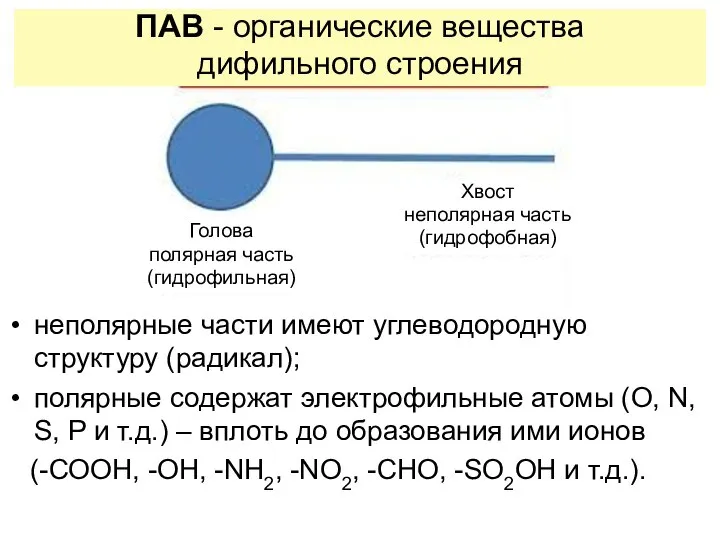
- 9. неполярные части имеют углеводородную структуру (радикал); полярные содержат электрофильные атомы (O, N, S, P и т.д.)
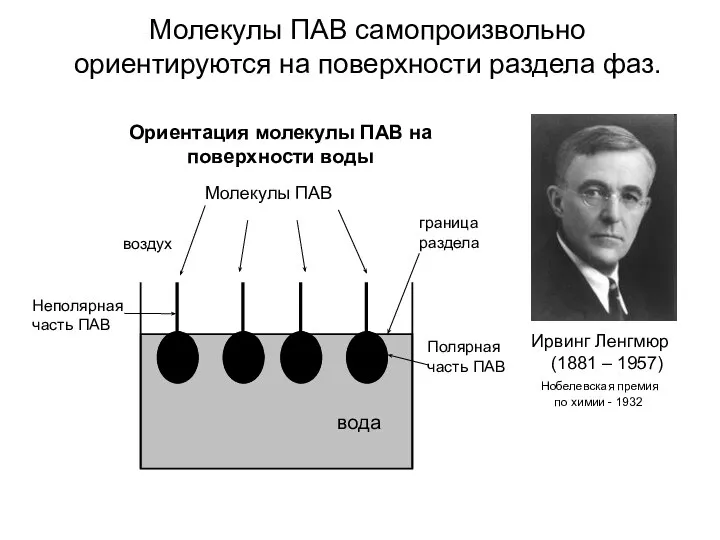
- 10. Молекулы ПАВ самопроизвольно ориентируются на поверхности раздела фаз. Ирвинг Ленгмюр (1881 – 1957) Нобелевская премия по
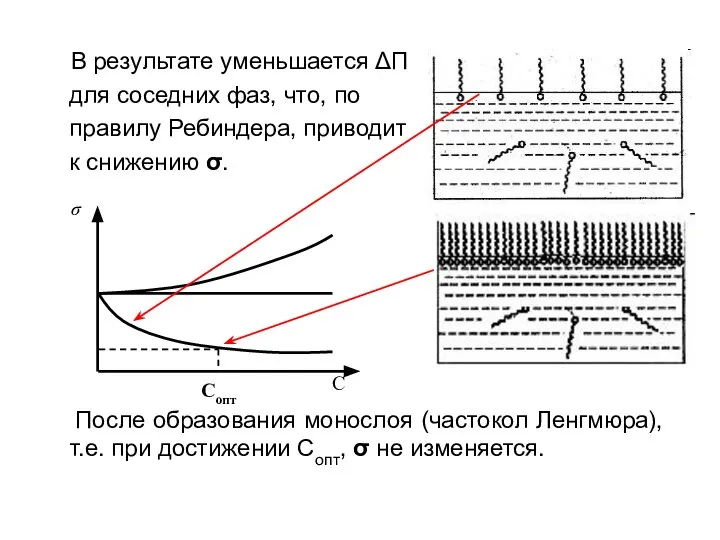
- 11. В результате уменьшается ΔП для соседних фаз, что, по правилу Ребиндера, приводит к снижению σ. После
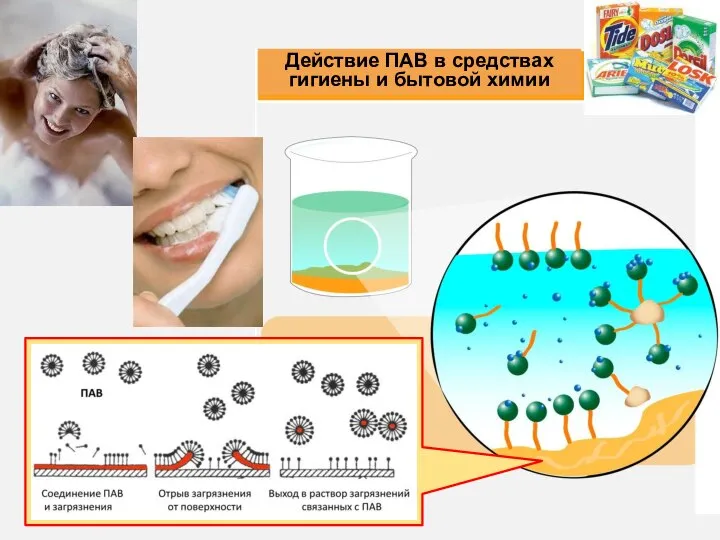
- 12. Действующее вещество - симетикон обладает свойствами ПАВ. уменьшает σ на границе жидкость-газ; способствует слиянию пузырьков газа
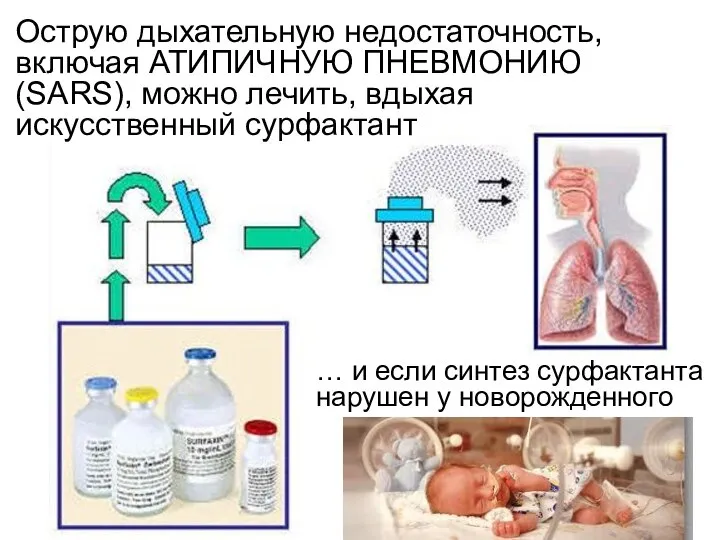
- 15. Острую дыхательную недостаточность, включая АТИПИЧНУЮ ПНЕВМОНИЮ (SARS), можно лечить, вдыхая искусственный сурфактант … и если синтез
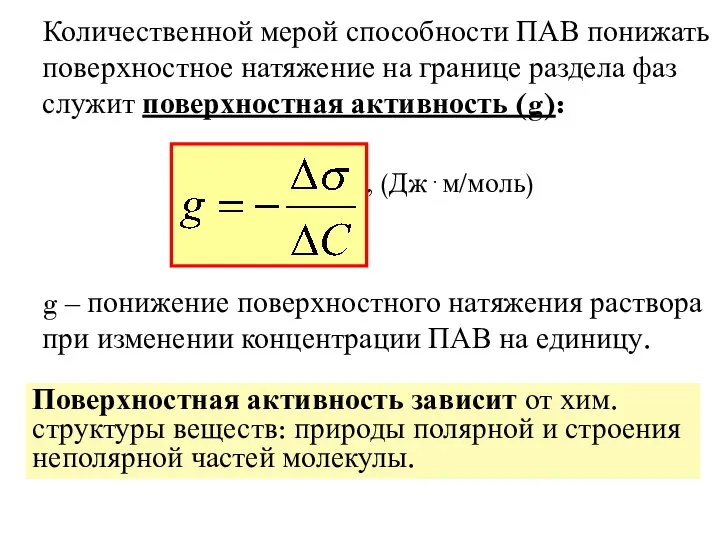
- 17. Количественной мерой способности ПАВ понижать поверхностное натяжение на границе раздела фаз служит поверхностная активность (g): ,
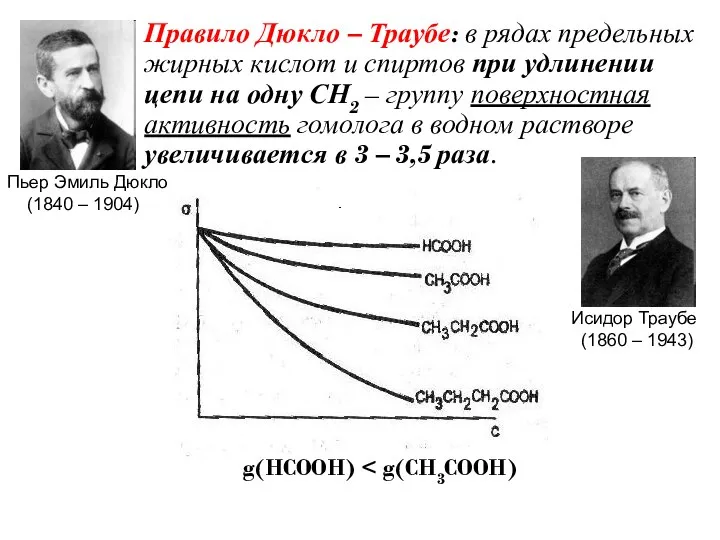
- 18. Правило Дюкло – Траубе: в рядах предельных жирных кислот и спиртов при удлинении цепи на одну
- 19. аБсорбция - самопроизвольный процесс поглощения вещества (абсорбтива) всем объемом абсорбента аДсорбция - самопроизвольный процесс накопления вещества
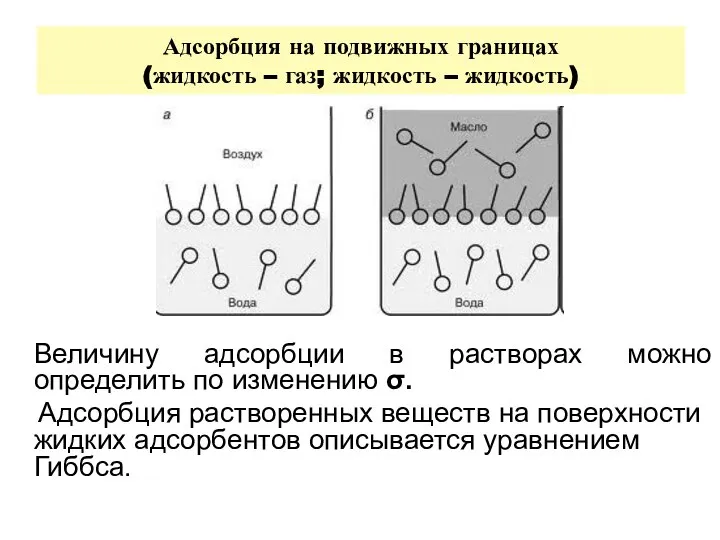
- 20. Адсорбция на подвижных границах (жидкость – газ; жидкость – жидкость) Величину адсорбции в растворах можно определить
- 21. Изотерма адсорбции Гиббса Уравнение адсорбции Гиббса: Для ПАВ: σ 0; Г > 0 – адсорбция положительна.
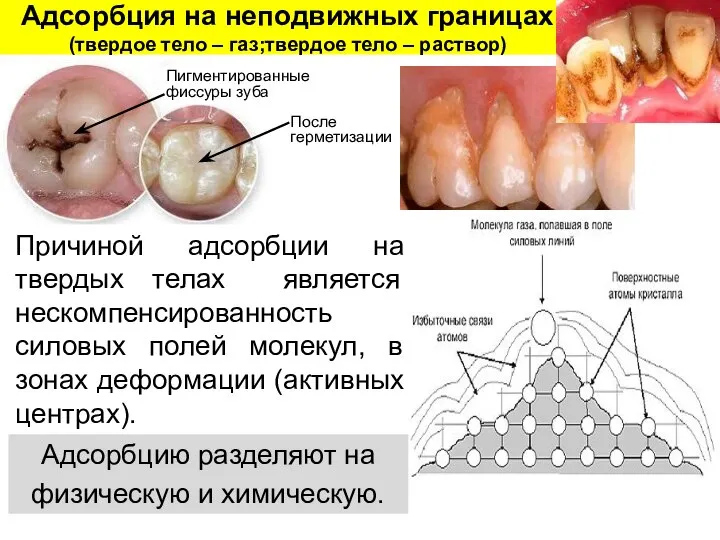
- 22. Адсорбция на неподвижных границах (твердое тело – газ;твердое тело – раствор) Причиной адсорбции на твердых телах
- 23. Физическая адсорбция (ФАд) возникает за счет ван-дер-ваальсовых взаимодействий и происходит на активных центрах (во впадинах поверхности).
- 24. Адсорбция (Г) на подвижной и неподвижной границах раздела описывается уравнением Ленгмюра Г∞ – предельная адсорбция; b
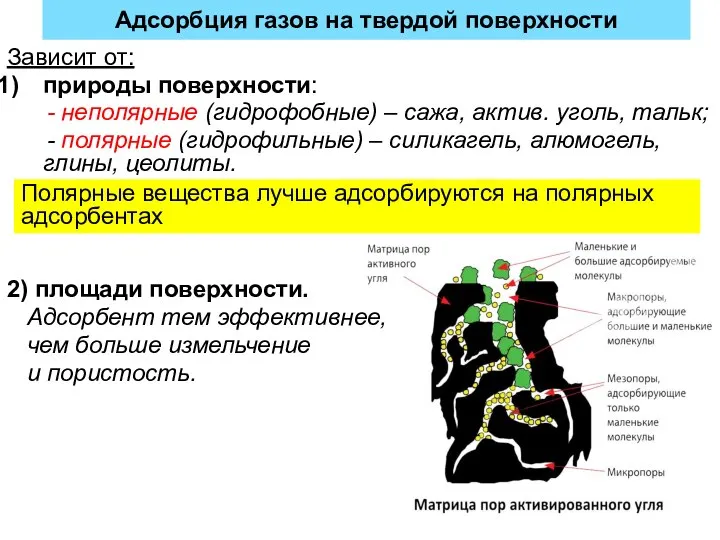
- 25. Адсорбция газов на твердой поверхности Зависит от: природы поверхности: - неполярные (гидрофобные) – сажа, актив. уголь,
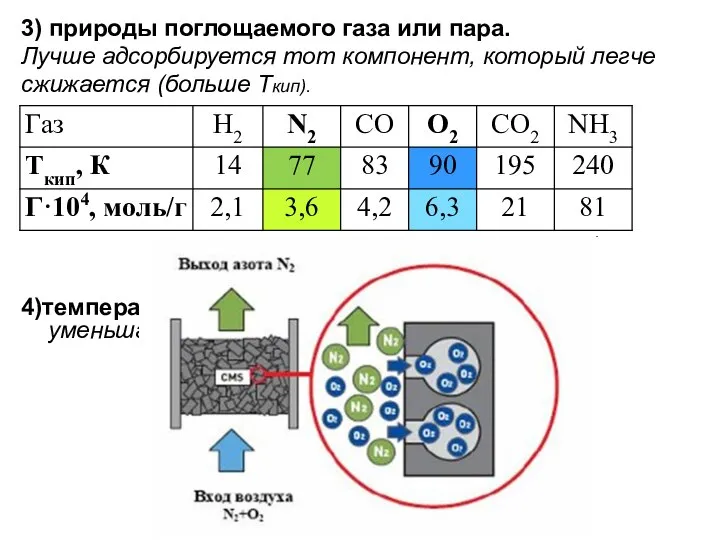
- 26. 3) природы поглощаемого газа или пара. Лучше адсорбируется тот компонент, который легче сжижается (больше Ткип). 4)температуры.
- 27. ИЗОБРЕТЕНИЕ, КОТОРОЕ СПАСЛО ТЫСЯЧИ ЖИЗНЕЙ В 1915 году русский химик-органик, академик АН СССР ЗЕЛИНСКИЙ Н.Д. с
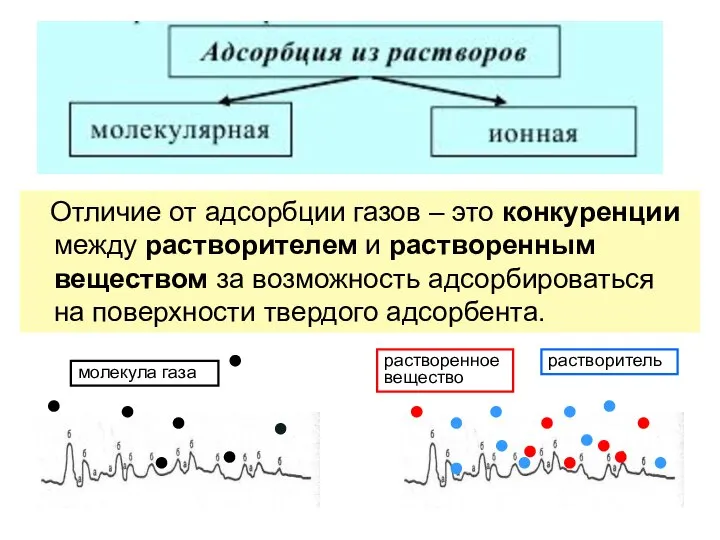
- 28. Отличие от адсорбции газов – это конкуренции между растворителем и растворенным веществом за возможность адсорбироваться на
- 29. Молекулярная (неэлектролитов) адсорбция Зависит от: 1) природы адсорбента. Полярные адсорбенты поглощают полярные вещества. 2) природы растворителя.
- 30. Адсорбция ионов из растворов в зависимости от природы адсорбента подразделяется на ионную адсорбцию и ионнообменную адсорбцию
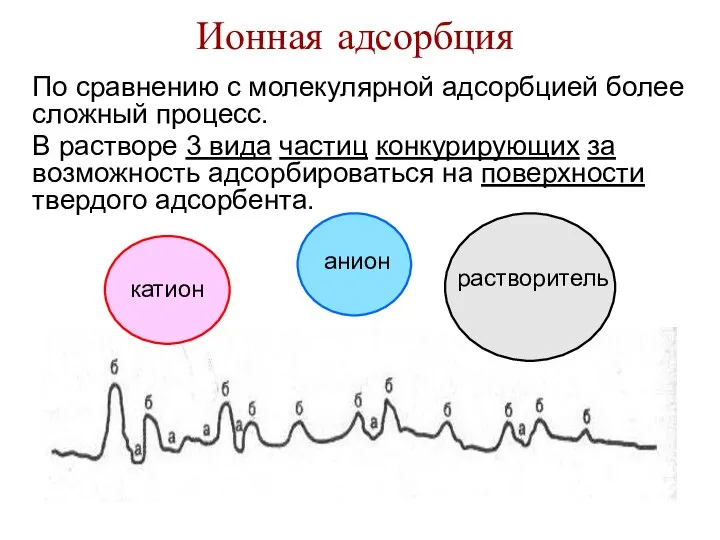
- 31. Ионная адсорбция По сравнению с молекулярной адсорбцией более сложный процесс. В растворе 3 вида частиц конкурирующих
- 32. Зависит от: 1) природы адсорбента. Чем более полярный адсорбент, тем лучше адсорбция ионов. 2) природы иона:
- 33. Избирательная адсорбция ионов правило Панета – Фаянса Например: на AgI могут адсорбироваться Ag+ и I-, а
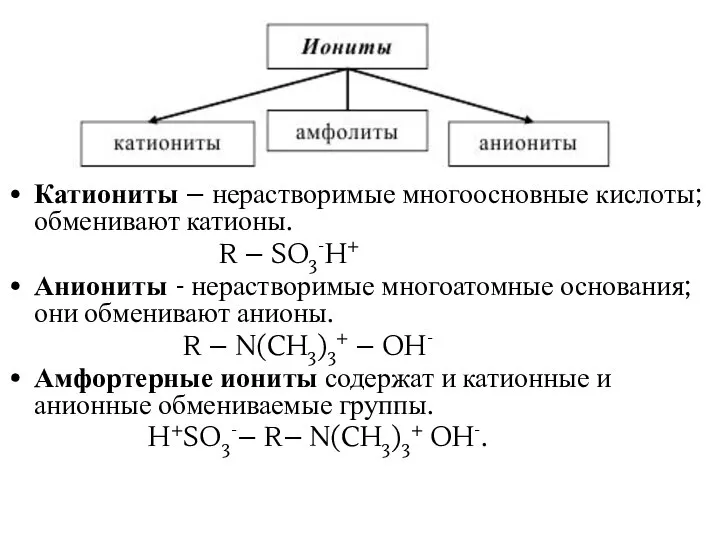
- 34. Ионообменная адсорбция Ионообменная адсорбция – процесс, при котором твердый адсорбент обменивает свои ионы на ионы того
- 35. Катиониты – нерастворимые многоосновные кислоты; обменивают катионы. R – SO3-H+ Аниониты - нерастворимые многоатомные основания; они
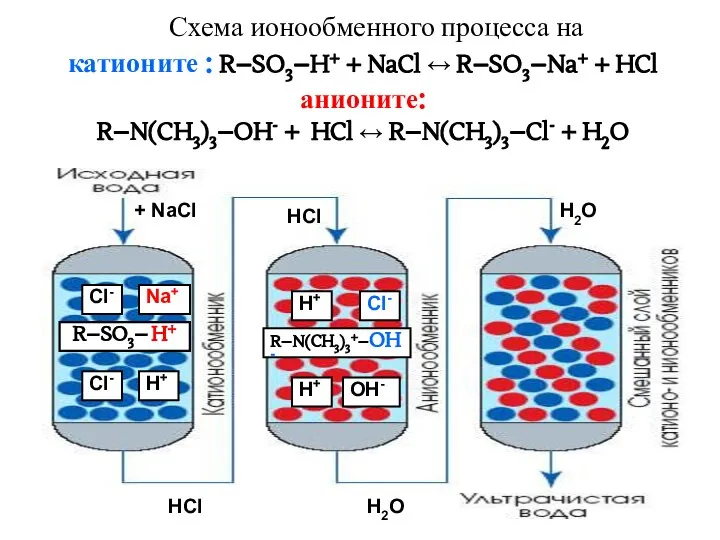
- 36. Схема ионообменного процесса на катионите : R–SO3–H+ + NaCl ↔ R–SO3–Na+ + HCl анионите: R–N(CH3)3–OH- +
- 38. Скачать презентацию
















 Карбоновые кислоты.
Карбоновые кислоты. Степень окисления
Степень окисления Радиохимия. Альфа-бета, және гамма-сәулеленудің табиғаты және қасиеті
Радиохимия. Альфа-бета, және гамма-сәулеленудің табиғаты және қасиеті Лекция 6. Химическая кинетика
Лекция 6. Химическая кинетика Металлы. Общая характеристика
Металлы. Общая характеристика Химический комплекс
Химический комплекс Коллигативные свойства растворов
Коллигативные свойства растворов Полимеры: польза или вред? Выполнила: Ученица 10 «А» класса Архипова Аятэ
Полимеры: польза или вред? Выполнила: Ученица 10 «А» класса Архипова Аятэ № 14.
№ 14.  Производство чугуна. (9 и 11 класс)
Производство чугуна. (9 и 11 класс) Кислородные соединения азота Азотная кислота МБОУ СОШ №30 г.Ростов-на-Дону
Кислородные соединения азота Азотная кислота МБОУ СОШ №30 г.Ростов-на-Дону Невидиме чорнило
Невидиме чорнило Топливо и его химические реакции при сгорании
Топливо и его химические реакции при сгорании Кристаллография. Точечные группы симметрии, принцип их вывода с помощью понятия о группах. Формы кристаллов низшей категории
Кристаллография. Точечные группы симметрии, принцип их вывода с помощью понятия о группах. Формы кристаллов низшей категории Нафта. Класифікація нафти
Нафта. Класифікація нафти Функциональные свойства и анализ каротиноидов в пищевых продуктах
Функциональные свойства и анализ каротиноидов в пищевых продуктах Получение металлов
Получение металлов  Лекарственные формы для глаз в условиях аптечного производства
Лекарственные формы для глаз в условиях аптечного производства Структурная механика композитов. Слоистый композит
Структурная механика композитов. Слоистый композит Основы теории и понятия высокоэффективной жидкостной хроматографии (ВЭЖХ)
Основы теории и понятия высокоэффективной жидкостной хроматографии (ВЭЖХ) Аттестационная работа. Методическая разработка по выполнению исследовательской работы Тайны поваренной соли
Аттестационная работа. Методическая разработка по выполнению исследовательской работы Тайны поваренной соли Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Точечные дефекты в кристаллах
Точечные дефекты в кристаллах Свойства химических элементов I и II А подгрупп периодической системы Д.И. Менделеева
Свойства химических элементов I и II А подгрупп периодической системы Д.И. Менделеева Алканы. Циклоалканы
Алканы. Циклоалканы Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы Алкалоидтар. Алкалоидтар негіздік қасиет
Алкалоидтар. Алкалоидтар негіздік қасиет Основы химической коррозии
Основы химической коррозии