Содержание
- 2. Правило. Найти самую длинную (главную) неразветвленную цепь углеродных атомов. Таким образом, в данном соединении главная цепь
- 3. Пронумеровать атомы углерода главной цепи. Номер атома углерода, у которого находится заместитель (алкильный радикал), должен быть
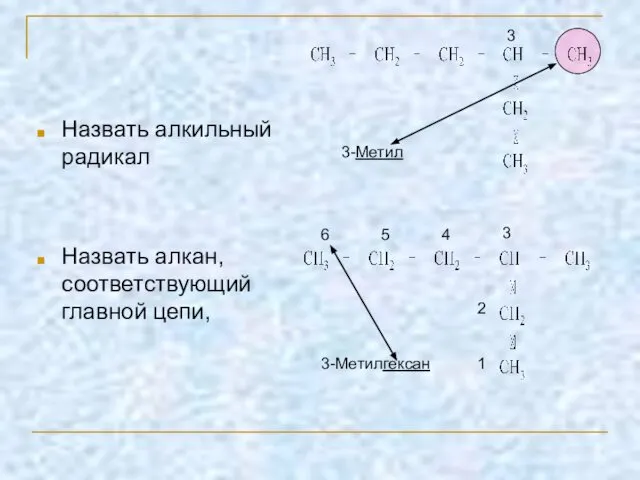
- 4. Назвать алкильный радикал Назвать алкан, соответствующий главной цепи, 3 3-Метил 3 6 5 4 2 1
- 5. В молекуле с несколькими одинаковыми заместителями нужно указать положение каждого заместителя. Сумма номеров положений заместителей должна
- 6. Свойства алканов
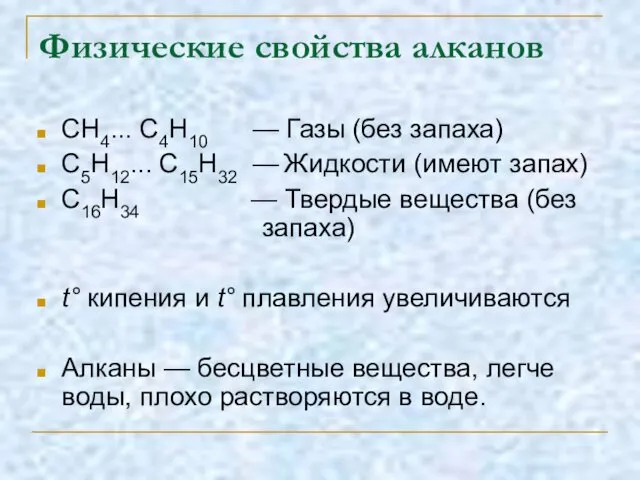
- 7. Физические свойства алканов СН4... С4Н10 — Газы (без запаха) С5Н12... С15Н32 — Жидкости (имеют запах) C16H34
- 8. Химические свойства алканов Для алканов наиболее характерны реакции замещения. В этих реакциях происходит гомолитическое расщепление ковалентных
- 9. Реакция замещения (разрыв связей С-Н) или
- 10. Галогенирование (замещение атома водорода атомом галогена с образованием галогеналкана RHal). Низшие алканы можно прохлорировать полностью. 1.1
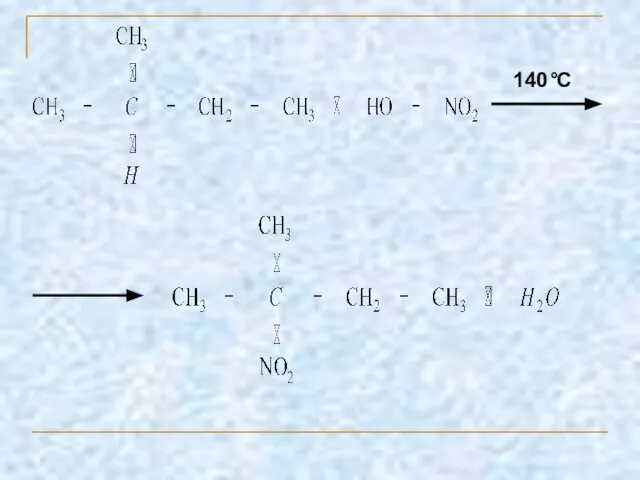
- 11. 1.2 Нитрование Нитрование (замещение атома водорода нитрогруппой — NO2 с образованием нитроалканов R—NO2). Нитрующий реагент —
- 12. 140°C
- 13. 1.3 Сульфирование. Замещение атома водорода сульфогруппой — SO3H с образованием алкансульфокислот. Сульфирующий реагент — серная кислота
- 14. 2. Реакция окисления При обычных условиях алканы устойчивы к действию окислителей (КMnО4, К2Сг207).
- 15. 2.1 Окисление кислородом воздуха при высоких температурах (горение). полное окисление (избыток О2) с образованием углекислого газа
- 16. 2.2 Окисление кислородом воздуха при невысоких температурах в присутствии катализаторов (не полное каталитическое окисление). В результате
- 17. 3. Термические превращения алканов 3.1 Крекинг. 3.2 Дегидрирование,
- 18. 3.1 Крекинг Крекинг (англ. cracking — расщепление) — это разрыв связей С — С в молекулах
- 19. 3.1 Дегидрирование Дегидрирование: отщепление водорода происходит в результате разрыва связей С — Н; Осуществляется в присутствии
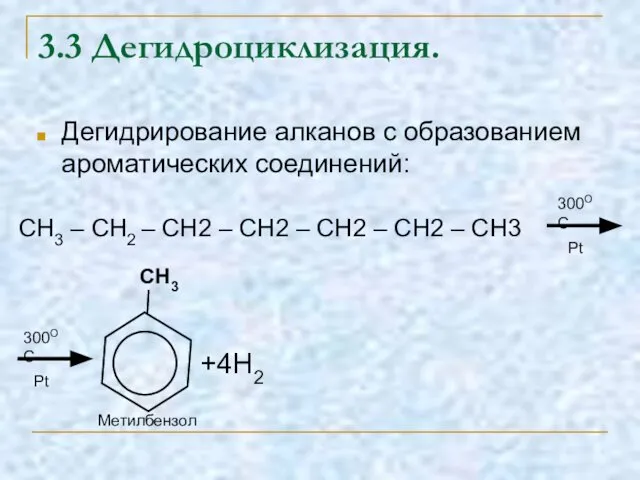
- 20. 3.3 Дегидроциклизация. Дегидрирование алканов с образованием ароматических соединений: CH3 – CH2 – CH2 – CH2 –
- 21. 3.4 Изомеризация Изомеризация – превращение химического соединения в его изомер: н-алкан → изоалкан
- 23. Скачать презентацию
















 Общая характеристика углерода
Общая характеристика углерода Физико-химиеские методы анализа (ФХМА)
Физико-химиеские методы анализа (ФХМА) Значение химии в повседневной жизни
Значение химии в повседневной жизни Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Тема урока: «Скорость химических реакций.» Цель урока : Знать определение скорости реагирующих веществ, от реакций; зависимости с
Тема урока: «Скорость химических реакций.» Цель урока : Знать определение скорости реагирующих веществ, от реакций; зависимости с Презентация Теллур
Презентация Теллур Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Соли. Формула соли
Соли. Формула соли 140 лет дому, который построил Д.И. Менделеев
140 лет дому, который построил Д.И. Менделеев Нафта
Нафта  Химические методы количественного анализа. Электрохимические методы
Химические методы количественного анализа. Электрохимические методы Презентация по Химии "Основні Фракції нафти" - скачать смотреть бесплатно
Презентация по Химии "Основні Фракції нафти" - скачать смотреть бесплатно Разработка реактора для отопления домов путем извлечения водорода из воды
Разработка реактора для отопления домов путем извлечения водорода из воды Золото
Золото Кислотность почвы
Кислотность почвы Соли и их классификация
Соли и их классификация Алотропні видозміни Карбона та їх застосування Розмаїтого Дмитра
Алотропні видозміни Карбона та їх застосування Розмаїтого Дмитра  Федотова Елена Анатольевна – учитель химии МБОУ Изыхская СОШ
Федотова Елена Анатольевна – учитель химии МБОУ Изыхская СОШ  Высокомолекулярные соединения и супрамолекулярные структуры. Синтез полимеров (Лекция 1)
Высокомолекулярные соединения и супрамолекулярные структуры. Синтез полимеров (Лекция 1) Степень окисления
Степень окисления Действующие вещества. Лексикон
Действующие вещества. Лексикон Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ Массовая доля
Массовая доля Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов Презентация по Химии "Чорна металургія. Сплави" - скачать смотреть бесплатно
Презентация по Химии "Чорна металургія. Сплави" - скачать смотреть бесплатно Наблюдения в сходящемся свете. Коноскопия
Наблюдения в сходящемся свете. Коноскопия Гетерогенные процессы и равновесия
Гетерогенные процессы и равновесия ИЗ ОПЫТА ИСПОЛЬЗОВАНИЯ ИНТЕРАКТИВНОЙ ДОСКИ НА УРОКАХ ХИМИИ.
ИЗ ОПЫТА ИСПОЛЬЗОВАНИЯ ИНТЕРАКТИВНОЙ ДОСКИ НА УРОКАХ ХИМИИ.