Содержание
- 2. ИОННАЯ СВЯЗЬ Na0 +11 2е,8е,1е Cl0 +17 2e,8e,7e Какой вид связи может образоваться между этими атомами?
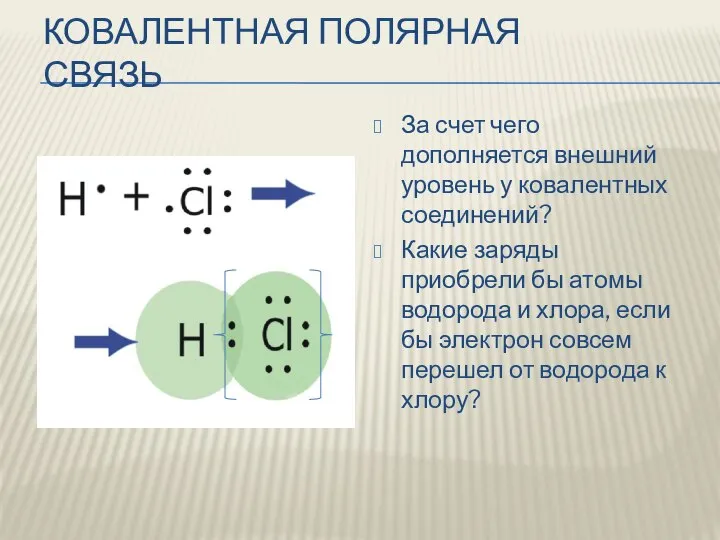
- 3. КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ За счет чего дополняется внешний уровень у ковалентных соединений? Какие заряды приобрели бы
- 4. БИНАРНЫЕ СОЕДИНЕНИЯ – Соединения, состоящие из двух видов атомов (NaCl, HCl, H2O, CO2)
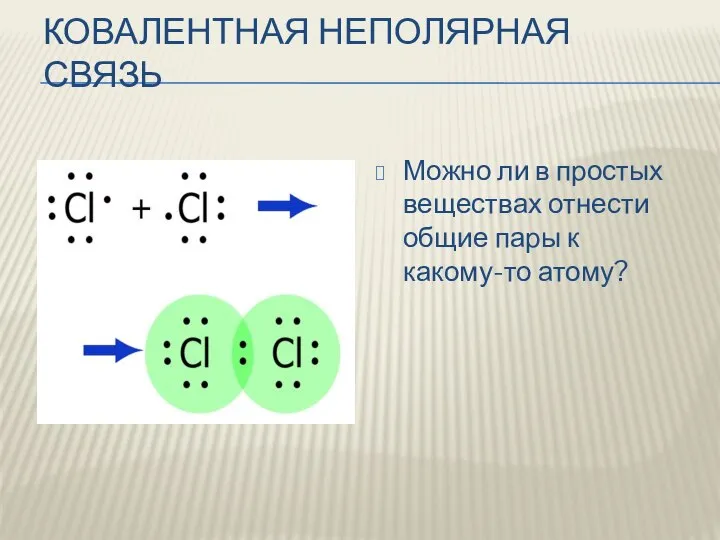
- 5. КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ Можно ли в простых веществах отнести общие пары к какому-то атому?
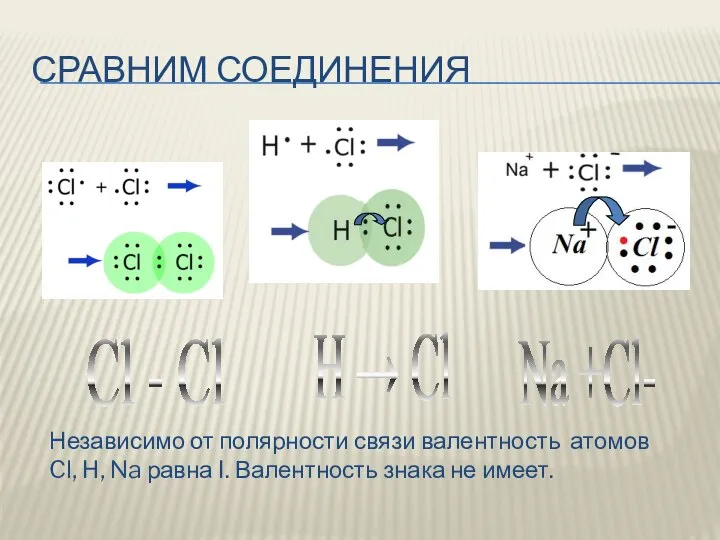
- 6. СРАВНИМ СОЕДИНЕНИЯ H → Cl Cl - Cl Na +Cl- Независимо от полярности связи валентность атомов
- 7. СТЕПЕНЬ ОКИСЛЕНИЯ – Это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что
- 8. ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ: Степень окисления свободных атомов и простых веществ равна 0: ( Mg0, N20,
- 9. ПРОМЕЖУТОЧНЫЕ С.О. Рассмотрим возможные с.о. серы – S Максимальная +6 SO3 Минимальная -2 H2S Сера может
- 10. КАК ОПРЕДЕЛИТЬ СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТА В СОЕДИНЕНИИ? (С. 88) 1) Определение степеней окисления начинают с того
- 11. ЗАДАНИЕ : Определите С.О. по формулам: Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O
- 12. АЛГОРИТМ НАЗВАНИЯ БИНАРНЫХ СОЕДИНЕНИЙ: Пример: Al+32O-23 – оксид алюминия; Cu+2O-2 – оксид меди (II) Cl-1 –
- 13. АЛГОРИТМ СОСТАВЛЕНИЯ ФОРМУЛ ПО НАЗВАНИЯМ: Записать знаки элементов (частиц) в порядке: на первом месте – положительно
- 14. ЗАДАНИЕ: Составить формулы веществ по названиям: хлорид кальция оксид железа (III) оксид азота (V) хлорид серы
- 16. Скачать презентацию










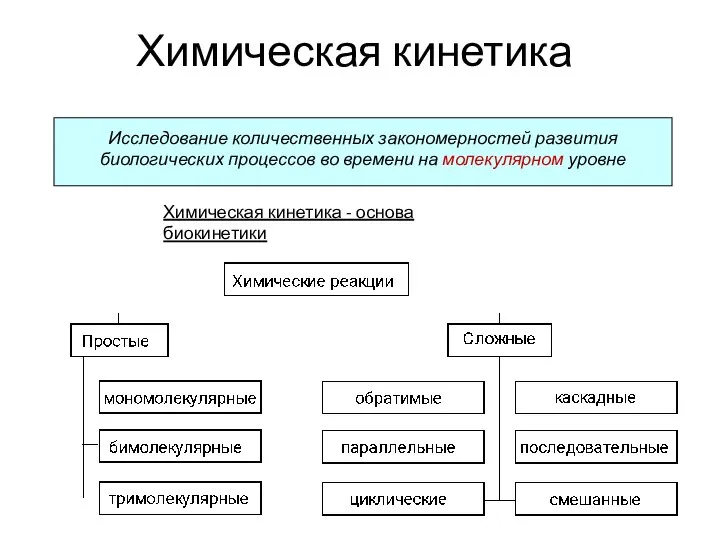 Химическая кинетика
Химическая кинетика Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина друга)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина друга) Неметаллы
Неметаллы Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Концепция метанольной экономики
Концепция метанольной экономики I закон термодинамики, его применение для расчёта тепловых эффектов
I закон термодинамики, его применение для расчёта тепловых эффектов Ковалентная связь. Радикалы
Ковалентная связь. Радикалы Жидкостная хроматография
Жидкостная хроматография Количество вещества, моль, молярная масса, молярный объем
Количество вещества, моль, молярная масса, молярный объем Химический элемент натрий
Химический элемент натрий Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..
Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..  Основы гетерогенного катализа и производство катализаторов
Основы гетерогенного катализа и производство катализаторов Повторение по химии (8 класс)
Повторение по химии (8 класс) Линии и точки диаграммы Fe-Fe3С. Сплавы железа с углеродом. Углеродистые стали, их характеристики и маркировка. (Лекция 4)
Линии и точки диаграммы Fe-Fe3С. Сплавы железа с углеродом. Углеродистые стали, их характеристики и маркировка. (Лекция 4) АБС-пластик. Свойства
АБС-пластик. Свойства Презентация по химии Угарный газ
Презентация по химии Угарный газ  Биологическая эффективность гербицида Miuris 125 в борьбе с однодольными сорными растениями в посевах сой
Биологическая эффективность гербицида Miuris 125 в борьбе с однодольными сорными растениями в посевах сой Аминокислоты. Белки
Аминокислоты. Белки Презентация по химии Удобрения и их классификация
Презентация по химии Удобрения и их классификация Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Техника безопасности на уроках химии
Техника безопасности на уроках химии Гибридизация атома углерода
Гибридизация атома углерода Шестая группа элементов
Шестая группа элементов Требования к осадителю
Требования к осадителю Одноатомные спирты. Химические свойства
Одноатомные спирты. Химические свойства «Химия и повседневная жизнь человека» Программа элективного курса для 9-го класса МОУ СОШ с. Георгиевка Чупра Н.Б. учител
«Химия и повседневная жизнь человека» Программа элективного курса для 9-го класса МОУ СОШ с. Георгиевка Чупра Н.Б. учител Презентация Дисперсные системы
Презентация Дисперсные системы