Содержание
- 2. Краткий план 1. Общая классификация методов анализа. 2. Общие способы расчета концентрации веществ. 3. Титриметрические методы
- 3. Общие понятия Аналитический сигнал – среднее значение результатов измерения физической величины в заключительной стадии анализа, функционально
- 4. Классификация методов анализа 1. Химические методы – основаны на использовании химической реакции. 1.1. Титриметрические методы –
- 5. Классификация методов анализа (продолжение) 4. Хроматографические методы – гибридные методы анализа, основанные на разделении анализируемых веществ
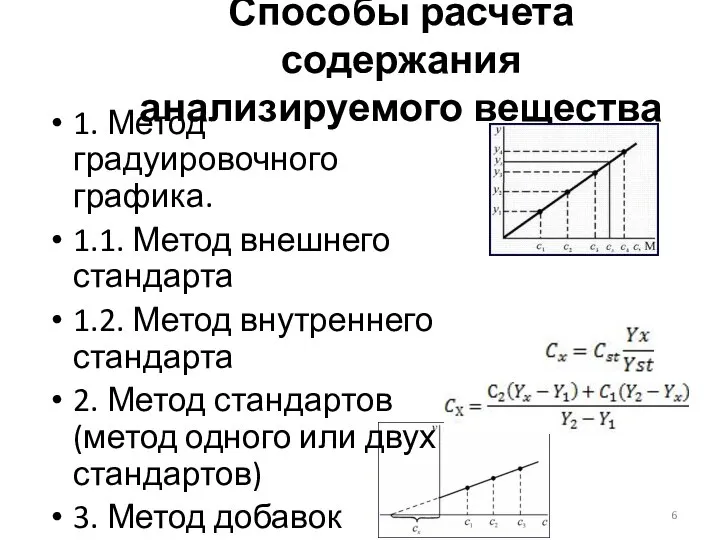
- 6. Способы расчета содержания анализируемого вещества 1. Метод градуировочного графика. 1.1. Метод внешнего стандарта 1.2. Метод внутреннего
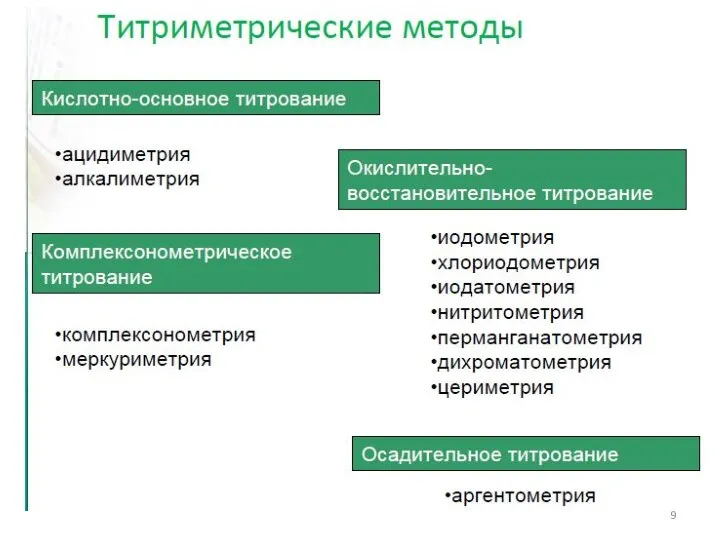
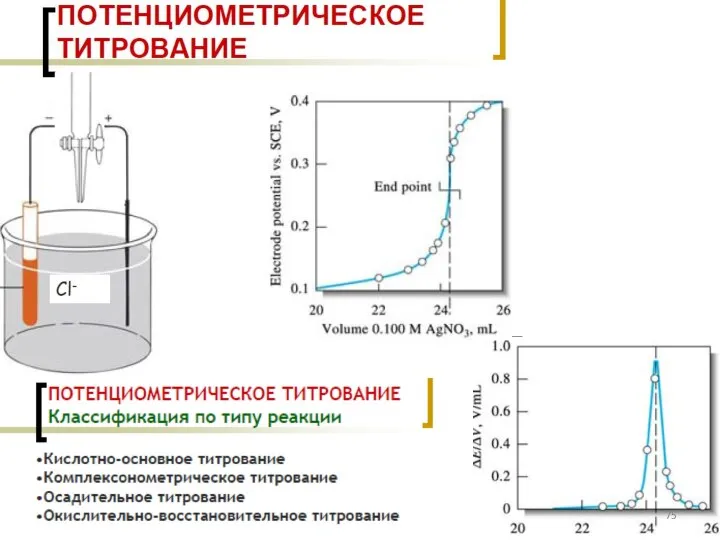
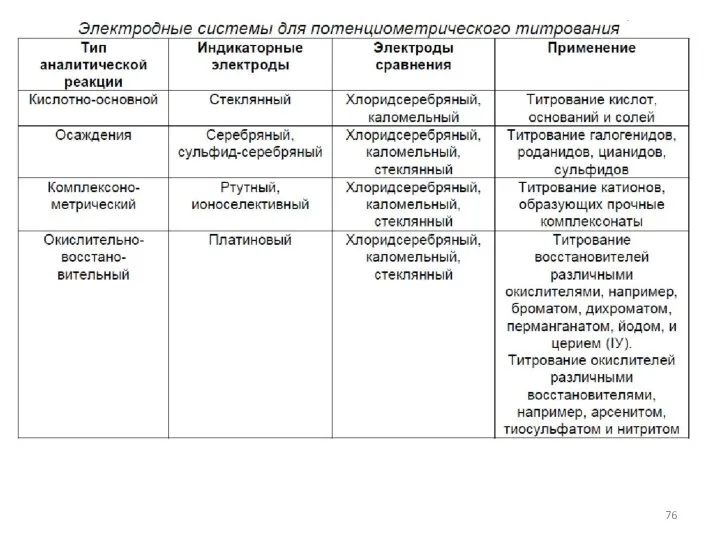
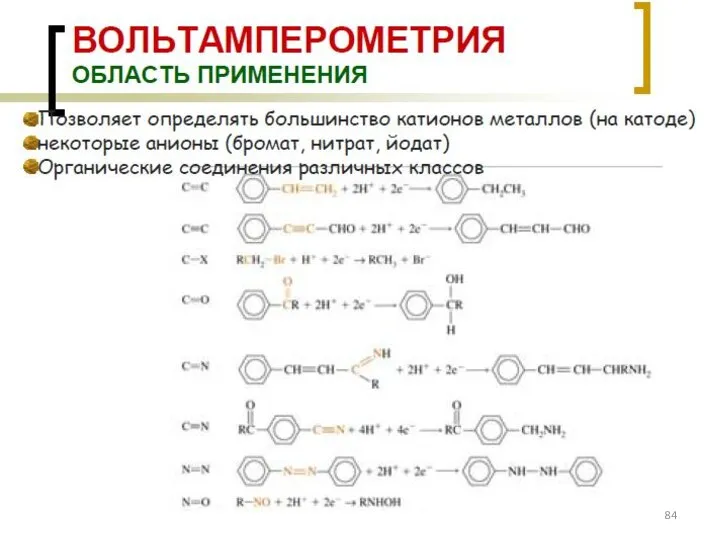
- 8. Классификация титриметрических методов анализа По типу химической реакции: 1. Кислотно-основное титрование (протолитические реакции). 2. Комплексонометрическое титрование
- 10. По способу выполнения
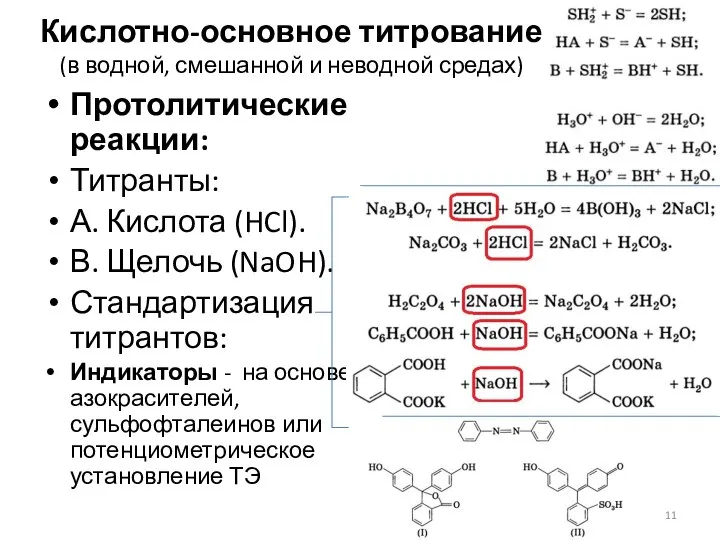
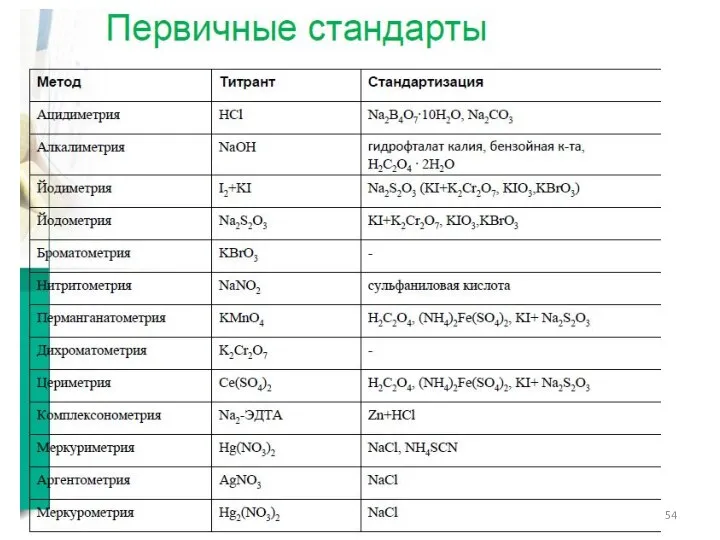
- 11. Кислотно-основное титрование (в водной, смешанной и неводной средах) Протолитические реакции: Титранты: А. Кислота (HCl). В. Щелочь
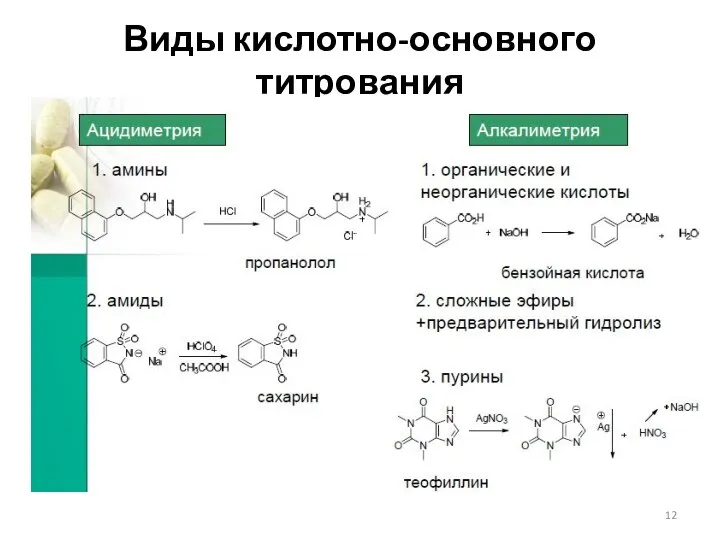
- 12. Виды кислотно-основного титрования
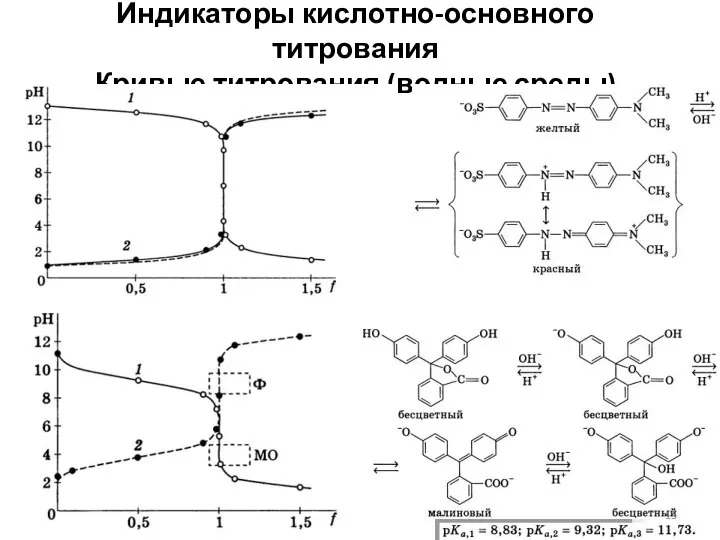
- 13. Индикаторы кислотно-основного титрования Кривые титрования (водные среды)
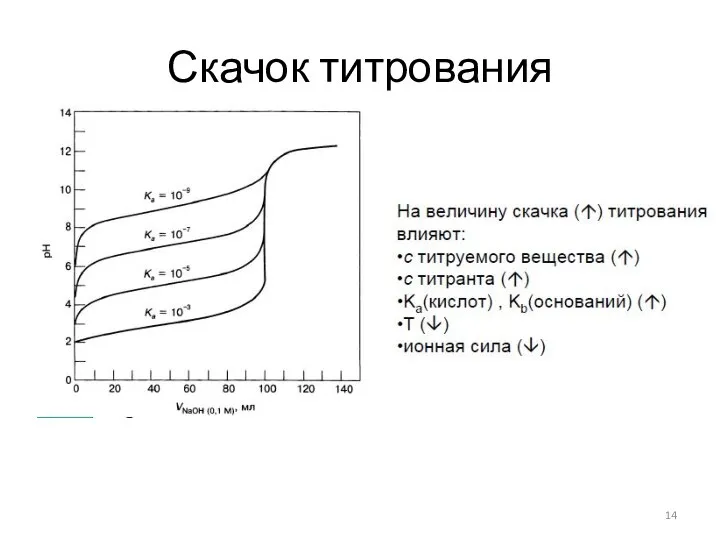
- 14. Скачок титрования
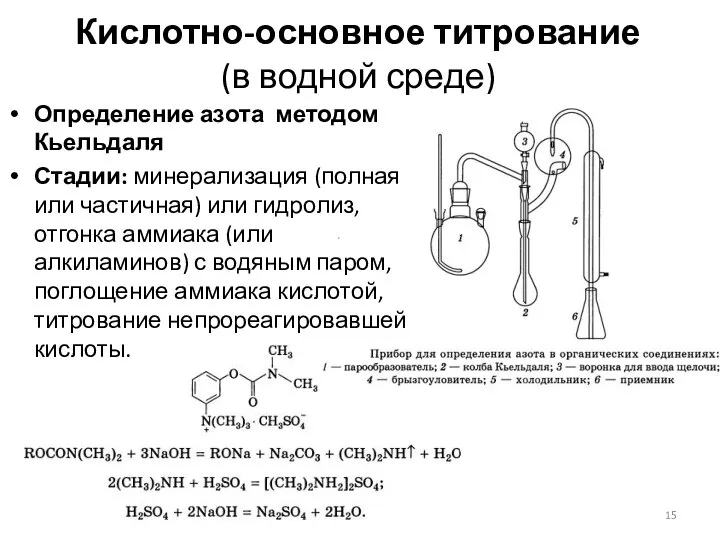
- 15. Кислотно-основное титрование (в водной среде) Определение азота методом Кьельдаля Стадии: минерализация (полная или частичная) или гидролиз,
- 16. Кислотно-основное титрование (в смешанных средах) Используют, когда ЛВ плохо растворимо в воде (органический растворитель используют для
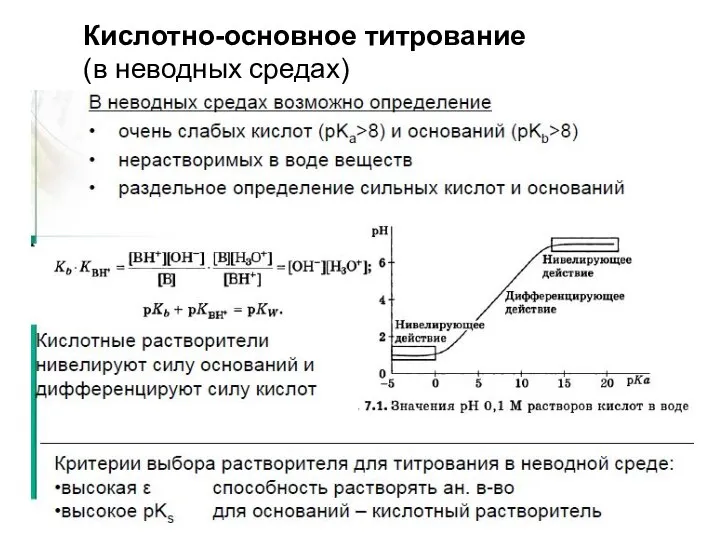
- 17. Кислотно-основное титрование (в неводных средах) Критерии выбора растворителя: 1. Для оснований – выбирается кислота (безводная уксусная,
- 18. Кислотно-основное титрование (в неводных средах)
- 19. Кислотно-основное титрование (неводное титрование)
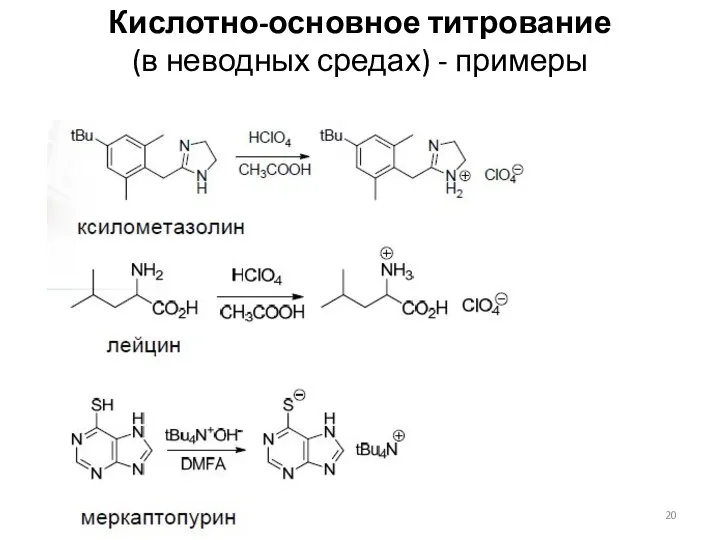
- 20. Кислотно-основное титрование (в неводных средах) - примеры
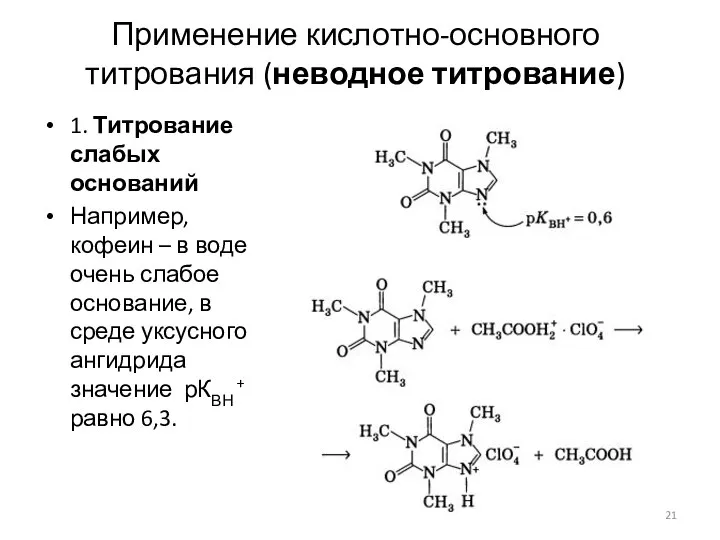
- 21. Применение кислотно-основного титрования (неводное титрование) 1. Титрование слабых оснований Например, кофеин – в воде очень слабое
- 22. Общая схема неводного титрования слабых оснований
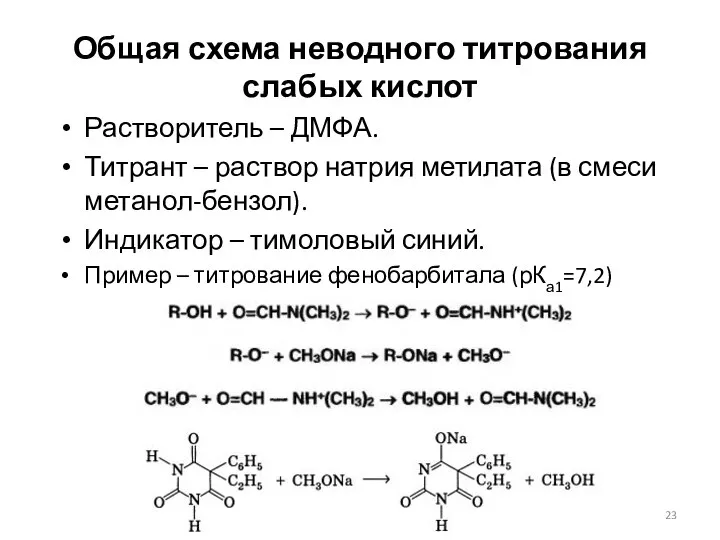
- 23. Общая схема неводного титрования слабых кислот Растворитель – ДМФА. Титрант – раствор натрия метилата (в смеси
- 24. Комплексонометрическое титрование Группа титриметрических методов, основанная на реакциях образования растворимых комплексных соединений. - меркуриметрия (монодентантные комплексы
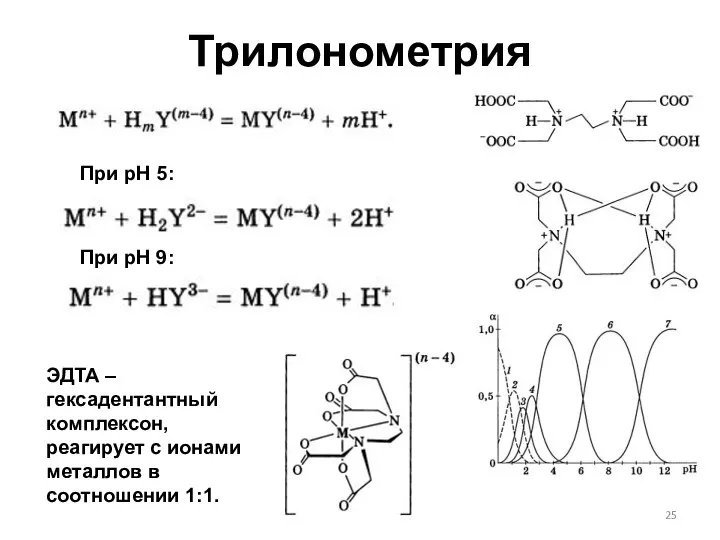
- 25. Трилонометрия При рН 5: При рН 9: ЭДТА – гексадентантный комплексон, реагирует с ионами металлов в
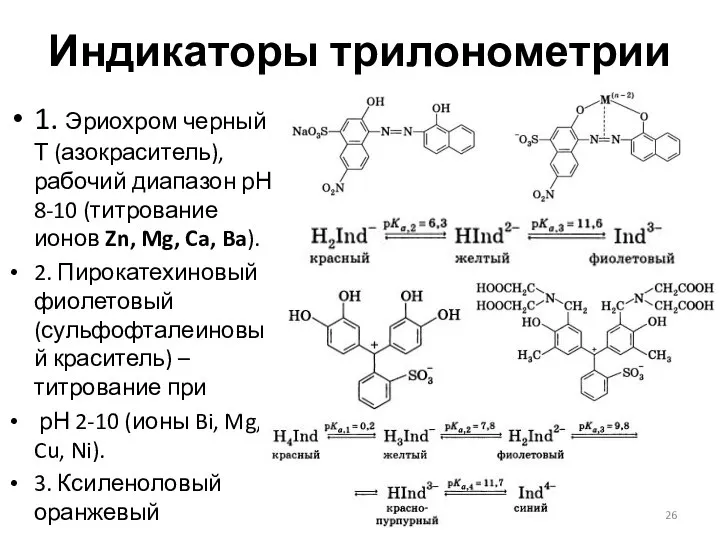
- 26. Индикаторы трилонометрии 1. Эриохром черный Т (азокраситель), рабочий диапазон рН 8-10 (титрование ионов Zn, Mg, Ca,
- 27. Примеры применения металлохромных индикаторов До ТЭ После ТЭ
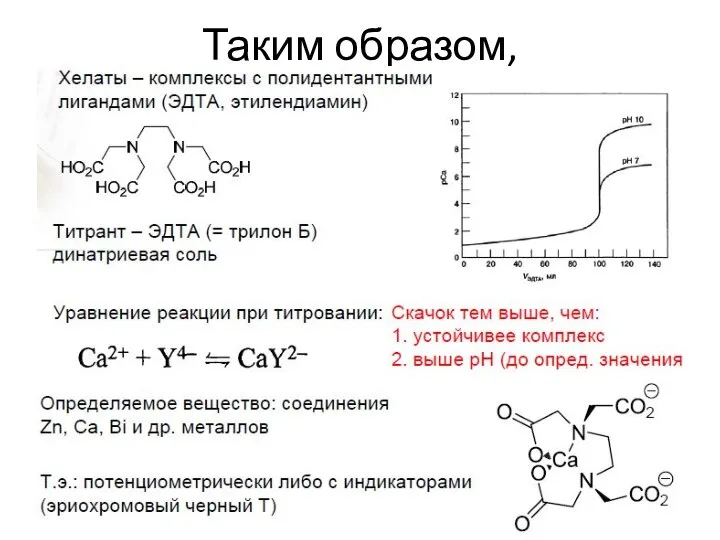
- 28. Таким образом,
- 29. Окислительно-восстановительное титрование Группа титриметрических методов, основанная на использовании ОВ-реакций. Классификация:
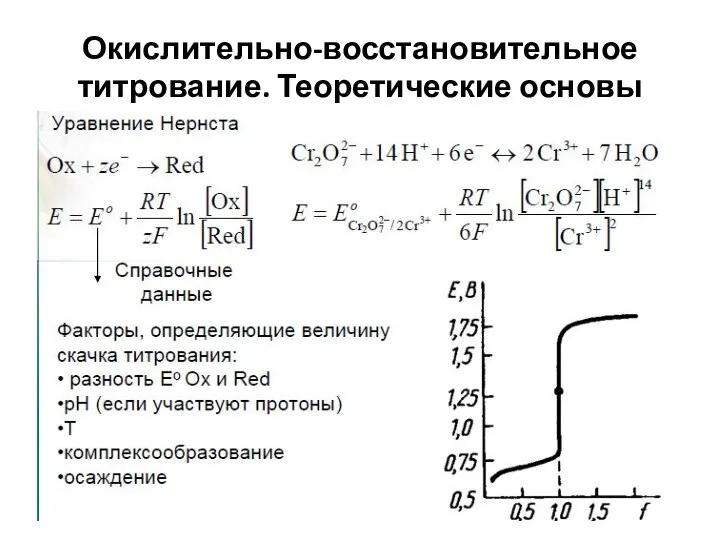
- 30. Окислительно-восстановительное титрование. Теоретические основы
- 31. Окислительно-восстановительное титрование. Теоретические основы
- 32. Индикаторы ОВ-титрования (принципы действия)
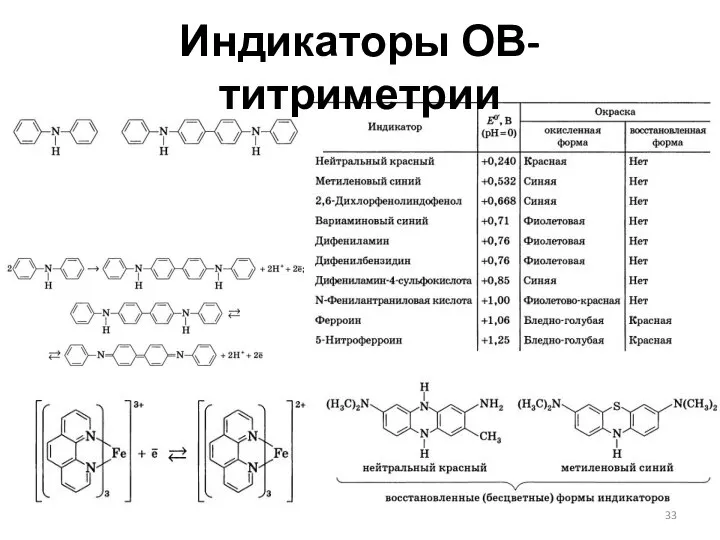
- 33. Индикаторы ОВ-титриметрии
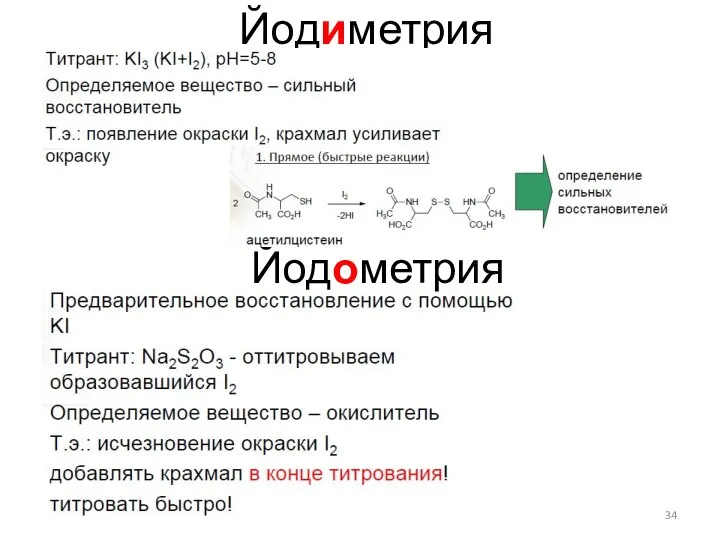
- 34. Йодиметрия Йодометрия
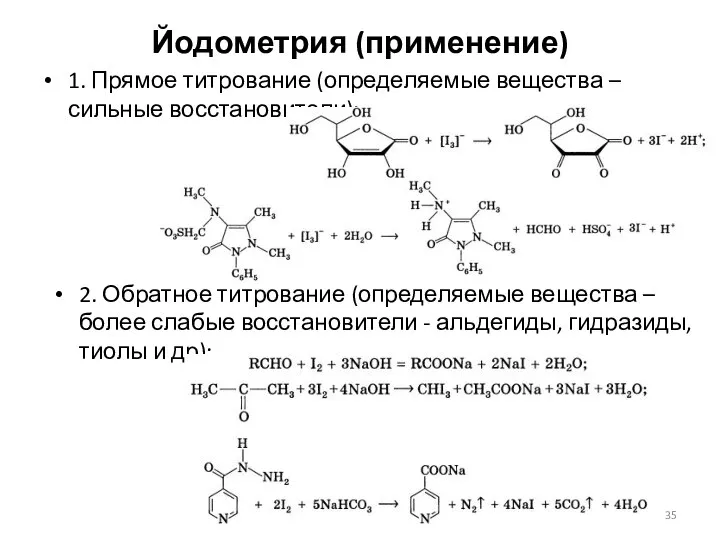
- 35. Йодометрия (применение) 1. Прямое титрование (определяемые вещества – сильные восстановители): 2. Обратное титрование (определяемые вещества –
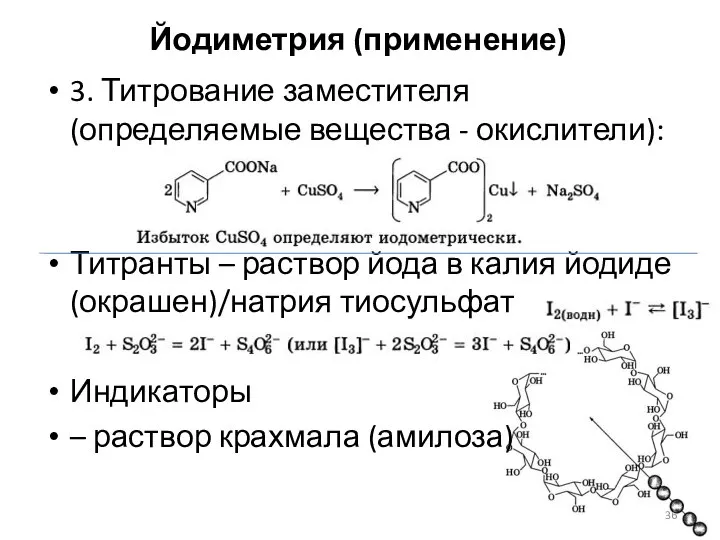
- 36. Йодиметрия (применение) 3. Титрование заместителя (определяемые вещества - окислители): Титранты – раствор йода в калия йодиде
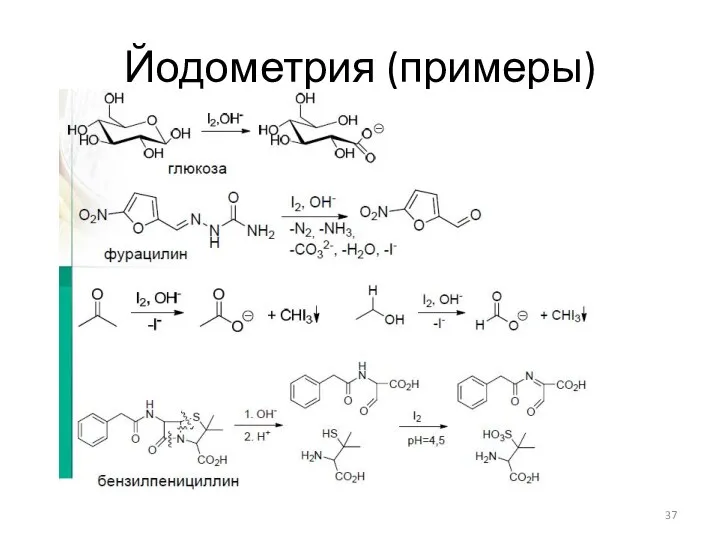
- 37. Йодометрия (примеры)
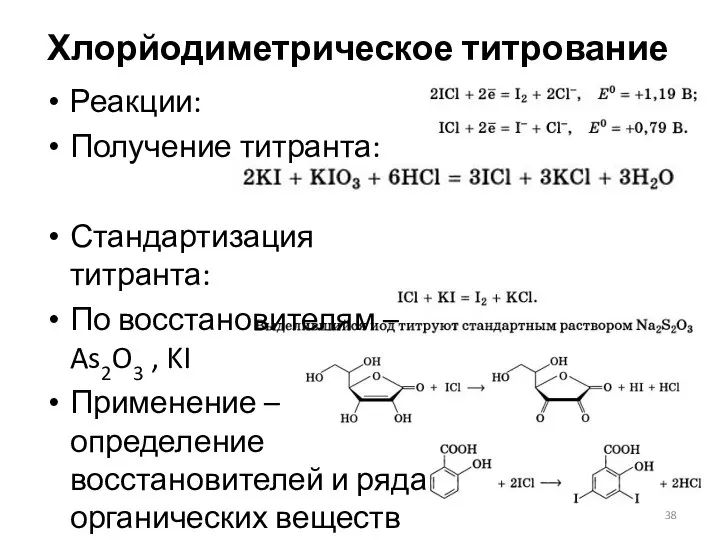
- 38. Хлорйодиметрическое титрование Реакции: Получение титранта: Стандартизация титранта: По восстановителям – As2O3 , KI Применение – определение
- 39. Хлорйодиметрическое титрование (применение) Определение йодного числа – массы йода, присоединяющегося к 100 г органического вещества. Йодное
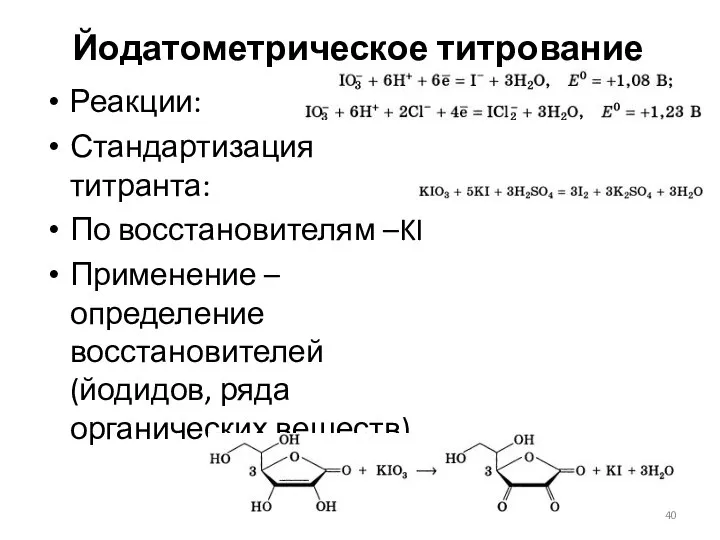
- 40. Йодатометрическое титрование Реакции: Стандартизация титранта: По восстановителям –KI Применение – определение восстановителей (йодидов, ряда органических веществ)
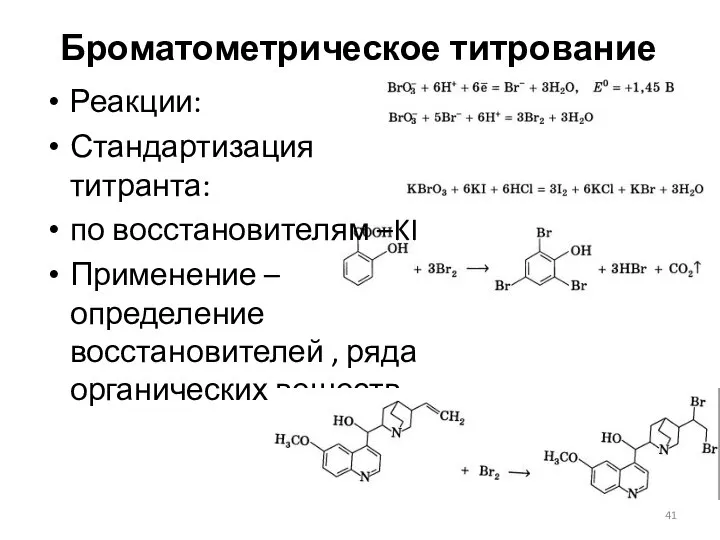
- 41. Броматометрическое титрование Реакции: Стандартизация титранта: по восстановителям –KI Применение – определение восстановителей , ряда органических веществ
- 42. Броматометрия (варианты)
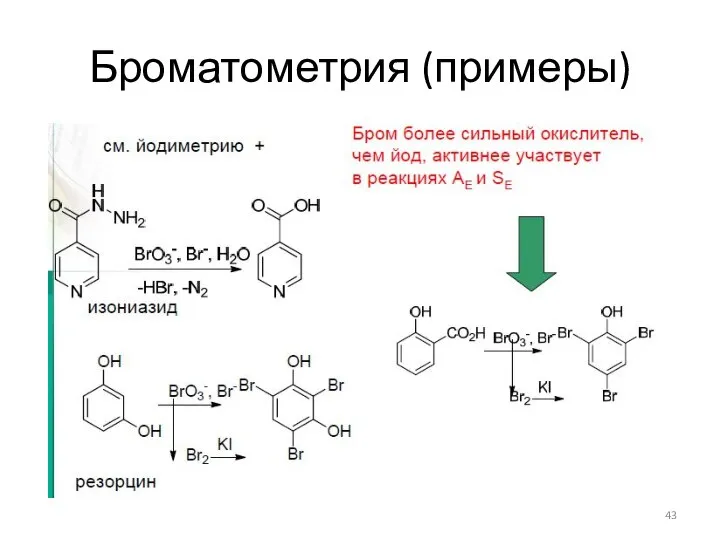
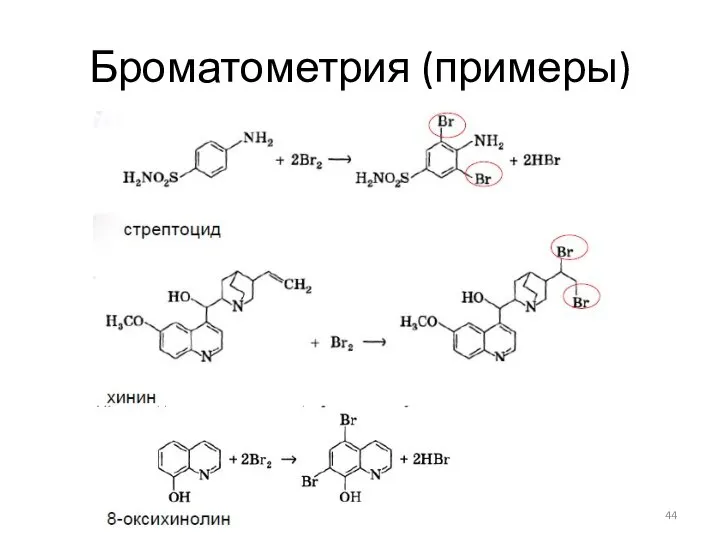
- 43. Броматометрия (примеры)
- 44. Броматометрия (примеры)
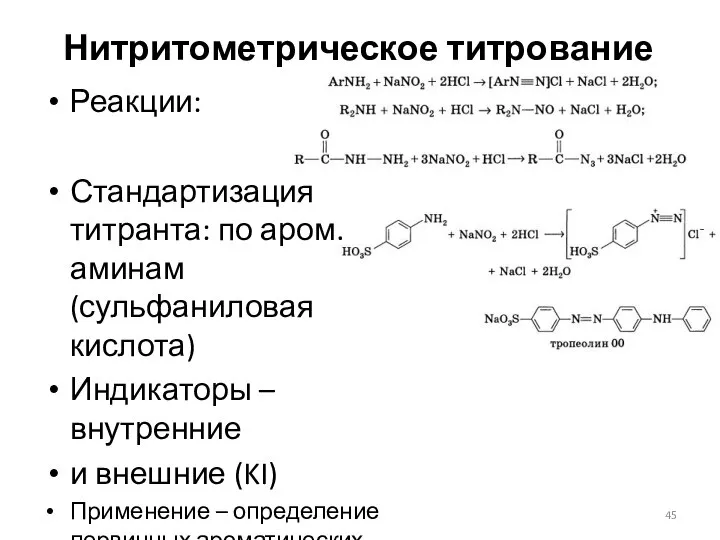
- 45. Нитритометрическое титрование Реакции: Стандартизация титранта: по аром. аминам (сульфаниловая кислота) Индикаторы – внутренние и внешние (KI)
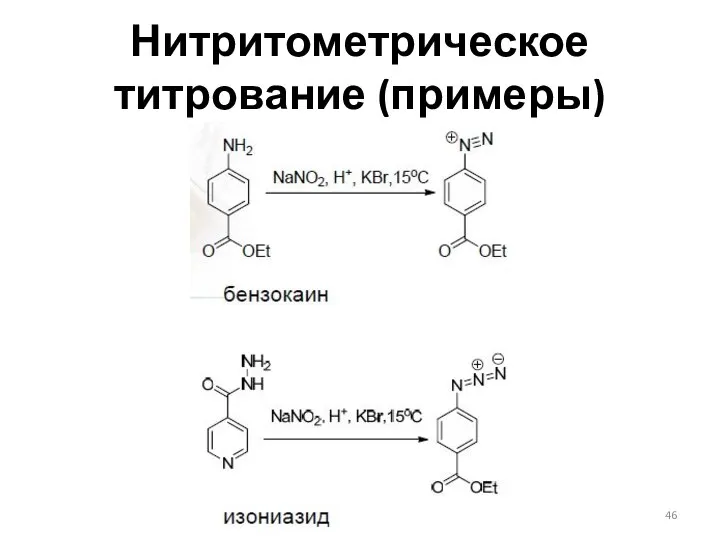
- 46. Нитритометрическое титрование (примеры)
- 47. Перманганатометрическое титрование Реакции: Стандартизация титранта: по оксалат-иону Индикаторы – ферроин Применение – прямое, Обратное, косвенное титрование
- 48. Дихроматометрическое титрование Реакции: Стандартизация титранта: не требуется (дихромат калия – первичный стандарт). Индикаторы – дифениламин, ферроин
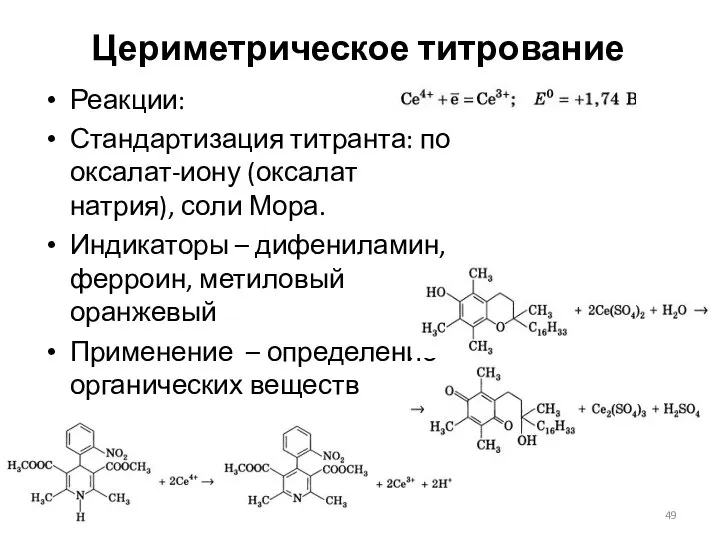
- 49. Цериметрическое титрование Реакции: Стандартизация титранта: по оксалат-иону (оксалат натрия), соли Мора. Индикаторы – дифениламин, ферроин, метиловый
- 50. Осадительное титрование
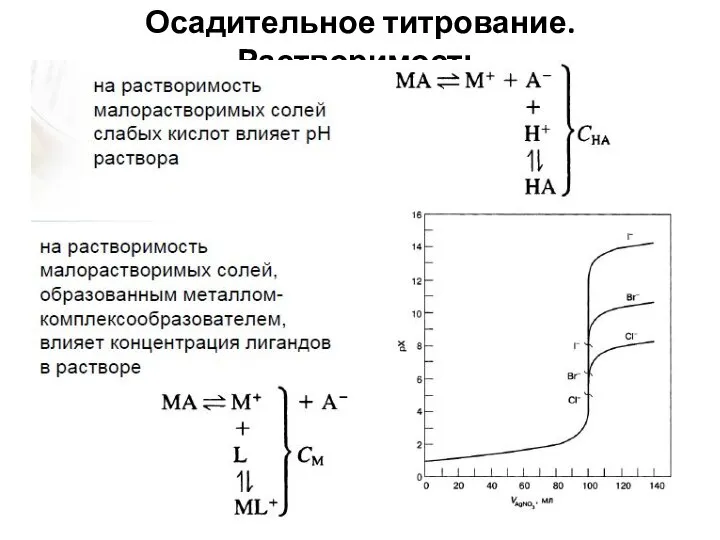
- 51. Осадительное титрование. Растворимость
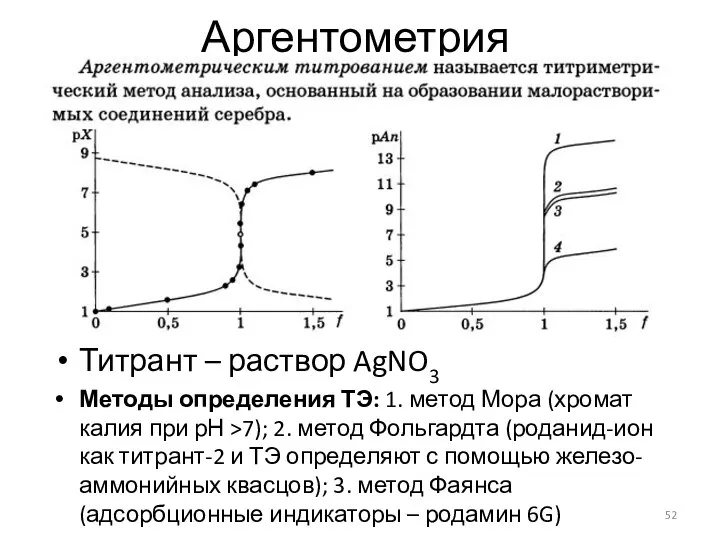
- 52. Аргентометрия Титрант – раствор AgNO3 Методы определения ТЭ: 1. метод Мора (хромат калия при рН >7);
- 53. Общая характеристика титриметрических методов Достоинства: 1. Высокая точность (погрешность измерения при содержаниях вещества 10-100% - менее
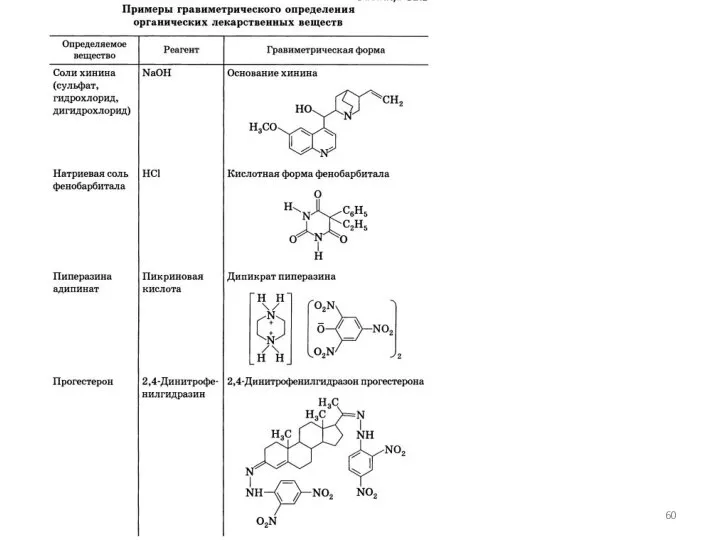
- 55. Гравиметрия совокупность методов количественного анализа, основанных на измерении массы вещества или его составных частей, выделенных в
- 56. ЭТАПЫ ГРАВИМЕТРИЧЕС-КОГО АНАЛИЗА ВЛИЯНИЕ РАСТВОРИМОСТИ
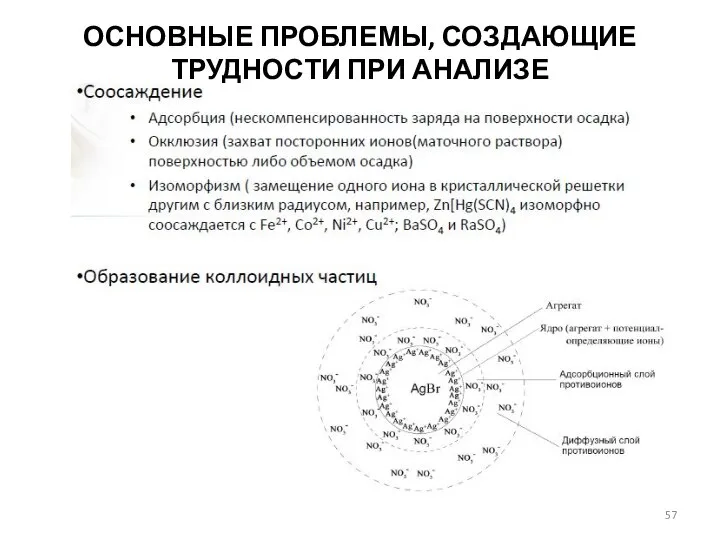
- 57. ОСНОВНЫЕ ПРОБЛЕМЫ, СОЗДАЮЩИЕ ТРУДНОСТИ ПРИ АНАЛИЗЕ
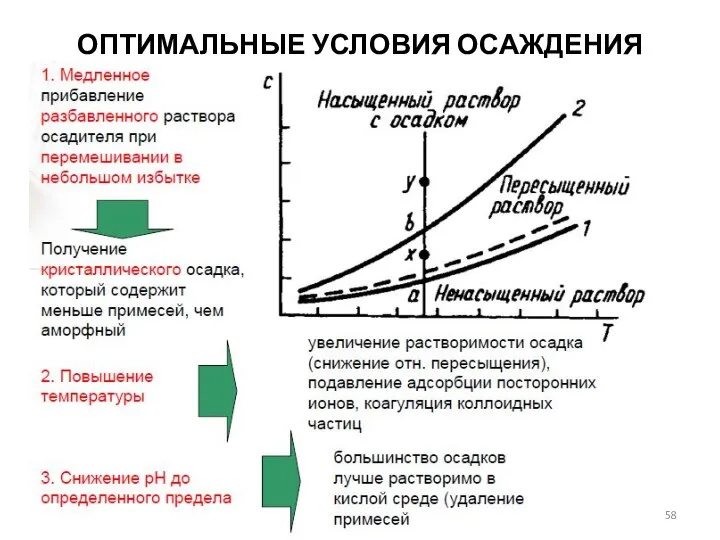
- 58. ОПТИМАЛЬНЫЕ УСЛОВИЯ ОСАЖДЕНИЯ
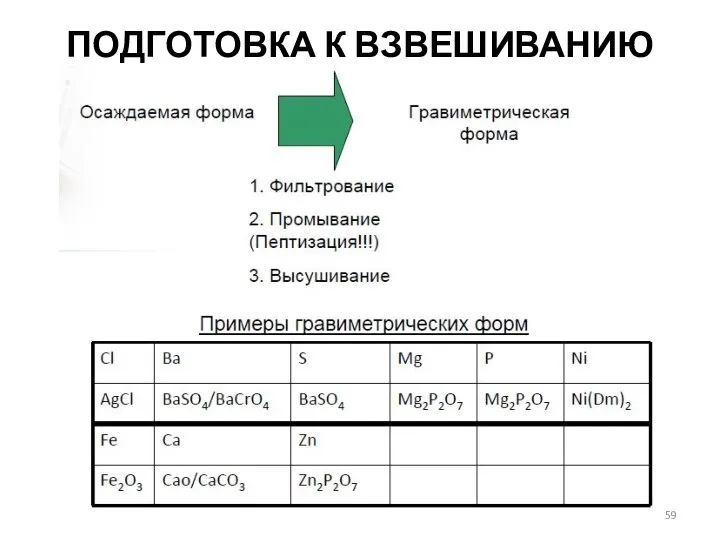
- 59. ПОДГОТОВКА К ВЗВЕШИВАНИЮ
- 61. Электрохимические методы анализа основаны на измерении сигнала (потенциал, сила тока, сопротивление, количество электричества) в результате взаимодействия
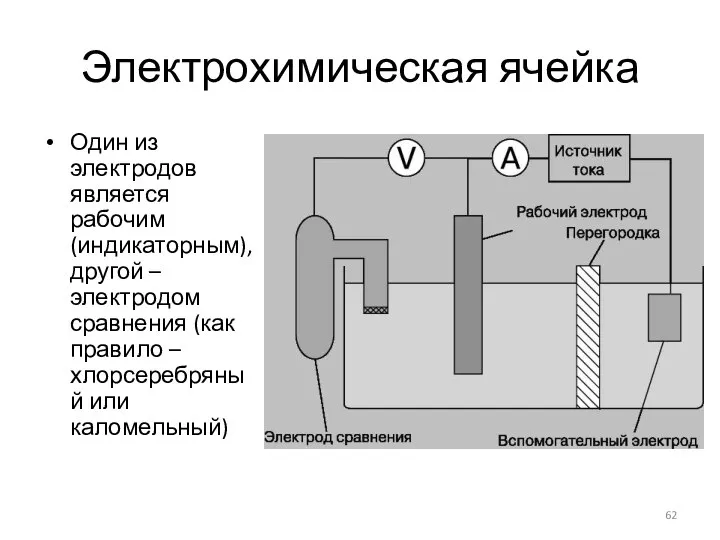
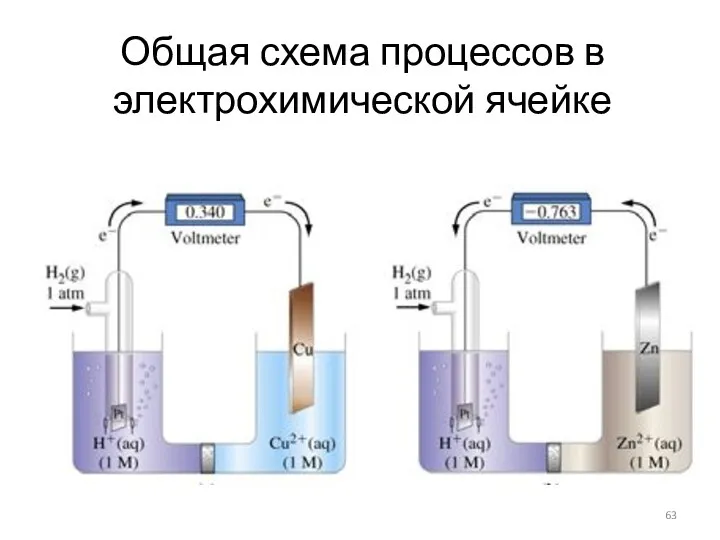
- 62. Электрохимическая ячейка Один из электродов является рабочим (индикаторным), другой – электродом сравнения (как правило – хлорсеребряный
- 63. Общая схема процессов в электрохимической ячейке
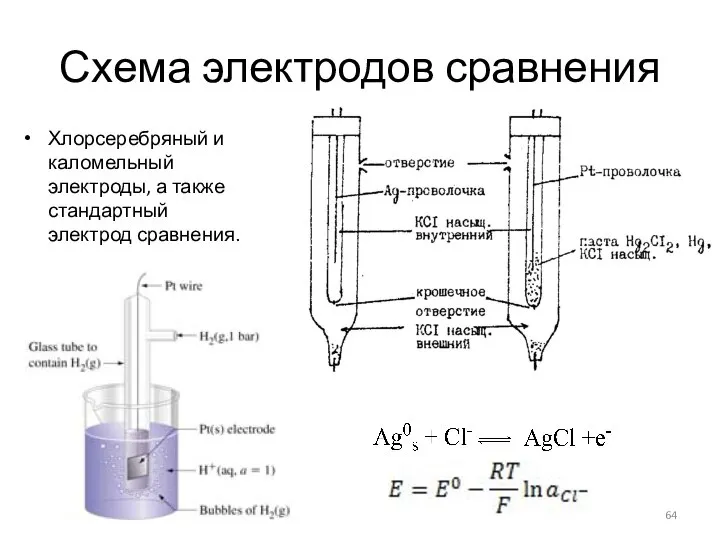
- 64. Схема электродов сравнения Хлорсеребряный и каломельный электроды, а также стандартный электрод сравнения.
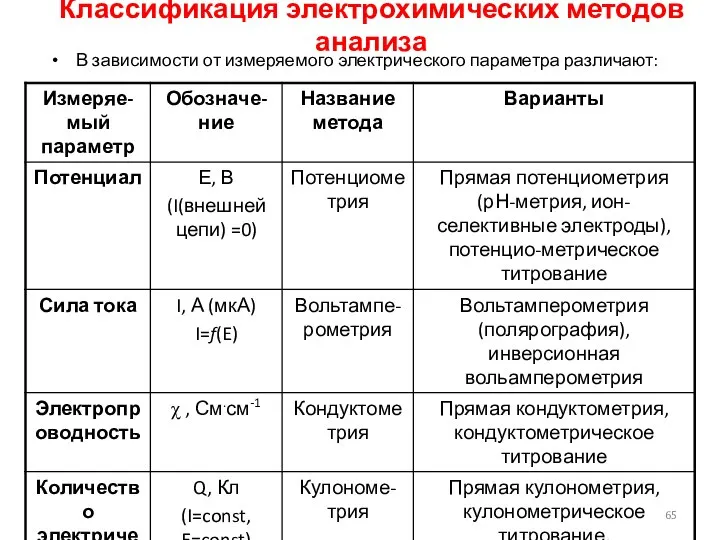
- 65. Классификация электрохимических методов анализа В зависимости от измеряемого электрического параметра различают:
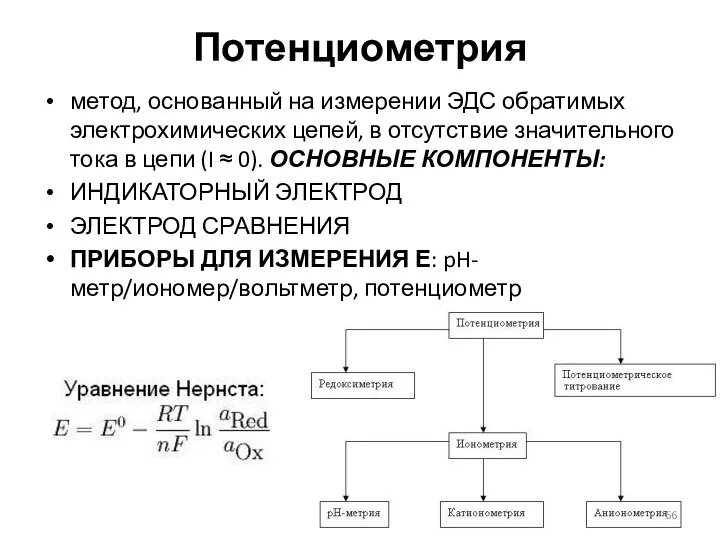
- 66. Потенциометрия метод, основанный на измерении ЭДС обратимых электрохимических цепей, в отсутствие значительного тока в цепи (I
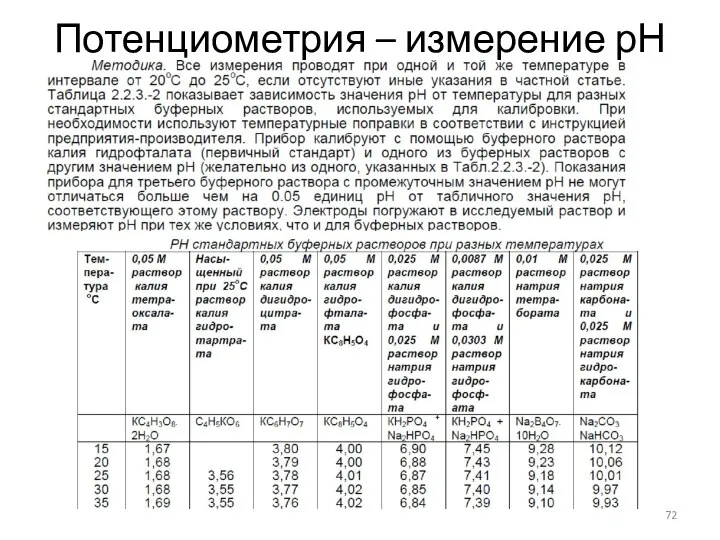
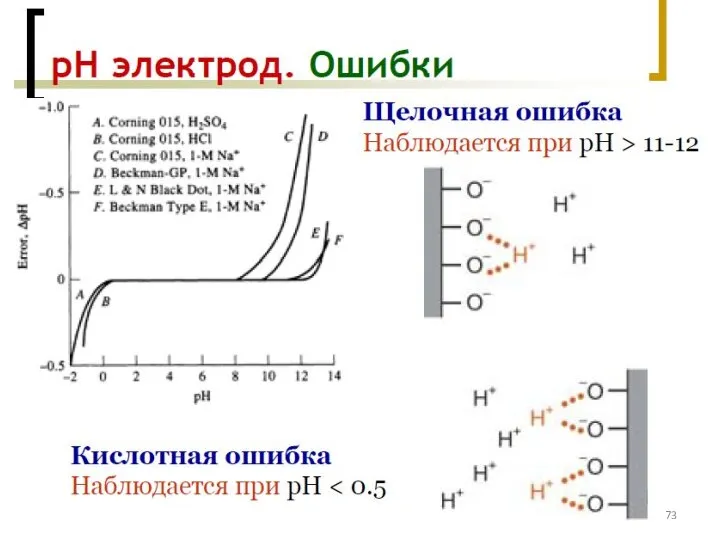
- 72. Потенциометрия – измерение рН
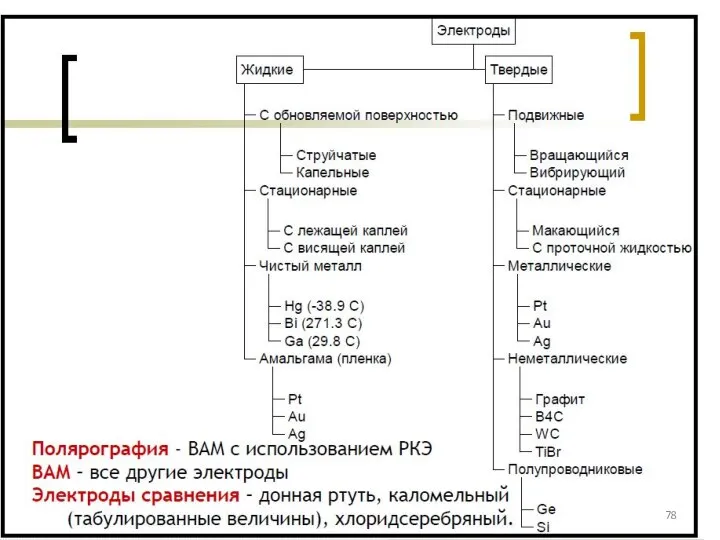
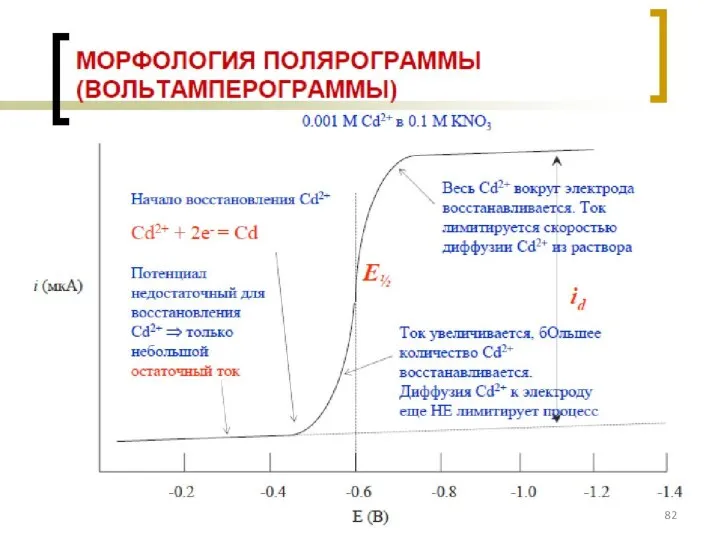
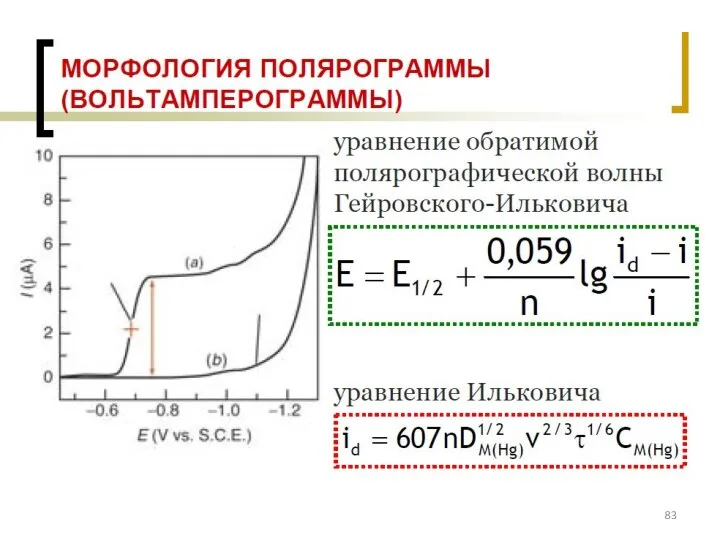
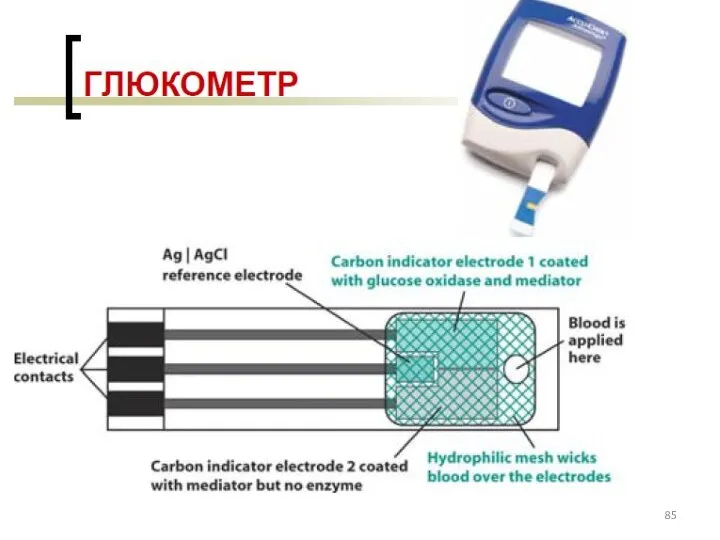
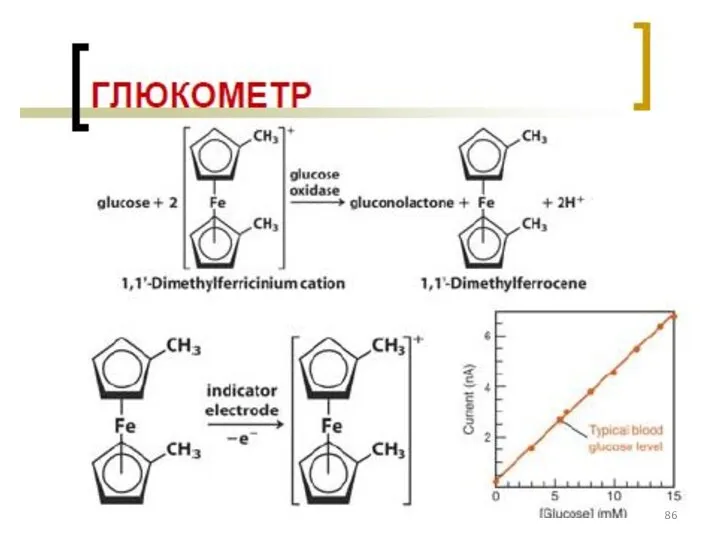
- 77. Классификация электродов ВАМ: см. на след. слайде
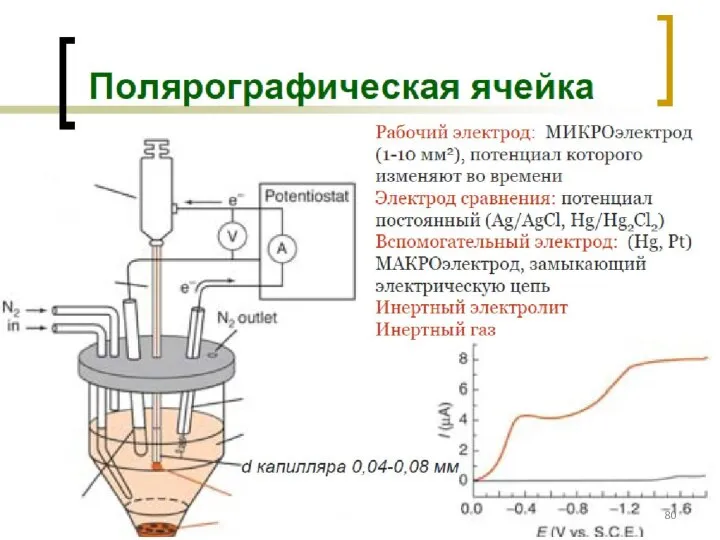
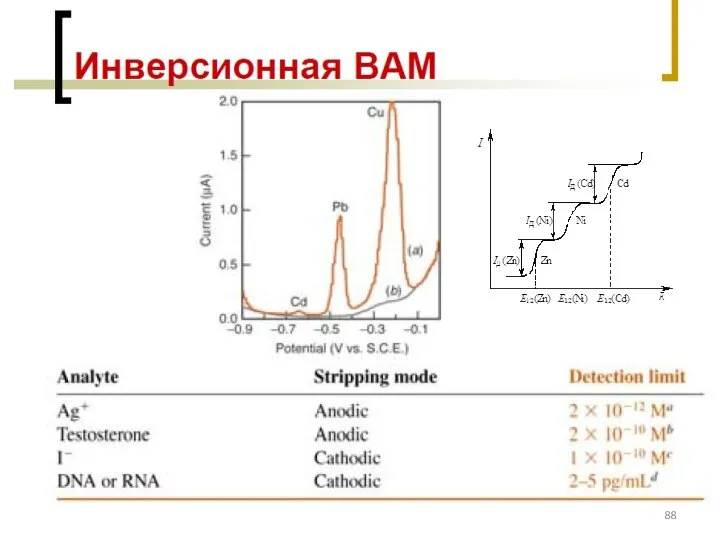
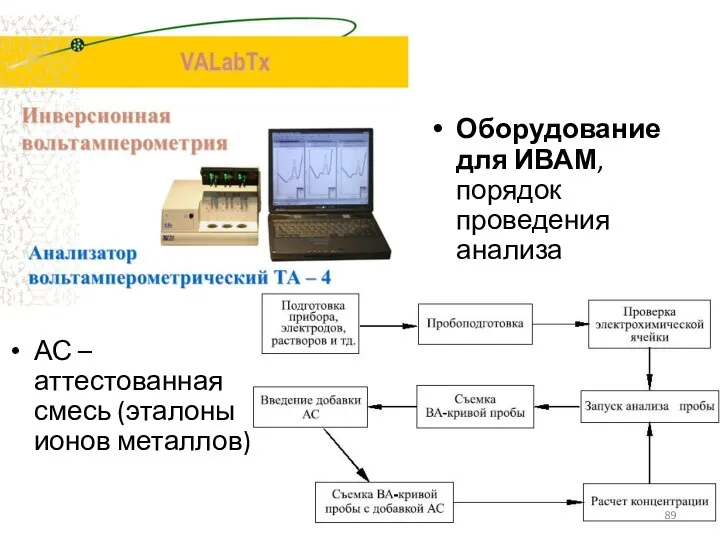
- 89. Оборудование для ИВАМ, порядок проведения анализа АС – аттестованная смесь (эталоны ионов металлов)
- 92. Кондуктометрия совокупность электрохимических методов анализа, основанных на измерении электропроводности c растворов электролитов (жидких электролитов), которая пропорциональна
- 93. Характеристические кривые бесконтактных высокочастотных ячеек: 1,2,3 - зависимости обратных величин активной, емкостной и индуктивной составляющих Z
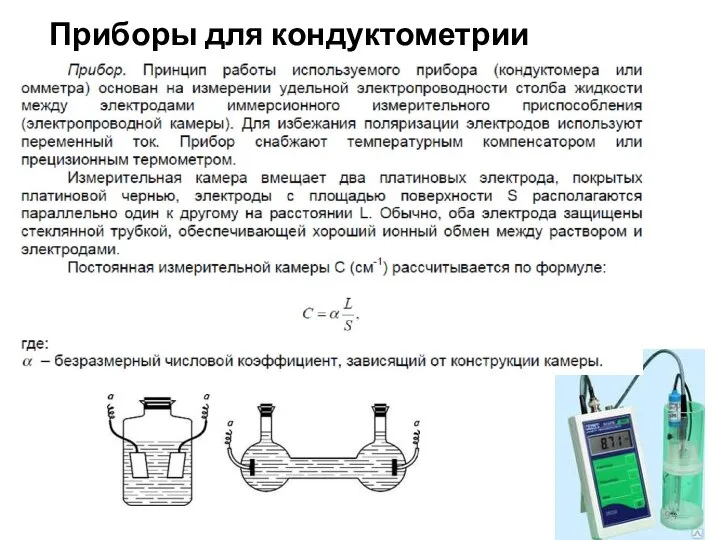
- 94. Приборы для кондуктометрии
- 95. Варианты проведения кондуктометрических измерений
- 96. Кондуктометрический метод анализа Достоинства: 1. высокая чувствительность (нижняя граница определяемых концентраций около 10-4-10-5 М), 2. достаточно
- 97. Кулонометрия Кулонометрический метод анализа основан на применении известного закона Фарадея, связывающего количество прореагировавшего на электроде вещества
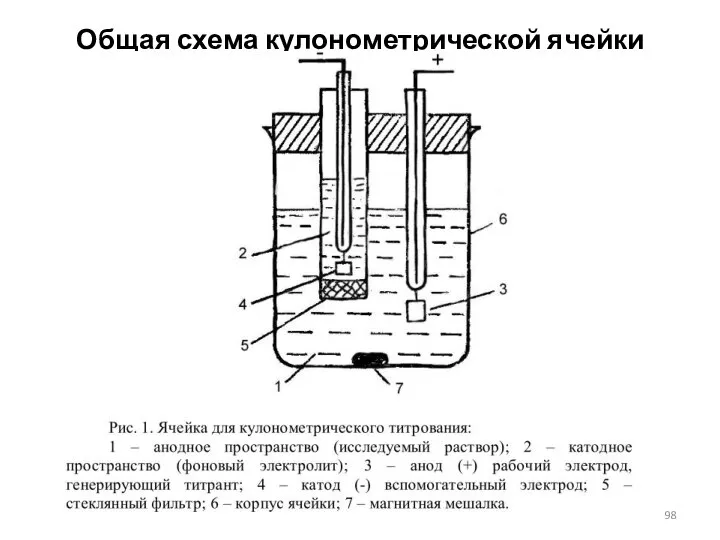
- 98. Общая схема кулонометрической ячейки
- 99. Кулонометрия (виды) Различают два основных вида кулонометрических определений – прямую кулонометрию и кулонометрическое титрование. В методах
- 100. Кулонометрия (виды) В методе кулонометрического титрования используют установки с постоянной силой тока. Кулонометрическое титрование в значительной
- 101. Кулонометрия Достоинства метода кулонометрического титрования: 1. высокая чувствительностью и точностью (0,1–0,05%), позволяя прямым титрованием определять вещества
- 104. Скачать презентацию














































 Увлекательная химия
Увлекательная химия Термический анализ
Термический анализ Презентация по Химии "Презентация Медь" - скачать смотреть
Презентация по Химии "Презентация Медь" - скачать смотреть  Алканы и их свойства
Алканы и их свойства Класифікація розчинів. Осмос. Осмотичний тиск
Класифікація розчинів. Осмос. Осмотичний тиск Реакции ионного обмена в водных растворах электролитов. Ионные реакции и уравнения
Реакции ионного обмена в водных растворах электролитов. Ионные реакции и уравнения Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Игра «Химические элементы» (формулы и названия)
Игра «Химические элементы» (формулы и названия) Биохимия и молекулярная биология. (Лекция 1)
Биохимия и молекулярная биология. (Лекция 1) Камни и Рыбы
Камни и Рыбы Минералы
Минералы Растворы электролитов
Растворы электролитов Материаловедение. Диаграммы состояния
Материаловедение. Диаграммы состояния Кремнийорганические модификаторы
Кремнийорганические модификаторы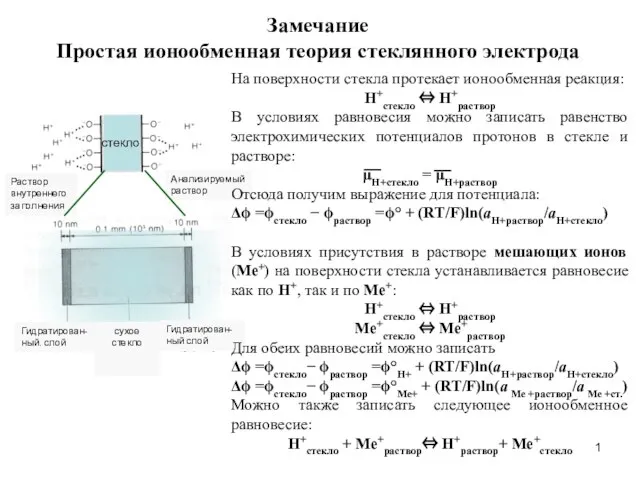 Простая ионообменная теория стеклянного электрода
Простая ионообменная теория стеклянного электрода Порцеляна. Фаянс
Порцеляна. Фаянс Физические свойства металлов
Физические свойства металлов Подгруппа углерода
Подгруппа углерода Направление окислительно-восстановительного процесса
Направление окислительно-восстановительного процесса Липиды - жиры и жироподобные органические соединения, практически нерастворимые в воде
Липиды - жиры и жироподобные органические соединения, практически нерастворимые в воде Минералогический и химический состав почвы
Минералогический и химический состав почвы Дисперсные системы и растворы
Дисперсные системы и растворы Неорганические и органические основания.
Неорганические и органические основания. Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева
Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева The role of chemistry in the solution of the food problem
The role of chemistry in the solution of the food problem Презентация Типы изомерий 10 класс
Презентация Типы изомерий 10 класс Загадочная медь
Загадочная медь Углерод. Кремний
Углерод. Кремний