Содержание
- 2. Влияние эффекторов на активность (скорость реакции) ферментов Эффекторы – вещества, которые связываясь с молекулой фермента, ингибируют(
- 3. Ингибиторы. Типы. По степени прочности связывания с ферментом делят на необратимые и обратимые. Обратимые ингибиторы –
- 4. Ингибиторы. Типы. Необратимые ингибиторы – ковалентно связываются c ферментом, образуя прочный комплекс E I , который
- 5. Типы обратимых ингибиторов. Конкурентные ингибиторы Обратимые ингибиторы делят на конкурентные и неконкурентные. К конкурентным ингибиторам (тип
- 6. Результат действия конкурентного ингибирования на графике зависимости V от [S] контроль С ингибитором Км –повышается; V
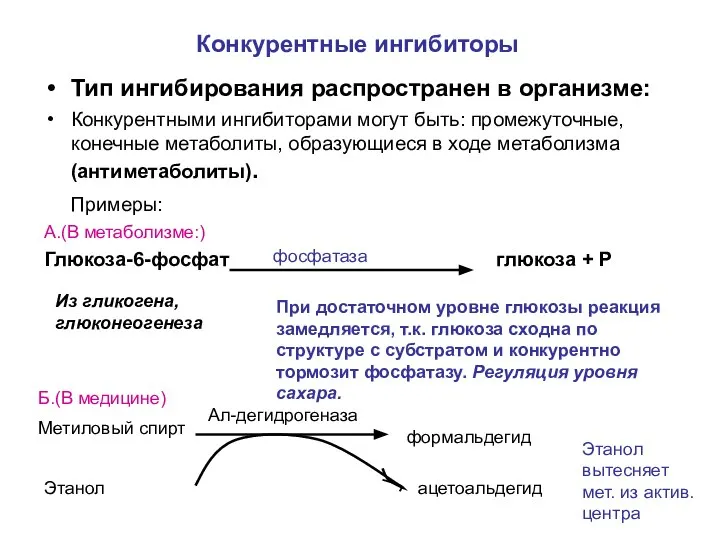
- 7. Конкурентные ингибиторы Тип ингибирования распространен в организме: Конкурентными ингибиторами могут быть: промежуточные, конечные метаболиты, образующиеся в
- 8. Неконкурентные ингибиторы Неконкурентные ингибиторы. Тип ингибирования – неконкурентный. Неконкурентный ингибитор не обладает сходством структуры с субстратом
- 9. Результат действия неконкурентного ингибитора на графике зависимости [S] 1/2Vмах 1/2Vмах Км V [S] Км – не
- 10. Уровни регуляции скорости ферментативных реакций Для сохранения клеточного гомеостаза в клетках скорости ферментативных реакций в клетке
- 11. 1. Регуляция количества молекул фермента в клетке Количество ферментов определяется соотношением скоростей двух процессов – синтеза,
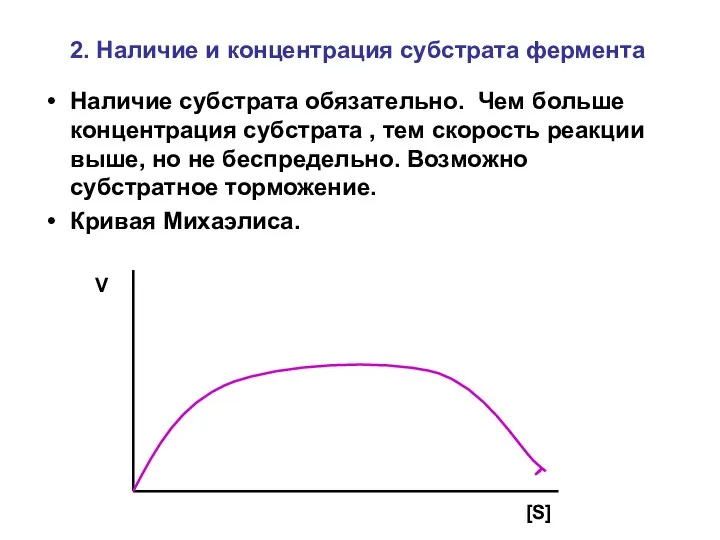
- 12. 2. Наличие и концентрация субстрата фермента Наличие субстрата обязательно. Чем больше концентрация субстрата , тем скорость
- 13. 3. Регуляция каталитической активности ключевого (регуляторного) фермента метаболического пути Высокоэффективный способ регуляции метаболизма. Основные механизмы регуляции
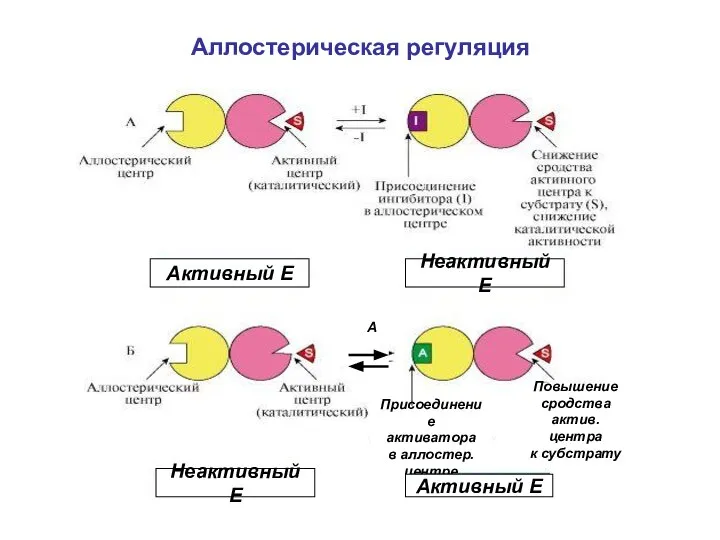
- 14. Аллостерическая регуляция Характерна для олигомерных ферментов (четвертичная структура). В структуре имеются каталитические протомеры( с активным центром)
- 15. Аллостерические эффекторы Отличаются по химической природе от субстрата. Активаторы и ингибиторы. Аллостерические ингибиторы- конечный продукт метаболического
- 16. Аллостерическая регуляция Повышение сродства актив.центра к субстрату Присоединение активатора в аллостер. центре Активный E Неактивный E
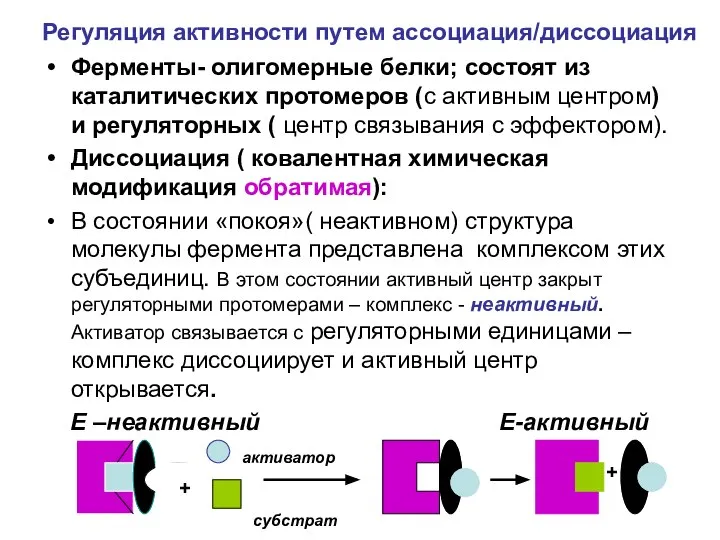
- 17. Регуляция активности путем ассоциация/диссоциация Ферменты- олигомерные белки; состоят из каталитических протомеров (с активным центром) и регуляторных
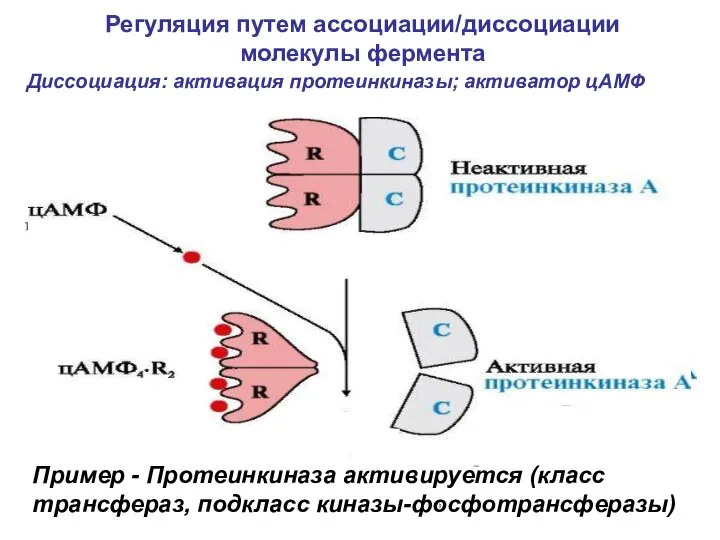
- 18. Регуляция путем ассоциации/диссоциации молекулы фермента активатор Диссоциация: активация протеинкиназы; активатор цАМФ Пример - Протеинкиназа активируется (класс
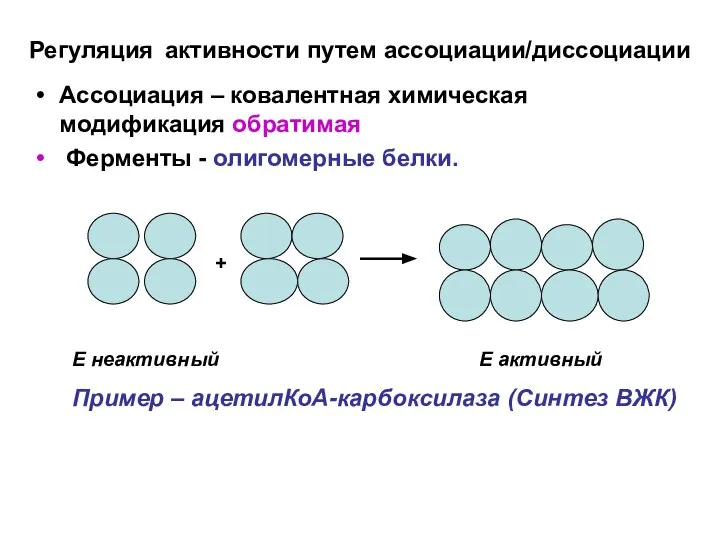
- 19. Регуляция активности путем ассоциации/диссоциации Ассоциация – ковалентная химическая модификация обратимая Ферменты - олигомерные белки. + E
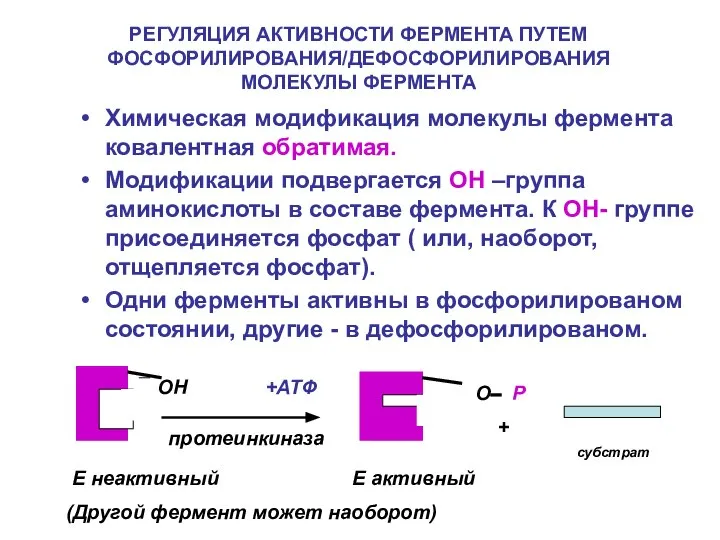
- 20. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТА ПУТЕМ ФОСФОРИЛИРОВАНИЯ/ДЕФОСФОРИЛИРОВАНИЯ МОЛЕКУЛЫ ФЕРМЕНТА Химическая модификация молекулы фермента ковалентная обратимая. Модификации подвергается ОН
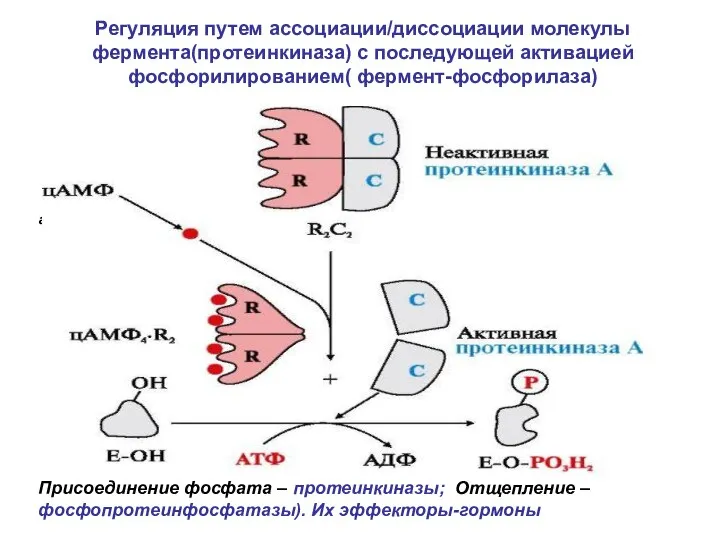
- 21. Регуляция путем ассоциации/диссоциации молекулы фермента(протеинкиназа) с последующей активацией фосфорилированием( фермент-фосфорилаза) активатор Присоединение фосфата – протеинкиназы; Отщепление
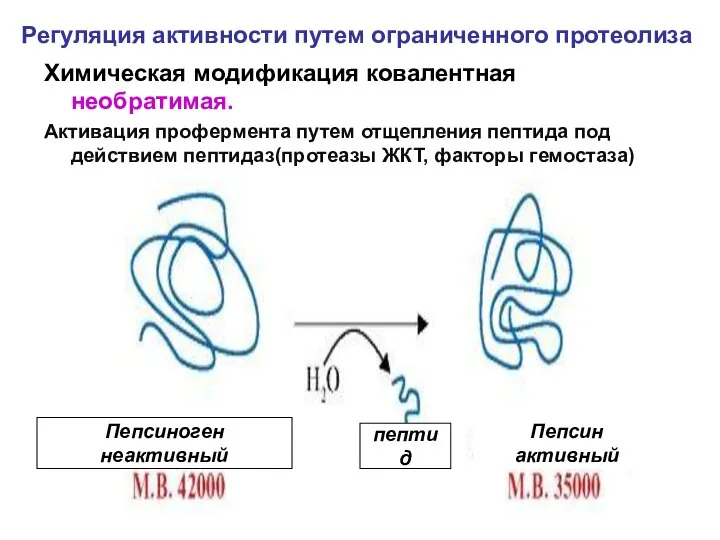
- 22. Регуляция активности путем ограниченного протеолиза Химическая модификация ковалентная необратимая. Активация профермента путем отщепления пептида под действием
- 24. Скачать презентацию




![Результат действия конкурентного ингибирования на графике зависимости V от [S] контроль](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404570/slide-5.jpg)

![Результат действия неконкурентного ингибитора на графике зависимости [S] 1/2Vмах 1/2Vмах Км](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404570/slide-8.jpg)





 Презентация по химии Щелочные металлы
Презентация по химии Щелочные металлы  Алканы Гексан
Алканы Гексан Лекарственные вещества (определения и классификация)
Лекарственные вещества (определения и классификация) Растворы электролитов
Растворы электролитов Масс-спектрометрия в органической химии
Масс-спектрометрия в органической химии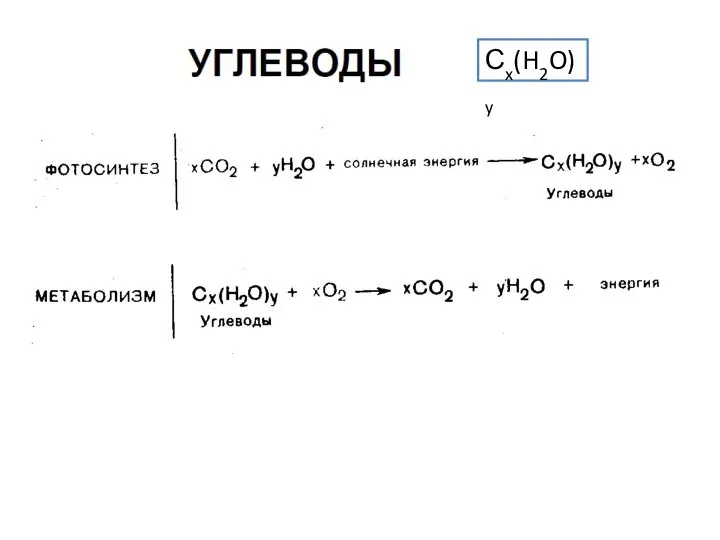 Углеводы. Классификация, cтроение
Углеводы. Классификация, cтроение Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Диаграмма железо-углерод
Диаграмма железо-углерод S-,p-,d-элементтердің медициналы-биологиялық маңызы
S-,p-,d-элементтердің медициналы-биологиялық маңызы ГИА. Вопрос 10. Химические свойства оксидов: основных, амфотерных, кислотных
ГИА. Вопрос 10. Химические свойства оксидов: основных, амфотерных, кислотных Химические формулы. Классы неорганических веществ. Урок №1
Химические формулы. Классы неорганических веществ. Урок №1 Алкины. Характеристика тройной связи
Алкины. Характеристика тройной связи Презентация по Химии "Углекислый газ" - скачать смотреть бесплатно
Презентация по Химии "Углекислый газ" - скачать смотреть бесплатно Полисахариды. Крахмал
Полисахариды. Крахмал Ученые химики. Выполнила ученица 10 кл. Трофимова Настя
Ученые химики. Выполнила ученица 10 кл. Трофимова Настя Формулы солей
Формулы солей Брейн-ринг. Відгадай елемент
Брейн-ринг. Відгадай елемент Свойства катализатора. Промотирование и модифицирование
Свойства катализатора. Промотирование и модифицирование Колообіг води Виконав Проданчук Олег Учень 10-А класу
Колообіг води Виконав Проданчук Олег Учень 10-А класу  Реакция нейтрализации
Реакция нейтрализации Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты Исследование химических моделей (11 класс)
Исследование химических моделей (11 класс) Methods for processing of liquid waste
Methods for processing of liquid waste Применимость геохимических правил к распространенности лантанидов в земной коре
Применимость геохимических правил к распространенности лантанидов в земной коре Расчеты по химическим уравнениям. Алгоритм решения расчетных задач
Расчеты по химическим уравнениям. Алгоритм решения расчетных задач Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез
Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез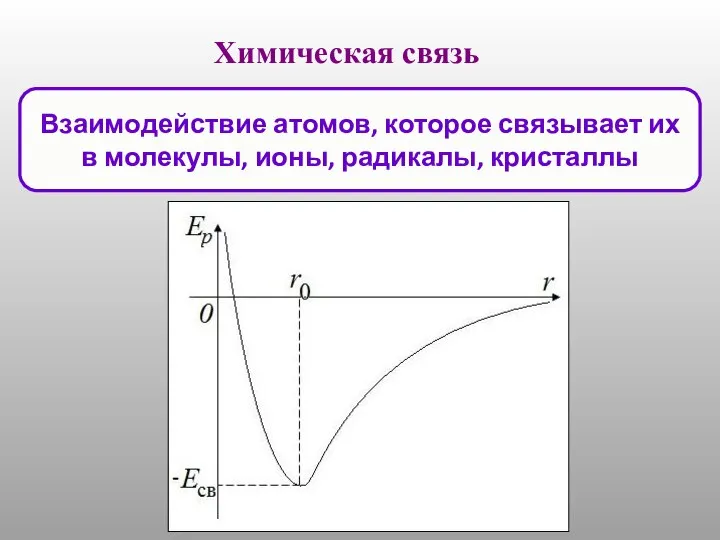 Химическая связь
Химическая связь Аттестационная работа. Образовательная программа элективного курса по химии Химия и мы
Аттестационная работа. Образовательная программа элективного курса по химии Химия и мы