Содержание
- 2. Дать понятие об амфотерности, амфотерных оксидах и гидроксидах, переходных металлах; Повторить, закрепить и развить знания о
- 3. Основные классы сложных веществ (повторение) Генетическая связь (повторение) Лабораторная работа Понятие амфотерности. Амфотерные оксиды и гидроксиды
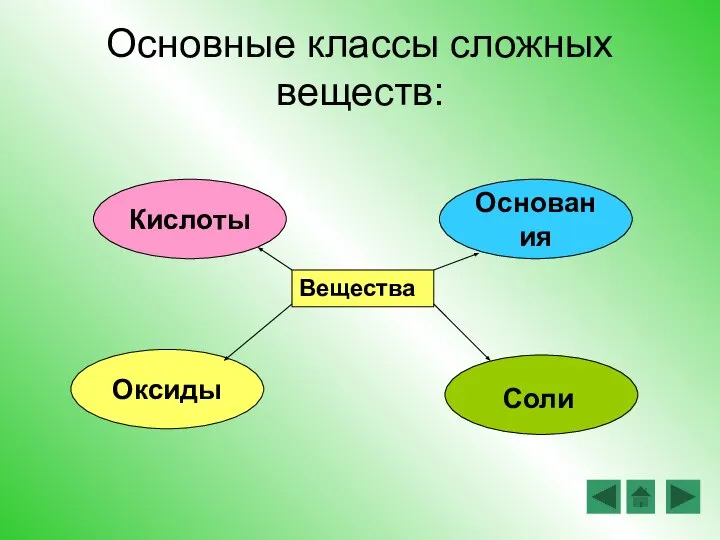
- 4. Основные классы сложных веществ: Вещества Кислоты Основания Оксиды Соли
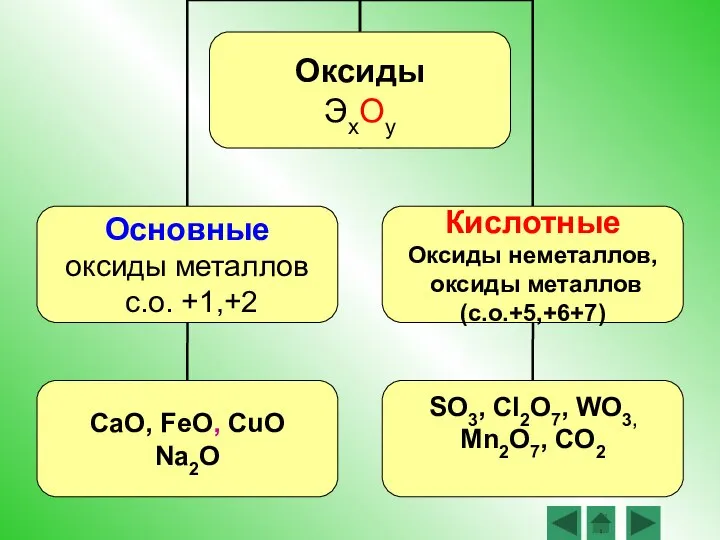
- 5. Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со
- 6. Задание 1 Выберите из списка веществ оксиды: H2O, CO2, P2O5, WO3 Fe2O3 SO3, CaCl2, SCl6, CuO,
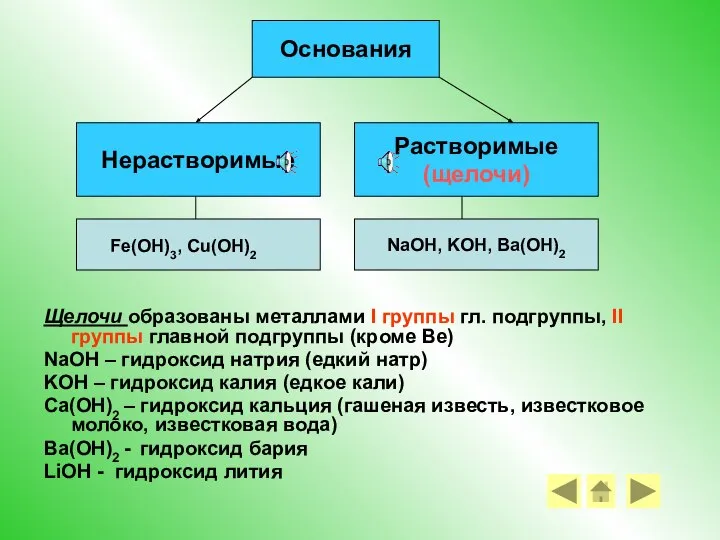
- 8. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких
- 9. Щелочи образованы металлами I группы гл. подгруппы, II группы главной подгруппы (кроме Be) NaOH – гидроксид
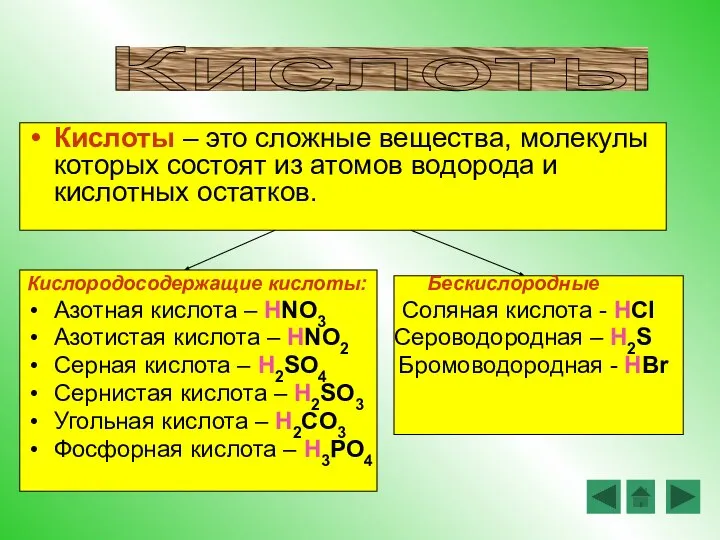
- 10. Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Кислородосодержащие кислоты:
- 11. Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков Соли KNO3 NaCl CuSO4
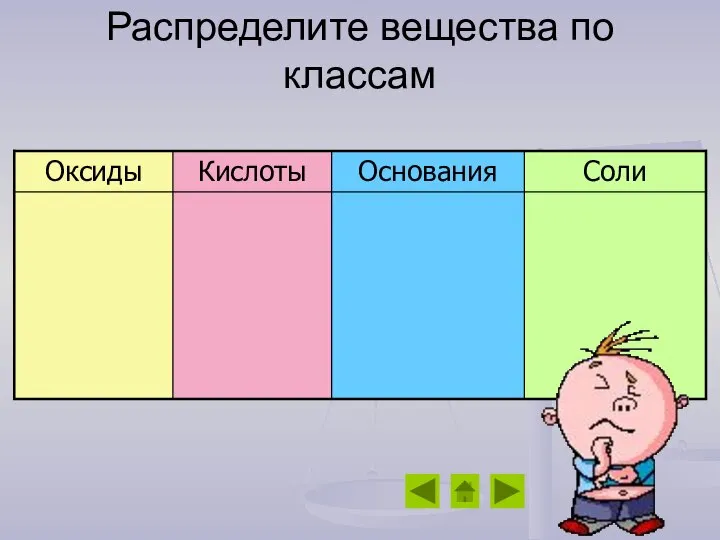
- 12. Распределите вещества по классам
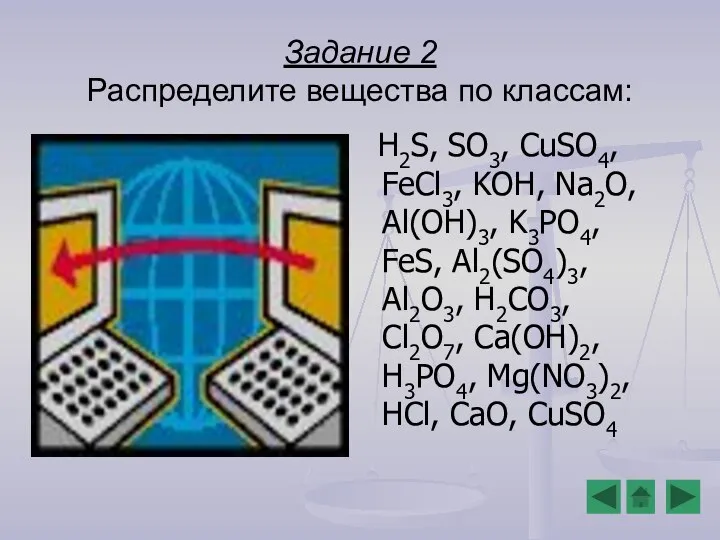
- 13. Задание 2 Распределите вещества по классам: H2S, SO3, CuSO4, FeCl3, KOH, Na2O, Al(OH)3, K3PO4, FeS, Al2(SO4)3,
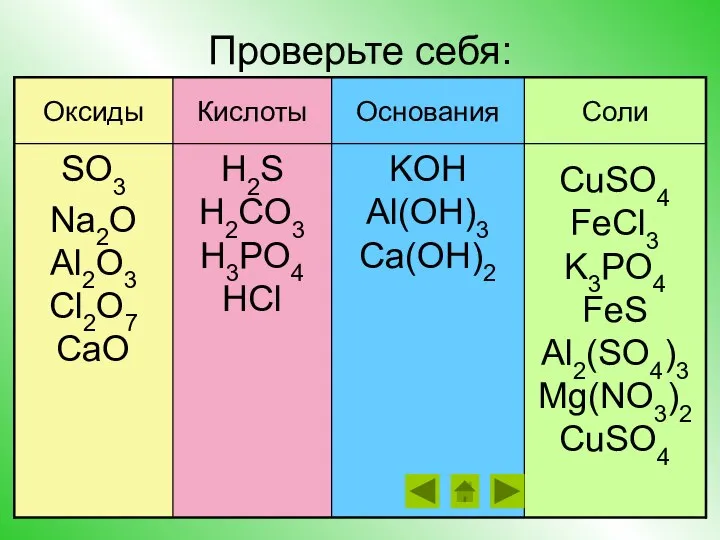
- 14. Проверьте себя:
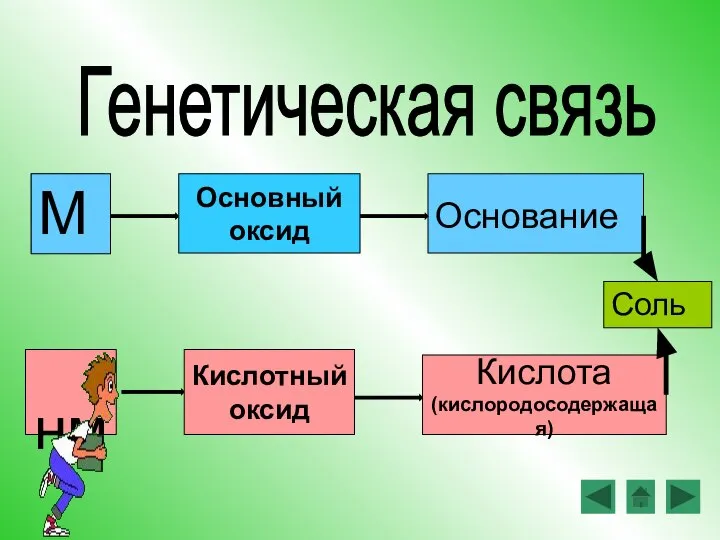
- 15. М Основание нм Кислота (кислородосодержащая) Генетическая связь Основный оксид Кислотный оксид Соль
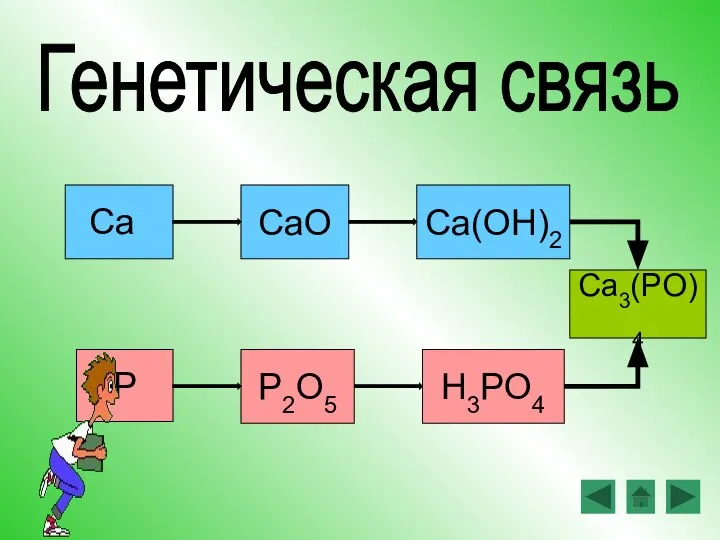
- 16. CaO Ca(OH)2 P2O5 H3PO4 P Ca Генетическая связь Ca3(PO)4
- 17. Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки
- 18. Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со
- 19. Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя
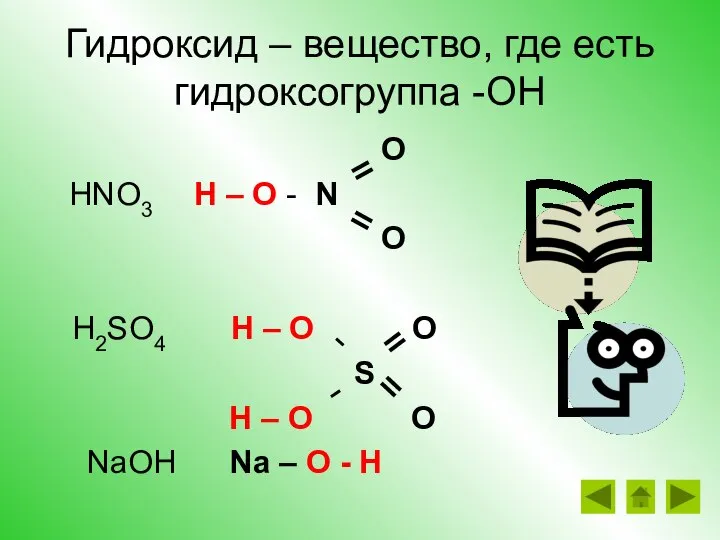
- 20. Гидроксид – вещество, где есть гидроксогруппа -ОН O HNO3 H – O - N O H2SO4
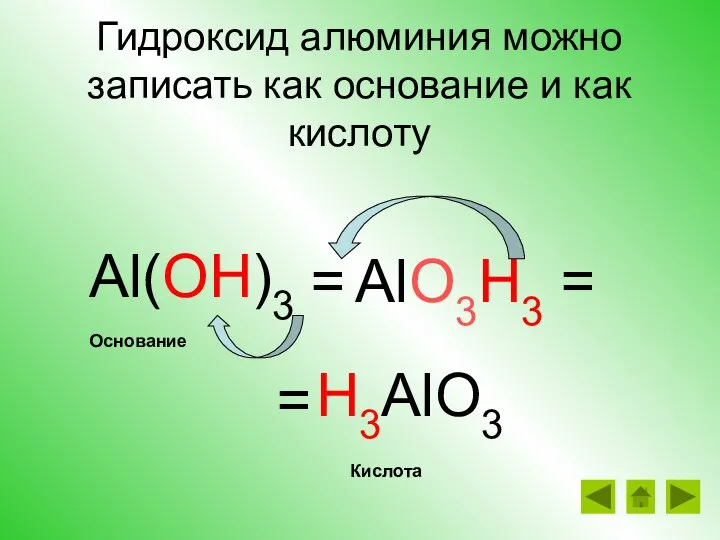
- 21. Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота
- 22. Al(OH)3 + 3HCl = AlCl3 +3H2O H3AlO3 + 3NaOH = Na3AlO3+3H2O Хлорид алюминия Алюминат натрия Запишите
- 23. Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 3NaOH = Na3AlO3 + 3H2O Как основный
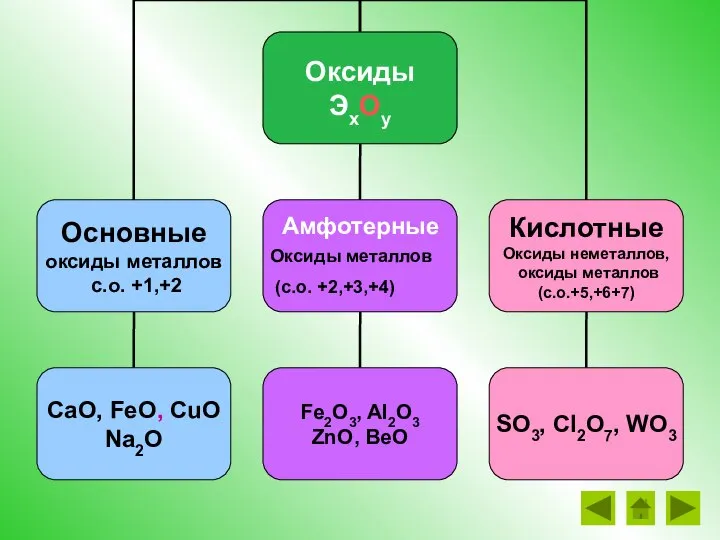
- 24. Амфотерные Оксиды металлов (с.о. +2,+3,+4)
- 25. Амфотерные гидроксиды
- 26. Какие из групп веществ проявляют амфотерные свойства? Ca(ОН)2, Cu(ОН)2, NaОН, Fe(OН)2 Fe2O3, Al2O3, Fe(OН)3 , ZnO,
- 27. Допишите уравнение реакции: Zn(OH)2 + 2NaOH в результате образуются Na2ZnO2 + 2H2O Zn(OH)2 + Na2O ZnSO4
- 28. Совершенно верно!!!
- 29. Подумай ещё немного!
- 31. Скачать презентацию
















 Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Презентация по Химии "Химия цвета" - скачать смотреть
Презентация по Химии "Химия цвета" - скачать смотреть  Основные диагностические признаки рубина и его имитаций
Основные диагностические признаки рубина и его имитаций Классификация процессов коррозии
Классификация процессов коррозии Функциональные наноматериалы. (Лекция 1)
Функциональные наноматериалы. (Лекция 1) Углеводороды
Углеводороды Химия в моей специальности
Химия в моей специальности Оксиды азота
Оксиды азота Гидрокарбонат натрия NaHCO₃
Гидрокарбонат натрия NaHCO₃ Ферросплавы. Феррохром
Ферросплавы. Феррохром Харчові добавки Підготували: Возна Руслана Таран Ірина
Харчові добавки Підготували: Возна Руслана Таран Ірина  Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Low-temperature EPR spectroscopy of high-spin cobalt complexes with unusual valence Co(III)
Low-temperature EPR spectroscopy of high-spin cobalt complexes with unusual valence Co(III) Равновесное горение. Лекция 3
Равновесное горение. Лекция 3 Химическое равновесие
Химическое равновесие Алюміній
Алюміній  Цепная сополимеризация
Цепная сополимеризация Химиялық реакцияның жылдамдығы. Катализ
Химиялық реакцияның жылдамдығы. Катализ Интеллектуальная игра «Брейн-ринг
Интеллектуальная игра «Брейн-ринг Ионная связь. Взаимная поляризация ионов
Ионная связь. Взаимная поляризация ионов Презентация по Химии "интеллектуальная игра Вперед к вершине Химического Олимпа" - скачать смотреть бесплатно
Презентация по Химии "интеллектуальная игра Вперед к вершине Химического Олимпа" - скачать смотреть бесплатно Путешествие в страну Металлию Обобщающий урок в 9 классе по теме «Металлы» Составила Будаева Л.Н.
Путешествие в страну Металлию Обобщающий урок в 9 классе по теме «Металлы» Составила Будаева Л.Н. Періодична система Менделєєва. Елементи 6 групи
Періодична система Менделєєва. Елементи 6 групи Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.
Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.  Неметаллические материалы
Неметаллические материалы Круговорот воды в природе
Круговорот воды в природе Принципы наноармирования волокнистых композитов
Принципы наноармирования волокнистых композитов Составить структурные формулы
Составить структурные формулы