Содержание
- 2. Одна легенда говорить, що одного разу до римського імператора Тиберія прийшов ювелір із металевою обідньою тарілкою,
- 3. Його назва походить від латинського слова,що в перекладі на нашу-галун,назва подвійної солі,до складу якої входить алюміній
- 5. Характеристика хімічного елементу 1. Порядковий номер – 13 2. ІІІ період, 3 група, головна підгрупа 3.
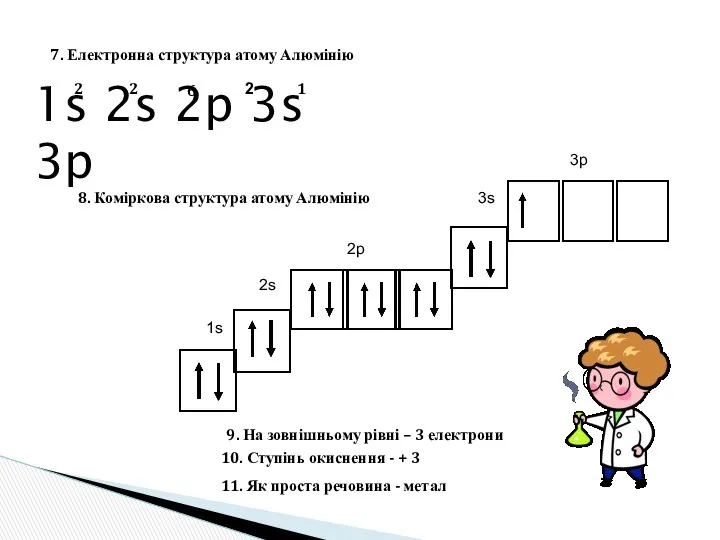
- 6. 1s 2s 2p 3s 3p 1s 2s 2p 3s 3p 7. Електронна структура атому Алюмінію 8.
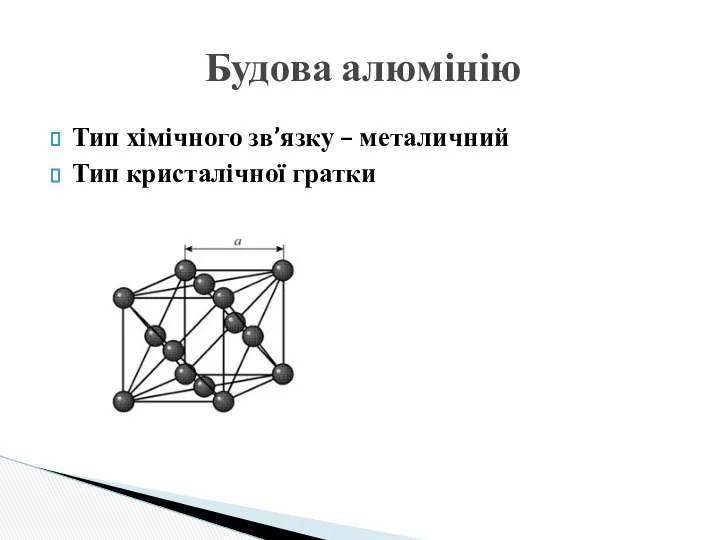
- 7. Будова алюмінію Тип хімічного зв’язку – металичний Тип кристалічної гратки
- 8. Основними способами одержання алюмінію на сьогоднішній день є електроліз. Хоча вчені знайшли в Китаї гробницю полководця
- 9. Алюміній-третій елемент за поширенням у природі після Оксигену і Силіцію:його атомна частка в корі в земній
- 10. Каолініт Боксит
- 11. Польовий шпат Нефелін
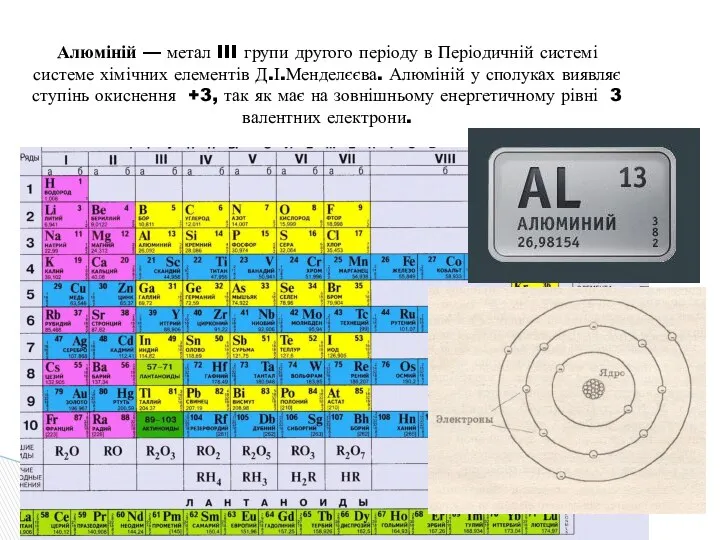
- 12. Алюміній — метал III групи другого періоду в Періодичній системі системе хімічних елементів Д.І.Менделєєва. Алюміній у
- 13. Фізичні властивості Алюмінію: Алюміній – сріблясто-білий метал, легкий і пластичний, густина його = 2,7 г/см3, температура
- 14. сріблясто – білий метал; ковкий; легко витягується; tпл = 660 0С; tкип = 2520 0С; ρ
- 15. Хімічні властивості лужних металів. Взаємодія з неметалами: 1) З киснем: 4Аl + 3О2 = 2Аl2О3 2)
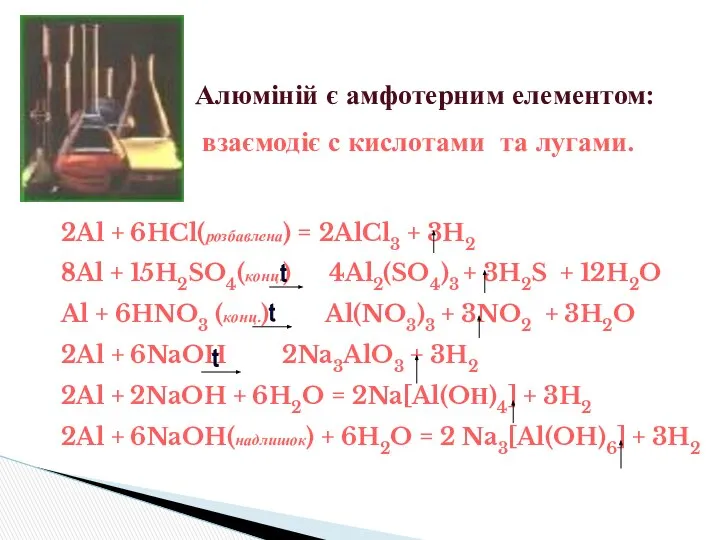
- 16. Алюміній є амфотерним елементом: взаємодіє с кислотами та лугами. 2Al + 6HCl(розбавлена) = 2AlCl3 + 3H2
- 17. взаємодія з йодом взаємодія з бромом
- 18. Алюміній оксид Аl 2O3 Проявляє амфотерні властивості: Аl2O3 +6 НС1 = 2АlСl3 + 3Н2О Аl 2O3
- 19. Алюміній гідроксид Al(OH)3 Проявляє амфотерні властивості: Аl (OH)3 + 3НС1 = АlСl3 + 3Н2О Аl (OH)3
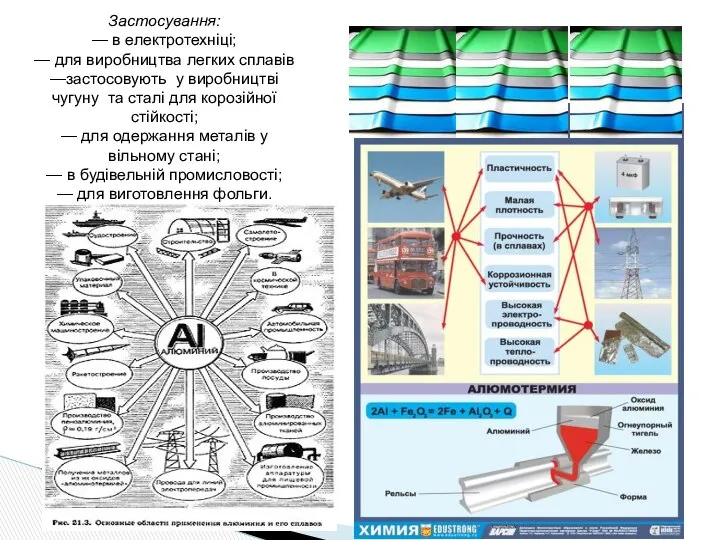
- 20. Застосування: — в електротехніці; — для виробництва легких сплавів —застосовують у виробництві чугуну та сталі для
- 21. Алюміній дуже добре проводить електричний струм – за електропровідністю він іде після срібла та міді. Тому
- 22. Будівництво Застосування алюмінію Авіабудування Машинобудування Харчова промисловість Фармацевтична промисловість Електротехніка
- 23. Алюміній дуже активний метал, він не зустрічається в природі у вигляді самородків, або розчинних солей: це
- 25. Скачать презентацию
















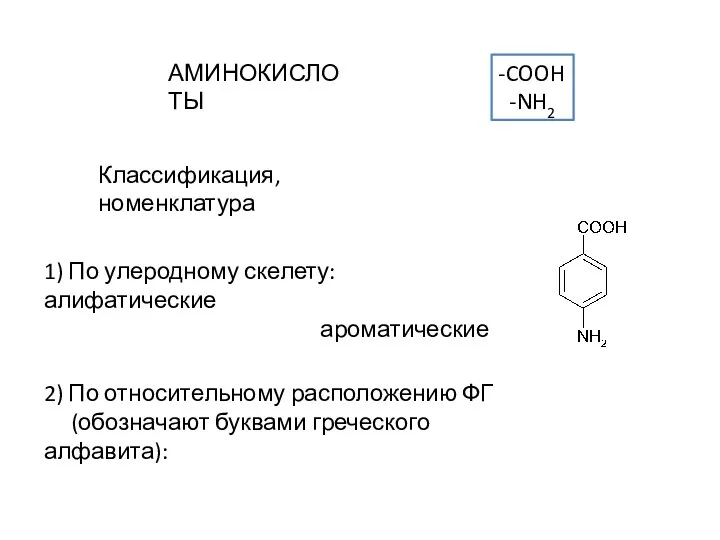 Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Фазовые равновесия
Фазовые равновесия Электролитическая диссоциация
Электролитическая диссоциация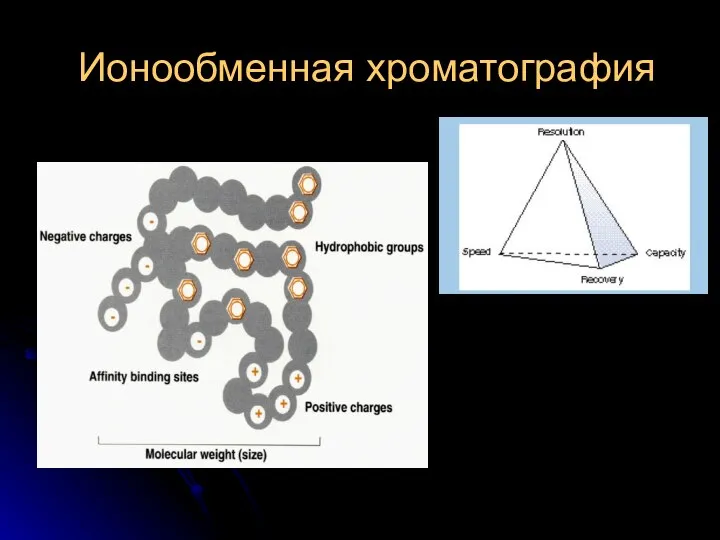 Ионообменная хроматография
Ионообменная хроматография Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Биохимия печени
Биохимия печени Потенциометрия. Методы потенциометрии, и их применение в медицине. Плюсы и минусы методов ПТ
Потенциометрия. Методы потенциометрии, и их применение в медицине. Плюсы и минусы методов ПТ Кристаллические решетки
Кристаллические решетки Атомные спектры
Атомные спектры Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде
Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде Высокопроизводительное моторное масло для бензиновых и дизельных двигателей
Высокопроизводительное моторное масло для бензиновых и дизельных двигателей Добавки, красители и консерванты в пищевых продуктах
Добавки, красители и консерванты в пищевых продуктах «Адамсит». Дигидрофенарсазинхлорид HN(C6H4)2AsCl
«Адамсит». Дигидрофенарсазинхлорид HN(C6H4)2AsCl Метасоматический процесс
Метасоматический процесс Относительная атомная масса
Относительная атомная масса Адские задания. ЕГЭ по химии
Адские задания. ЕГЭ по химии Презентация по Химии "Хімія в повсякденному житті" - скачать смотреть бесплатно
Презентация по Химии "Хімія в повсякденному житті" - скачать смотреть бесплатно Классификация неорганических веществ
Классификация неорганических веществ Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ
Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ Спирт. Спирты в природе. Влияние спирта на человека
Спирт. Спирты в природе. Влияние спирта на человека Физические и химические свойства воды
Физические и химические свойства воды Электрохимические методы. (Лекция 3)
Электрохимические методы. (Лекция 3) Такая знакомая сода
Такая знакомая сода Электролиз. 9 класс
Электролиз. 9 класс Биохимия лёгких
Биохимия лёгких Кафедры биохимии УГМУ в прошлом и настоящем
Кафедры биохимии УГМУ в прошлом и настоящем Состав вещества
Состав вещества