Содержание
- 2. Электролитическая диссоциация
- 3. Студент должен: Знать: положения теории электролитической диссоциации электролитов и гидролиза солей Уметь: Составлять молекулярно-ионные уравнения диссоциации
- 4. Электролитическая диссоциация- распад вещества на ионы в растворах полярных растворителей или в расплавах. Если вещество при
- 5. По величине степени диссоциации электролиты делятся на две группы: 1) если α > 0,3 (30%), то
- 6. Диссоциация слабых электролитов- процесс обратимый и ступенчатый: СН3СООН СН3СОО-+Н+, для него устанавливается состояние химического равновесия, которое
- 7. Свойства химических соединений в растворах определяются характером их диссоциации: HCl→H++Cl- (кислоты при диссоциации дают ионы H+);
- 8. Al(OH)3 + 3NaOHрастворNa3[Al(OH )6]; Sn(OH)2 +2HCl→SnCl2 + 2H2O; Sn(OH)2 + 2NaOHсплавление Na2SnO2 + 2H2O Sn(OH)2 +
- 9. Процесс ионизации воды протекает по уравнению: H2O H+ +OH- +55,9 кДж/моль. В нейтральных растворах: СМ(H+ )=
- 10. Кислотно-основные индикаторы- это вещества, меняющие окраску при изменении рН раствора. Индикаторами могут быть слабые органические кислоты
- 11. Пример 1. Составьте молекулярное уравнение реакций, если сокращенное ионное уравнение записывается в виде: а) Сl- +
- 12. б) ZnS↓+ 2Н+ →Zn2+ + H2S. Кислота - сильный электролит, должна образовывать с ионом цинка растворимую
- 13. Пример 2. Вычислите рН 0,1 М раствора соляной кислоты (α = 100%). Решение. Если α =
- 14. Пример 3. Вычислите рН 0,01 М раствора гидроксида натрия ( α= 100%). Решение. NaOH → Na++
- 15. 1.Запишите уравнение реакций в ионном (полном и сокращенном) виде: a)Cu(NO3)2+KOH→ ...; д) HN03 + Ва(ОН)2→..; б)
- 16. 2. Можно ли приготовить растворы, содержащие одновременно следующие вещества: а)Na2СO3 и НС1; г) NH4NO3 и NaOH;
- 17. 4. Составьте молекулярное уравнение реакций, если сокращенное ионное уравнение записывается в виде: а) Cu2+ + 2S3-
- 18. 6.Вычислите концентрацию ионов водорода в 0,01 М растворе гидроксида аммония NH4OH, если степень диссоциации составляет 0,2%.
- 19. ИОННЫЕ ПРОЦЕССЫ
- 20. Реакции в растворах электролитов, при которых не происходит изменение зарядов ионов, входящих в соединение, называются обменными
- 21. При выводе ионно-молекулярных уравнений необходимо придерживаться следующей формы записи: а) сильные электролиты следует писать в виде
- 22. Образование комплексного иона: HgJ2 + 2KJ = K2[HJ4] HgJ2 + 2K+ +2J-=2K+ + [HgJ4]2- HgJ2+ 2J-=
- 23. в) Образование слабой кислоты: 2CH3COONa + H2SO2= 2CH3COOH + Na 2SO4 2CH3COO- + 2H+ =2CH3COOH г)
- 24. Абсолютно нерастворимых веществ нет. В насыщенном растворе малорастворимого электролита, например BaSO4, находящегося в соприкосновении с твердой
- 25. В таком случае, на основании закона действия масс, состояние равновесия зависит только от произведения концентрации ионов,
- 26. Из понятия ПР вытекает условие образования осадков: труднорастворимый электролит выпадает в осадок, когда произведение концентраций его
- 27. Пример 1. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: a) HCI и NaOH;
- 28. В реакции (д) два слабых электролита, но так как. реакции идут в сторону большего связывания ионов
- 29. Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения: a) SО32¯ +2Н+ = SО2
- 30. Например: а) Na2SO3 + 2HCI =2NaCI + SO2 + Н2О б)Pb(NO3)2+K2CrO4=PbCrO4+2KNO3 в) КНСО3 + КОН =
- 31. ГИДРОЛИЗ СОЛЕЙ
- 32. Гидролиз солей- это обменные реакции ионов соли и молекул воды, приводящие к образованию ионов или молекул
- 33. Гидролиз- процесс обратимый, его равновесие сильно смещено влево, в сторону исходных веществ. Равновесие реакции гидролиза подчиняется
- 34. Примеры решения задач Пример 1. запишите уравнения реакций гидролиза следующих солей и определите реакцию среды (нейтральная,
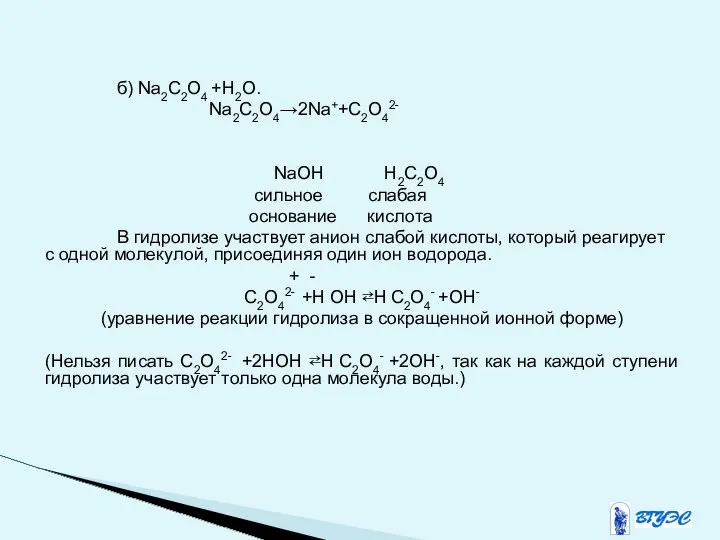
- 35. б) Na2C2O4 +Н2О. Na2C2O4→2Na++C2O42- NaOH H2C2O4 сильное слабая основание кислота В гидролизе участвует анион слабой кислоты,
- 36. Так как ионы Na+ не принимают участия в гидролизе, то они присутствуют в неизменной форме в
- 37. Если опустить все рассуждения, уравнение реакции гидролиза Na2C2O4 можно записать следующим образом: Na2C2O4 +НОН ⇄; C2O42-
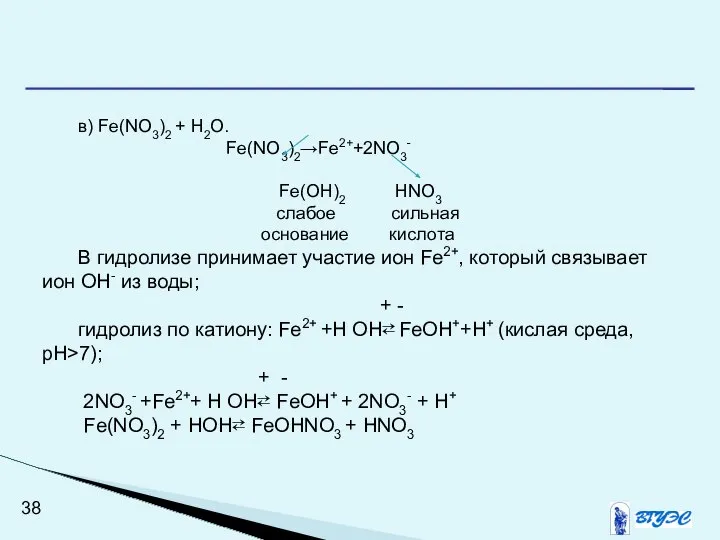
- 38. в) Fe(NO3)2 + H2O. Fe(NO3)2→Fe2++2NO3- Fe(OH)2 HNO3 слабое сильная основание кислота В гидролизе принимает участие ион
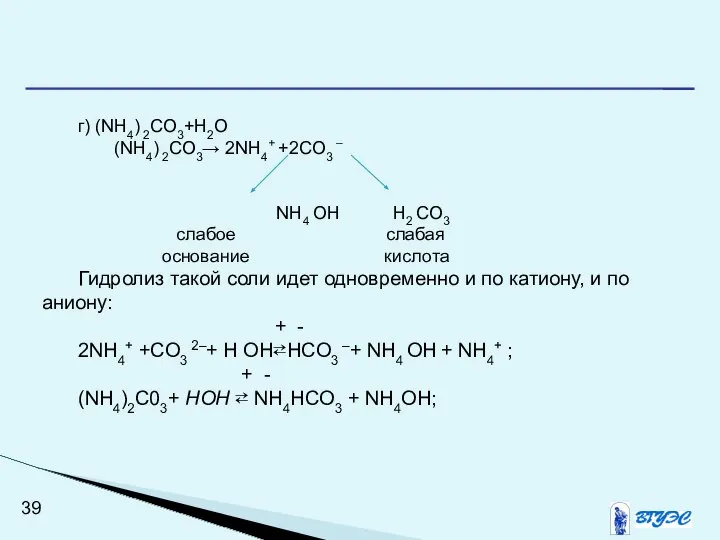
- 39. г) (NH4) 2CO3+H2O (NH4) 2CO3→ 2NH4+ +2CO3 – NH4 OH H2 CO3 слабое слабая основание кислота
- 40. (Так как в молекуле воды только один ион ОН-, то на первой ступени гидролиза связывается только
- 41. д) FeS + Н20. Так как FeS в воде нерастворима, гидролиз ее не идет. FeS +
- 42. Пример . Запишите уравнения реакций гидролиза следующих солей: a) A12(S04)3; б) CuSO4 Решение. a)Al2(S04)3+H20. Al2(SO4)3→ 2Al3++2S042-
- 43. 2А13++ 2НОН ↔ 2А1OН2+ + 2Н+ ( сокращенное ионное уравнение); 3S042-+2A13++2H0H ↔2Al0H2++2H++3SO42- (полное ионное уравнение); Al2(SO4)3+2Н20
- 44. В правой части полного ионного уравнения присутствуют 2 катиона (СиОН+ и Н+) и только один анион
- 45. Пример . Запишите уравнения реакций, которые происходят при смешивании водных растворов Na2S и АlСl3. Решение. При
- 46. 1. Запишите уравнения реакций гидролиза следующих солей и определите реакцию среды: NaNO3; б) NH4CI; в) K2SO4;
- 47. 4. Запишите уравнения реакций, которые происходят при смешивании водных растворов К2СОз и Сr(NО3)3 5. При обработке
- 49. Скачать презентацию






![Al(OH)3 + 3NaOHрастворNa3[Al(OH )6]; Sn(OH)2 +2HCl→SnCl2 + 2H2O; Sn(OH)2 + 2NaOHсплавление](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1261039/slide-7.jpg)













![Образование комплексного иона: HgJ2 + 2KJ = K2[HJ4] HgJ2 + 2K+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1261039/slide-21.jpg)






















 Химическая термодинамика
Химическая термодинамика Обнаружение нитратов в растениях
Обнаружение нитратов в растениях Липиды. Классификация
Липиды. Классификация Пробоподготовка (HPLC, instrumental analysis)
Пробоподготовка (HPLC, instrumental analysis) Углеводородные и неуглеводородные соединения нефти. Физические свойства нефти. Химические классификации нефти
Углеводородные и неуглеводородные соединения нефти. Физические свойства нефти. Химические классификации нефти Алкины 10 класс - Презентация_
Алкины 10 класс - Презентация_ Обмен белков
Обмен белков Азот қышқылын өндіру
Азот қышқылын өндіру Цифровые лаборатории «Архимед» в изучении биологии и химии
Цифровые лаборатории «Архимед» в изучении биологии и химии Цемент. (9 класс)
Цемент. (9 класс) Диены (диолефины, алкадиены)
Диены (диолефины, алкадиены) Основания. Классификация оснований
Основания. Классификация оснований Короткі відомості з історії хімії. Становлення хімії як науки
Короткі відомості з історії хімії. Становлення хімії як науки Катализаторы
Катализаторы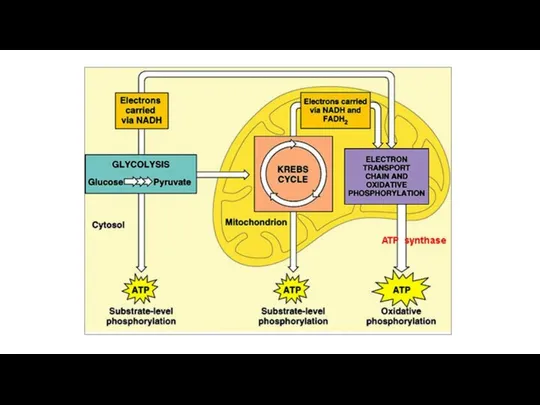 The Krebs cycle
The Krebs cycle Меры безопасности в турпоездках
Меры безопасности в турпоездках  Расчет константы равновестия для реакции
Расчет константы равновестия для реакции Коллекция учебных динамических слайдов по химии (8 класс)
Коллекция учебных динамических слайдов по химии (8 класс) Ковалентная полярная связь
Ковалентная полярная связь Классификация моторных масел по стандартам API
Классификация моторных масел по стандартам API Нуклеиновые кислоты
Нуклеиновые кислоты Процессы и аппараты химической технологии
Процессы и аппараты химической технологии Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп Классификация неорганических веществ. Оксиды. Автор: Калитина Тамара Михайловна Место работы: МОУ СОШ №3 с.Александров-Гай
Классификация неорганических веществ. Оксиды. Автор: Калитина Тамара Михайловна Место работы: МОУ СОШ №3 с.Александров-Гай  Электрохимия. Электродные потенциалы
Электрохимия. Электродные потенциалы Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Методы решения ОВР с участием органических соединений
Методы решения ОВР с участием органических соединений Применение центрифугирования
Применение центрифугирования