Содержание
- 2. Подготовили: ученики 9 класса А Гимназии №1 Зорин Сергей Шакенов Серик Югай Дмитрий Огай Артём С
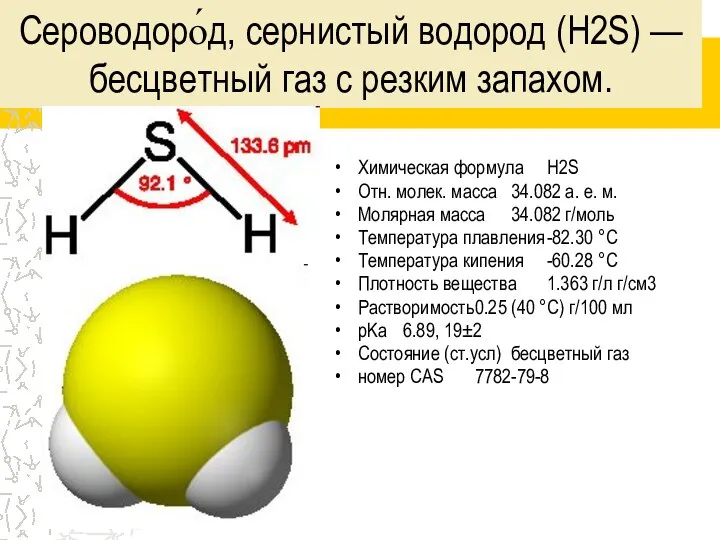
- 3. Сероводоро́д, сернистый водород (H2S) — бесцветный газ с резким запахом. Химическая формула H2S Отн. молек. масса
- 4. Нахождение в природе Встречается в природе в составе нефти, природного газа, вулканического газа и в горячих
- 5. Свойства Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2),
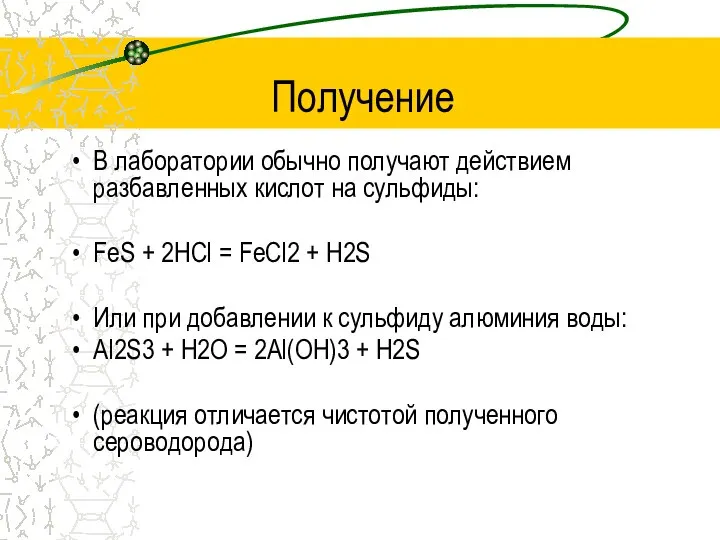
- 6. Получение В лаборатории обычно получают действием разбавленных кислот на сульфиды: FeS + 2HCl = FeCl2 +
- 7. Применение Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная вода используются
- 9. Скачать презентацию




 Презентация по Химии "Дезінфікуючі засоби" - скачать смотреть бесплатно
Презентация по Химии "Дезінфікуючі засоби" - скачать смотреть бесплатно Едкость Coca-Cola
Едкость Coca-Cola Новые наноматериалы. Получение, свойства и применение
Новые наноматериалы. Получение, свойства и применение Кружок «Алхимия»
Кружок «Алхимия» Пентоза - відновлювальна сировина для синтезу фуранових сполук
Пентоза - відновлювальна сировина для синтезу фуранових сполук Натуральный и синтетический каучуки. Резина.
Натуральный и синтетический каучуки. Резина.  Роль химических элементов в жизнедеятельности организма
Роль химических элементов в жизнедеятельности организма Сплавы серебра
Сплавы серебра Почвоведение. Введение
Почвоведение. Введение Электроды 1 рода
Электроды 1 рода Вакуумное фильтрование
Вакуумное фильтрование Радиоматериалы и радиокомпоненты. Зонная теория
Радиоматериалы и радиокомпоненты. Зонная теория Аминокислоты ароматического ряда и их производные
Аминокислоты ароматического ряда и их производные Анализ качества лекарственных косметических веществ, определяемых методом комплексонометрии
Анализ качества лекарственных косметических веществ, определяемых методом комплексонометрии Моделирование (7 класс)
Моделирование (7 класс) Презентация по Химии "Строение атома" - скачать смотреть бесплатно_
Презентация по Химии "Строение атома" - скачать смотреть бесплатно_ Типы химических реакций. Реакция соединения
Типы химических реакций. Реакция соединения Презентация по Химии "Органічні розчинники" - скачать смотреть бесплатно
Презентация по Химии "Органічні розчинники" - скачать смотреть бесплатно Общие свойства живых организмов
Общие свойства живых организмов Биохимия. Ферменты (Лекция№2)
Биохимия. Ферменты (Лекция№2) Презентация по Химии "Простые вещества – металлы" - скачать смотреть бесплатно
Презентация по Химии "Простые вещества – металлы" - скачать смотреть бесплатно Acids and alkalis
Acids and alkalis Тақырып. Ароматик көмірсутектер
Тақырып. Ароматик көмірсутектер Сабақтың тақырыбы: донорлыакцепторлы байланыс. Комплексті қосылыстар
Сабақтың тақырыбы: донорлыакцепторлы байланыс. Комплексті қосылыстар Гетерогенное ионное равновесие. Реакции обмена
Гетерогенное ионное равновесие. Реакции обмена Вакуумная перегонка мазута
Вакуумная перегонка мазута Названия алканов
Названия алканов "Вещества в твоей жизни" Урок химии в 9-м классе Учитель: Герасименко Е.В.
"Вещества в твоей жизни" Урок химии в 9-м классе Учитель: Герасименко Е.В.