Польза и вред металлов для человека
+
_
Кадмий – накапливаясь в почках, приводит
к гипертонии, снижению иммунитета, слабоумию. Содержится в табачном дыме, питьевой воде, загрязненном воздухе
Алюминий – старческое слабоумие, нарушение вазомоторных реакций, анемия, заболевание почек и печени. Пищевая фольга, посуда, пивные банки.
Свинец - нарушение мозговой деятельности, раковые заболевания, нарушение детородной функции у женщин. Загрязненный воздух – выхлопные газы автомобилей
Кальций – основа структурной костной ткани организма человека. Самое необходимое для человека минеральное вещество.
Медь - играет важную роль в обеспечении иммунной защиты, в том числе противорадиационной и противораковой, участвует в энергетическом обмене и кроветворении, в образовании защитного пигмента кожи меланина
Железо - необходимо для жизни, для образования гемоглобина (красных кровяных телец), миоглобина (красный пигмент в мышцах) и некоторых ферментов

![Из 118[1] химических элементов, открытых на данный момент (из них не](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1234562/slide-2.jpg)










 Природные полимеры. Белки и нуклеиновые кислоты
Природные полимеры. Белки и нуклеиновые кислоты Презентация Теллур
Презентация Теллур Алмаз (С)
Алмаз (С) Свойства спирта и воды
Свойства спирта и воды Стероиды, их химическое и пространственное строение
Стероиды, их химическое и пространственное строение Химический тренажер. Химические элементы
Химический тренажер. Химические элементы Білки. Властивості та функції
Білки. Властивості та функції Лабораторное оборудование, посуда и средства защиты Разработка для проведения практических работ по химии подготовила Нерев
Лабораторное оборудование, посуда и средства защиты Разработка для проведения практических работ по химии подготовила Нерев Презентация по химии ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
Презентация по химии ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ  Презентация по Химии "Соединения" - скачать смотреть бесплатно
Презентация по Химии "Соединения" - скачать смотреть бесплатно The application nanotechnology in chemistry
The application nanotechnology in chemistry Основания. Состав оснований
Основания. Состав оснований Щелочные металлы
Щелочные металлы Природный каучук
Природный каучук Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння АВТОР: НАЗАРЕНКО МАКСИМ ВОЛОДИМИРОВИЧ 10-А КЛАС,ГІМНАЗІЯ №32 ПЕЧЕРСЬКИЙ РАЙОН, М. КИЇВ ПЕДАГОГІЧНИЙ КЕРІВНИК: КУЗНЄЦОВА ЛЮДМИ
АВТОР: НАЗАРЕНКО МАКСИМ ВОЛОДИМИРОВИЧ 10-А КЛАС,ГІМНАЗІЯ №32 ПЕЧЕРСЬКИЙ РАЙОН, М. КИЇВ ПЕДАГОГІЧНИЙ КЕРІВНИК: КУЗНЄЦОВА ЛЮДМИ Свойства металлов Свойства металлов
Свойства металлов Свойства металлов Вещественный состав магматических горных пород
Вещественный состав магматических горных пород Хімія як наука
Хімія як наука Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары
Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары Генезис различных типов промежуточных фаз. Теория плотнейших упаковок
Генезис различных типов промежуточных фаз. Теория плотнейших упаковок Қатты дене-сұйық жанасу шегіндегі адсорбция
Қатты дене-сұйық жанасу шегіндегі адсорбция Степень окисления. Бинарные соединения металлов и не металлов: оксиды, хлориды, сульфиды и др.
Степень окисления. Бинарные соединения металлов и не металлов: оксиды, хлориды, сульфиды и др.  Химическая природа и состав нефти и газа. Физико-химические свойства нефтей и нефтепродуктов
Химическая природа и состав нефти и газа. Физико-химические свойства нефтей и нефтепродуктов Элементы третьего периода, периодической системы Д. И. Менделеева
Элементы третьего периода, периодической системы Д. И. Менделеева Программа «Gaussian»
Программа «Gaussian»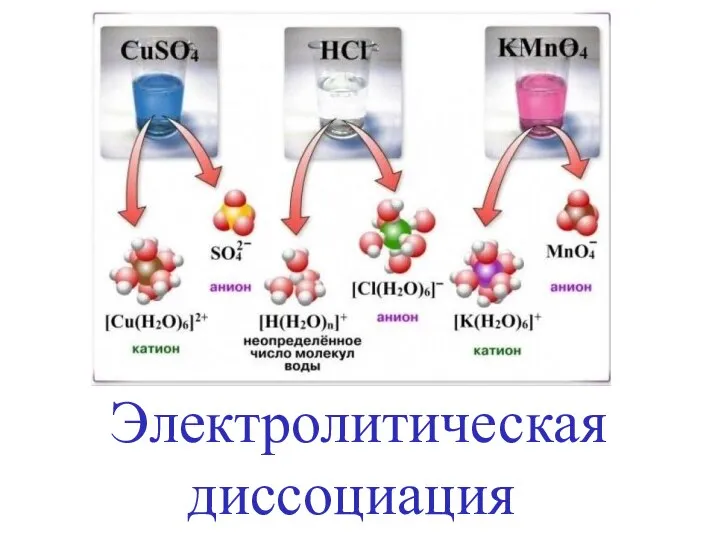 Электролитическая диссоциация
Электролитическая диссоциация Обобщающий урок по теме «Основные классы неорганических веществ»
Обобщающий урок по теме «Основные классы неорганических веществ»