Содержание
- 2. ВОДА Девиз урока: Вода – это жизнь!
- 3. 22 марта — Всемирный день водных ресурсов по календарю ООН, День воды.
- 4. Аквариум, Акватория, Акваланг, Акварель.
- 9. Исследование свойств воды
- 10. №1. Вода в природе Велики ли запасы воды на нашей планете? 2. Чего больше на Земле
- 11. Вид из космоса
- 12. Сколько воды на нашей планете? Общие мировые запасы воды во всех её агрегатных состояниях огромны. Вода
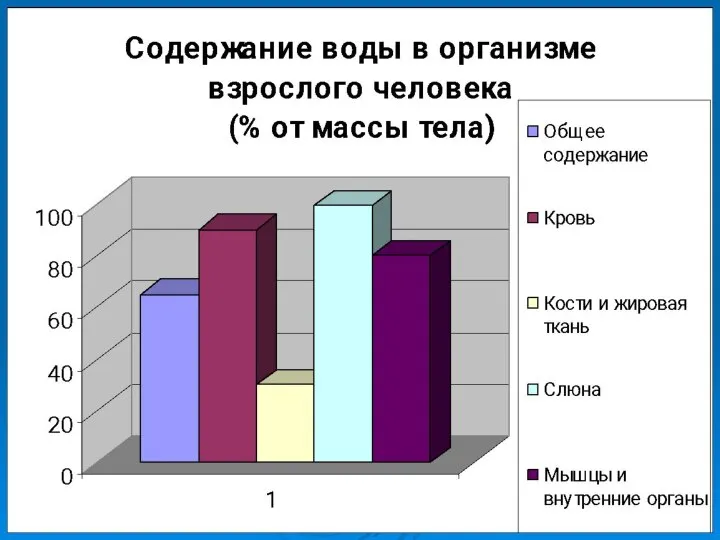
- 13. №2 Значение воды для жизни организмов 1. Какова роль воды в организме человека? 2. Зависит ли
- 15. №3 Вода — растворитель Почему воду называют универсальным растворителем? 2. Какой величиной характеризуется способность веществ растворяться
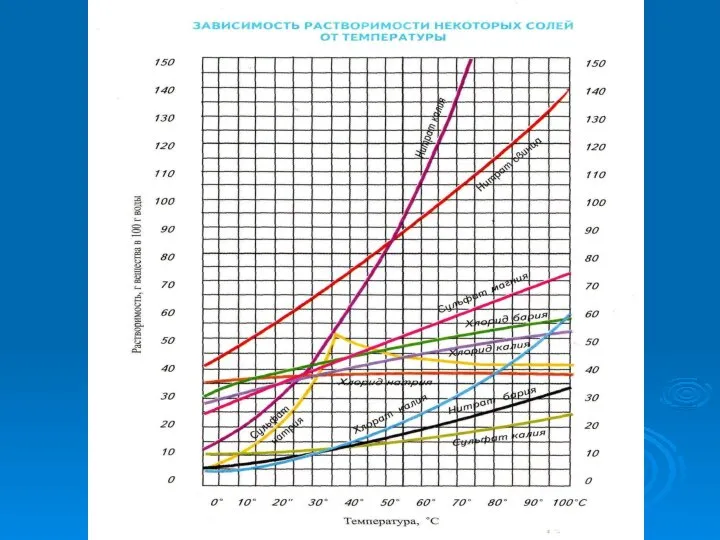
- 17. №4 Химики-экспериментаторы Растворимость зависит от температуры? От чего еще зависит растворимость ?
- 18. Особые свойства воды Видео-1 Видео-2
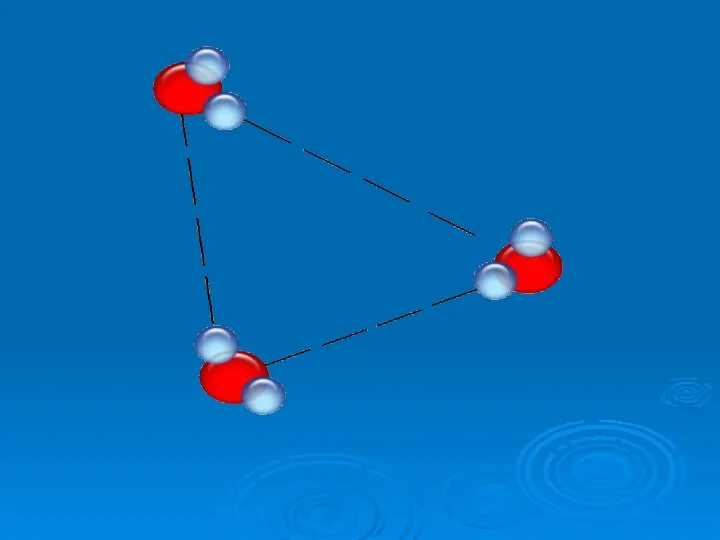
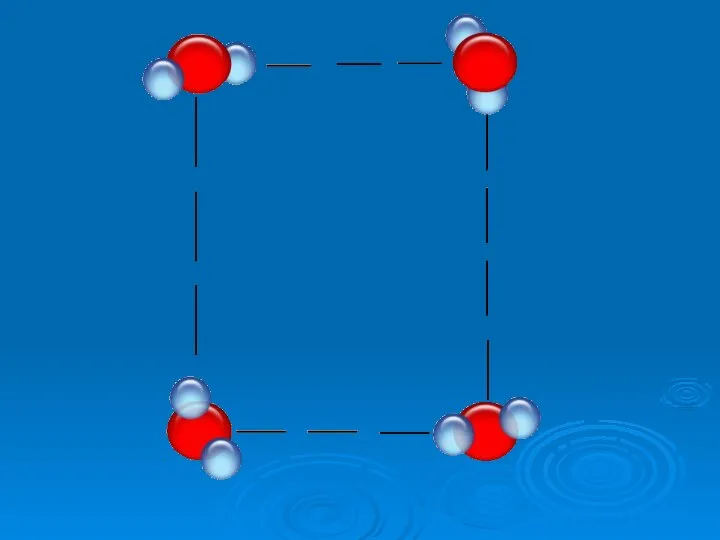
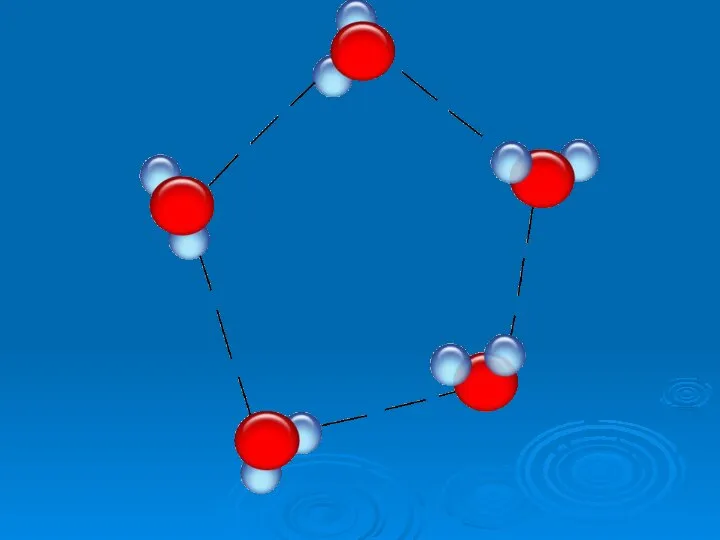
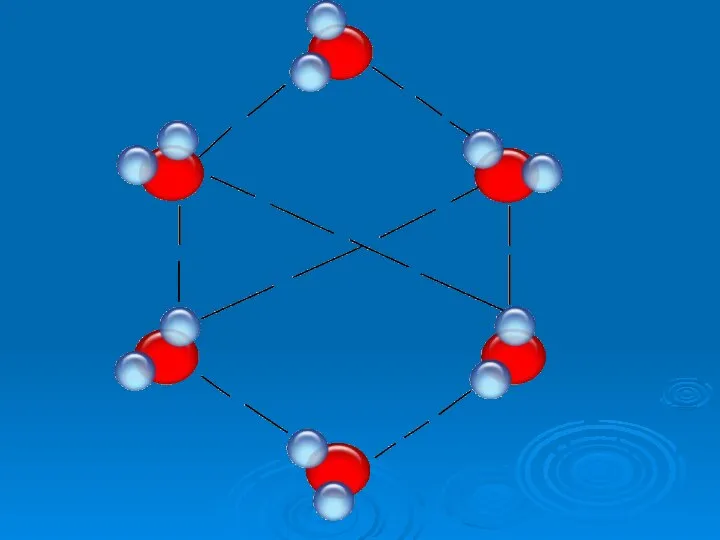
- 19. №5 Особые свойства воды Какое свойство воды спасает нашу планету от оледенения? 2. При какой температуре
- 20. Химические свойства воды Она необходима нам всегда. И юный химик, верно, пожелает Узнать, с чем реагирует
- 21. Взаимодействие воды с простыми веществами Опишет наша первая глава Процессы водорода замещения, И как с водой
- 22. 1. Реакции воды с металлами Кусочек лития пинцетом взят. Отметьте, что условия обычны. Опустим в воду
- 23. 2. Реакции воды с неметаллами И неметаллы могут вытеснять Газ водород из водяного пара. К примеру,
- 24. Взаимодействие воды со сложными веществами Поговорим о сложных веществах. С оксидами сначала разберемся. Причем практически, не
- 25. 1. Реакции воды с основными оксидами К оксиду кальция воды прилить Вмиг в гидроксид случится превращение.
- 26. В природе есть железная руда, Железняки — основные оксиды. Так вот, не растворяет их вода. Но
- 27. 2. Реакции воды с кислотными оксидами Нам так приятен летнею порой Вкус кислый газированной водицы! А
- 28. А под ногами нашими песок — Оксид кислотный. Только он едва ли С водой соединиться мог,
- 29. Так как же общий вывод прозвучит? У вас уже есть опыт ощутимый: С водой соединяется оксид,
- 32. Скачать презентацию






















 Сульфатна кислота. Фізичні та хімічні властивості сульфатної кислоти
Сульфатна кислота. Фізичні та хімічні властивості сульфатної кислоти Сахароза
Сахароза Карбоновые кислоты и их гетерофункциональные производные
Карбоновые кислоты и их гетерофункциональные производные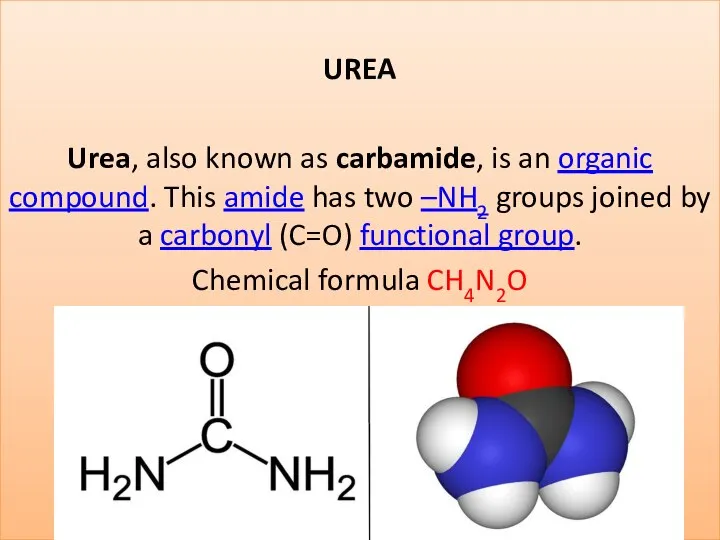 Urea (carbamide)
Urea (carbamide) Основные классы неорганических веществ
Основные классы неорганических веществ В глубине кристалла (11 класс)
В глубине кристалла (11 класс) Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля
Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля Галогены. Галогеноводороды
Галогены. Галогеноводороды Ағзалар мен биосұйықтар минерализатындағы "металдық улар"
Ағзалар мен биосұйықтар минерализатындағы "металдық улар" Циклоалканы
Циклоалканы Термохимия. Типы энтальпии
Термохимия. Типы энтальпии Radioimmunoassay& enzyme linked immunosorbent
Radioimmunoassay& enzyme linked immunosorbent Lektsia_1_Osnovnye_ponyatia_i_zakony_khimii
Lektsia_1_Osnovnye_ponyatia_i_zakony_khimii Гидролиз солей
Гидролиз солей Титан. История открытия титана
Титан. История открытия титана Каучук. Применение
Каучук. Применение Методы анализа молочных продуктов с использованием электрофореза. Электрофоретический метод в биохимии
Методы анализа молочных продуктов с использованием электрофореза. Электрофоретический метод в биохимии Классификация, виды бензинов и их свойства
Классификация, виды бензинов и их свойства Комплексы хлорида и иодида цинка (II) с карбамидом: синтез, характеристика и биологическая активность
Комплексы хлорида и иодида цинка (II) с карбамидом: синтез, характеристика и биологическая активность Классификация аминокислот в зависимости от природы радикалов
Классификация аминокислот в зависимости от природы радикалов Коллоидная химия
Коллоидная химия Медь, ее маркировка. Латуни. Бронзы
Медь, ее маркировка. Латуни. Бронзы Жидкостная хроматография
Жидкостная хроматография Эмульсия. Основные типы эмульсий
Эмульсия. Основные типы эмульсий Домашний эксперимент № 7 по химии «Цветные опыты - на стыке двух наук»
Домашний эксперимент № 7 по химии «Цветные опыты - на стыке двух наук» Биохимия и молекулярная биология. Биосинтез липидов. Лекция 8
Биохимия и молекулярная биология. Биосинтез липидов. Лекция 8 Спирты. Методы получения
Спирты. Методы получения Природные источники и переработка углеводородов
Природные источники и переработка углеводородов