Содержание
- 2. Химическая формула H2CO3
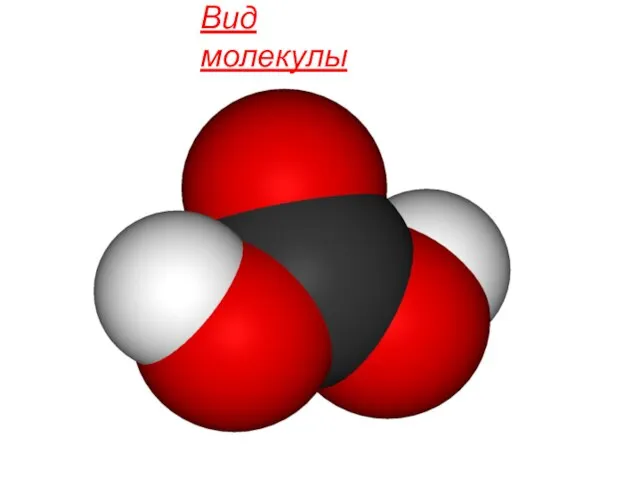
- 3. Вид молекулы
- 4. Общие сведения Угольная кислота́ — слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых
- 5. Физические свойства Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и
- 6. Химические свойства
- 7. Разложение При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево,
- 8. Получение Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается
- 9. Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). В биохимии используется свойство
- 11. Скачать презентацию







 Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра
Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра Белки и пептиды. Ферменты
Белки и пептиды. Ферменты Химические свойства алкадиенов и алкинов
Химические свойства алкадиенов и алкинов Кристаллические решетки
Кристаллические решетки Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома Дисперсные системы. Строение коллоидных частиц лиофобных золей
Дисперсные системы. Строение коллоидных частиц лиофобных золей Спирты: свойства, получение, применение
Спирты: свойства, получение, применение Минеральные удобрения: польза и вред
Минеральные удобрения: польза и вред Химическая термодинамика и кинетика
Химическая термодинамика и кинетика 3-Khimicheskaya_organizatsia_kletki
3-Khimicheskaya_organizatsia_kletki Способы количественного определения белка
Способы количественного определения белка «Созвездие талантов». Игра-зачет по теме «Основные классы неорганической химии» 8 класс
«Созвездие талантов». Игра-зачет по теме «Основные классы неорганической химии» 8 класс VB, VIB и VIIB подгруппы ПС: элементы подгрупп ванадия, хрома и марганца
VB, VIB и VIIB подгруппы ПС: элементы подгрупп ванадия, хрома и марганца Мұнай, құрамыөңдеу әдістері
Мұнай, құрамыөңдеу әдістері Спирты. Классификация спиртов
Спирты. Классификация спиртов Конструкционные полимеры: классификация, достижения и проблемы
Конструкционные полимеры: классификация, достижения и проблемы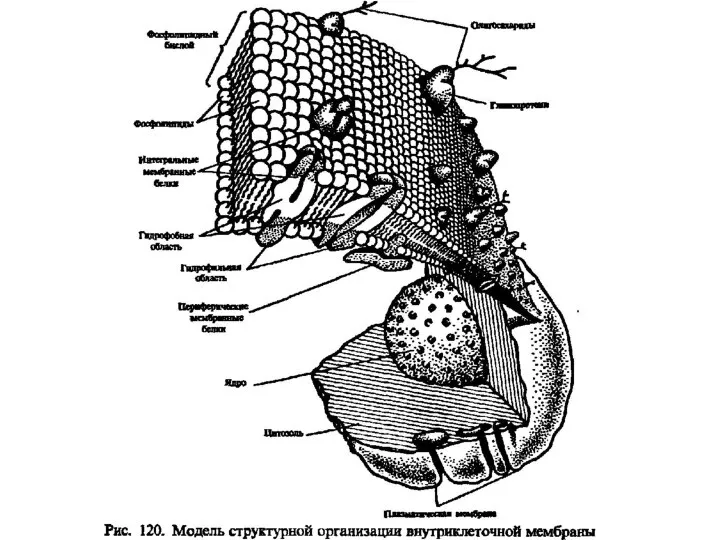 Липиды. Классификация липидов
Липиды. Классификация липидов Аммиак
Аммиак Электрохимические методы анализа: потенциометрия. Потенциометрическое титрование
Электрохимические методы анализа: потенциометрия. Потенциометрическое титрование Щелочные металлы
Щелочные металлы Електричний струм у газах та його використання
Електричний струм у газах та його використання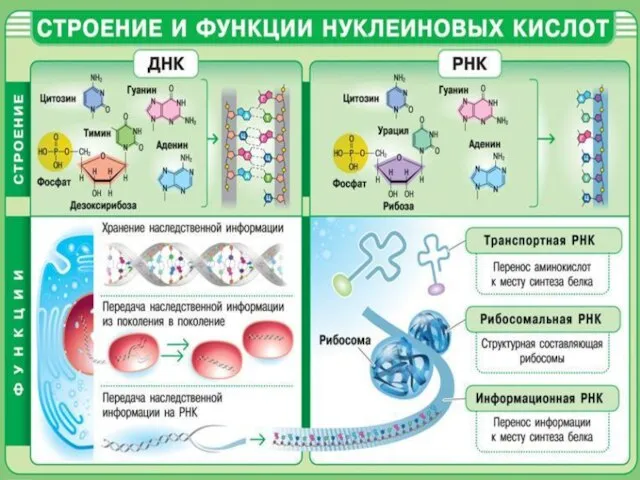 Строение и функции нуклеиновых кислот
Строение и функции нуклеиновых кислот Основания. Физические и химические свойства оснований
Основания. Физические и химические свойства оснований Презентация по Химии "Производные карбоновых кислот" - скачать смотреть
Презентация по Химии "Производные карбоновых кислот" - скачать смотреть  Азотная кислота и её соли
Азотная кислота и её соли Химические свойства оксидов
Химические свойства оксидов Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер
Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер Кристаллические и аморфные тела
Кристаллические и аморфные тела