Содержание
- 2. Диеновые углеводороды (алкадиены) Диеновыми углеводородами или алкадиенами, называются ненасыщенные углеводороды с открытой цепью углеродных атомов, в
- 3. Номенклатура и классификация Индивидуальные углеводороды с двумя двойными связями называют, пользуясь принципами международной заместительной номенклатуры для
- 4. Задание 1 Напишите формулы углеводородов диенового ряда от С=3 до С=10. К каждому углеводороду С5 и
- 5. Диеновые углеводороды, в которых две двойные связи находятся рядом и не разделены простыми связями, называют углеводородами
- 6. Диеновые углеводороды, в молекулах которых две двойные связи разделены двумя или более простыми связями, называются углеводородами
- 7. Особое значение имеют этиленовые углеводороды, в молекулах которых двойные связи разделены одной простой связью. Такие углеводороды
- 8. Ненасыщенные углеводороды ряда ацетилена (алкины) Углеводородами ряда ацетилена или ацетиленовыми углеводородами называют ненасыщенные углеводороды, в молекулах
- 9. Гомология, изомерия и номенклатура Состав каждого члена гомологического ряда ацетиленовых углеводородов может быть выражен общей эмпирической
- 10. Изомерия. Возможны два типа ацетиленовых соединений R—C ≡C—Н и R—C≡C—R'. (Линейная геометрия тройной связи делает невозможной
- 11. Номенклатура Международная заместительная номенклатура. Ацетиленовые углеводороды называют по заместительной номенклатуре так же, как предельные, с той
- 12. Напишите формулы углеводородов алкинового ряда от С=3 до С=10. К каждому углеводороду С5 и больше напишите
- 13. Свойства ацетиленовых углеводородов (алкинов) Физические свойства. Зависимости изменения физических свойств в гомологических рядах ацетиленовых углеводородов по
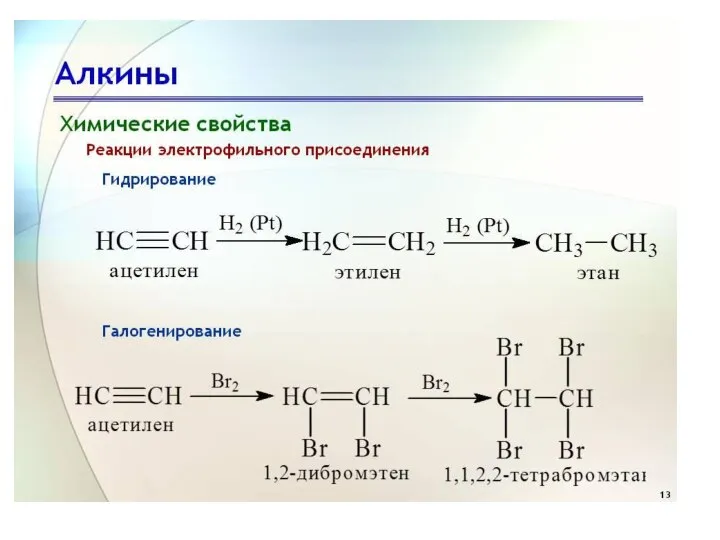
- 14. Химические свойства. Ацетиленовым углеводородам, так же как этиленовым, свойственны реакции присоединения по месту кратной связи, в
- 15. Присоединение водорода (реакция гидрирования) В присутствии катализаторов (например, Pt или Pd) водород присоединяется по месту тройной
- 17. Присоединение галогенов При взаимодействии ацетиленовых углеводородов с галогенами последние присоединяются по месту тройной связи; вначале присоединяется
- 18. Присоединение галогеноводородов Присоединение галогеноводородов протекает ступенчато. Вначале образуется моногалогенпроизводное этиленового ряда К последнему может присоединиться еще
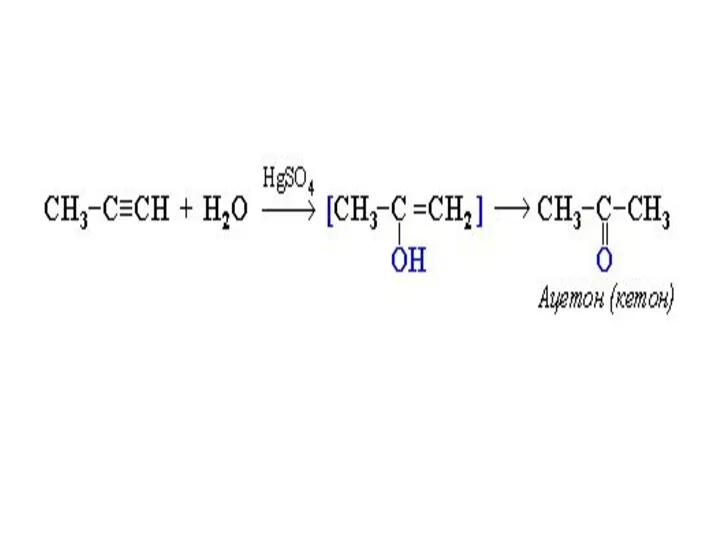
- 19. Присоединение воды (реакция гидратации) Эта реакция была открыта в 1881г. М.Г. Кучеровым. Под действием солей окисной
- 20. Образующееся соединение – виниловый спирт – относится к непредельным спиртам, в которых гидроксильная группа расположена при
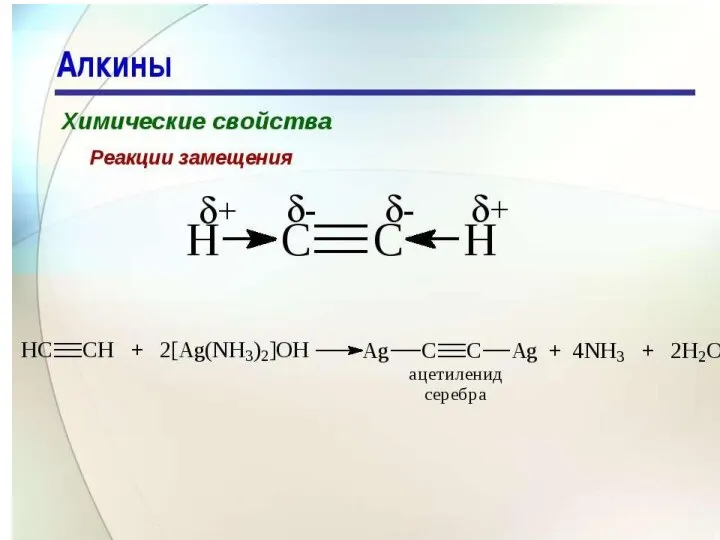
- 22. Замещение водорода при атомах углерода с тройной связью на металл Все рассмотренные до сих пор реакции
- 24. Присоединение СО Присоединение СО (реакция В. Реппе). Идет в присутствии никелевых катализаторов (Х=ОН, ОС2Н5, NH2)
- 28. Скачать презентацию






















 Теорія взаємного впливу атомів у молекулах органічних речовин
Теорія взаємного впливу атомів у молекулах органічних речовин Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Промислові способи отримання металів
Промислові способи отримання металів  Изомерия алкенов
Изомерия алкенов Сера
Сера Основы химического равновесия
Основы химического равновесия Химия элементов VIA группы. Сера
Химия элементов VIA группы. Сера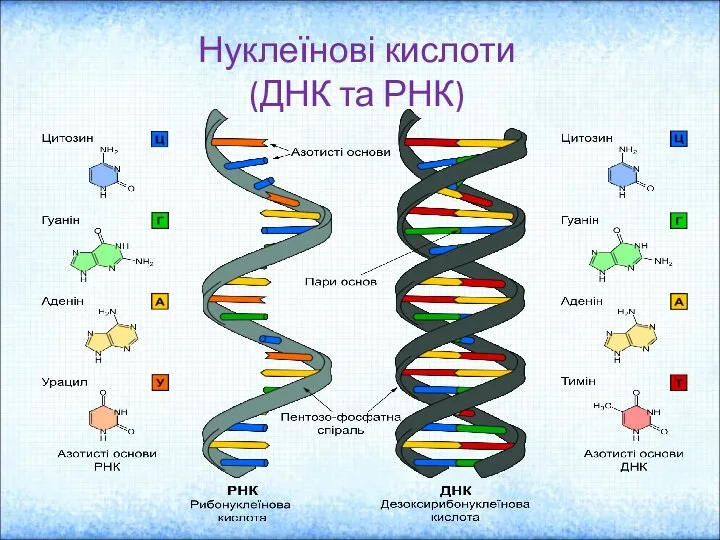 Нуклеїнові кислоти (ДНК та РНК)
Нуклеїнові кислоти (ДНК та РНК)  Аттестационная работа. Методическая разработка программы для 5 классов: Мир химии
Аттестационная работа. Методическая разработка программы для 5 классов: Мир химии Количественное определение лекарственных средств
Количественное определение лекарственных средств Органическая химия: «Жиры» Орлова Ольга Николаевна Школа №357 Приморского р-на.
Органическая химия: «Жиры» Орлова Ольга Николаевна Школа №357 Приморского р-на. Совместимость материалов
Совместимость материалов Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Ферум /Залізо
Ферум /Залізо  Массообменные процессы
Массообменные процессы Франций
Франций Комлексті қосылыстардың кұрылысы мен қасиеттерін тусіндіретін теория, енгізген 1893 ж А. Вернер
Комлексті қосылыстардың кұрылысы мен қасиеттерін тусіндіретін теория, енгізген 1893 ж А. Вернер Изучение ТЭД и ОВР в школьном курсе химии
Изучение ТЭД и ОВР в школьном курсе химии Высокоэффективная жидкостная препаративная хроиматография
Высокоэффективная жидкостная препаративная хроиматография Место и роль химии при изучении Естествознания в системе школьного образования
Место и роль химии при изучении Естествознания в системе школьного образования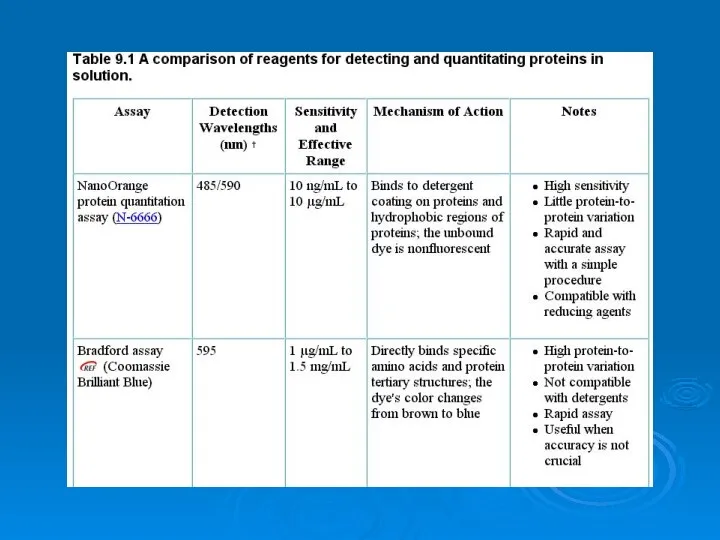 Analysis of proteins
Analysis of proteins Презентация по Химии "Пластмаси як різновид полімерів" - скачать смотреть бесплатно
Презентация по Химии "Пластмаси як різновид полімерів" - скачать смотреть бесплатно Минеральные удобрения
Минеральные удобрения Стани води
Стани води Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы Лекция 8. Нуклеофильное присоединение к кратным связям углерод-гетероатом. Карбонильные соединения
Лекция 8. Нуклеофильное присоединение к кратным связям углерод-гетероатом. Карбонильные соединения Полимерные материалы (ПМ). Классификация ПМ
Полимерные материалы (ПМ). Классификация ПМ Пуриновые основания
Пуриновые основания