Содержание
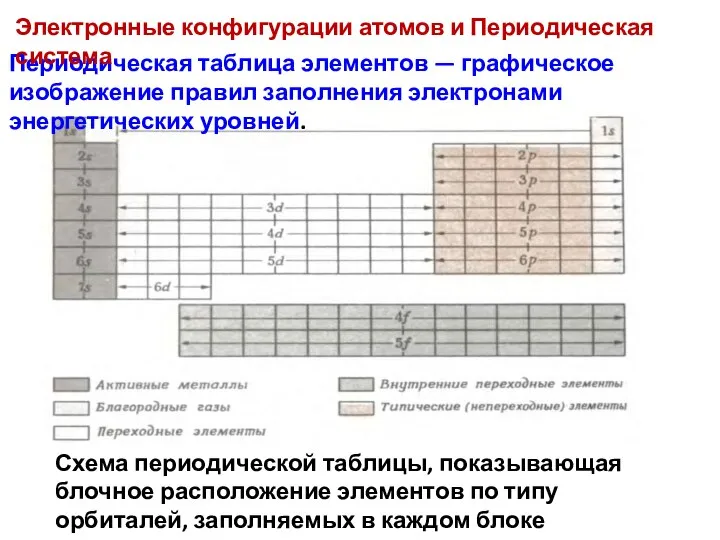
- 3. Схема периодической таблицы, показывающая блочное расположение элементов по типу орбиталей, заполняемых в каждом блоке Периодическая таблица
- 4. Правила заполнения электронных оболочек атомов 1. Принцип последовательного заполнения атомных орбиталей с наименьшей энергией; орбитали заполняются,
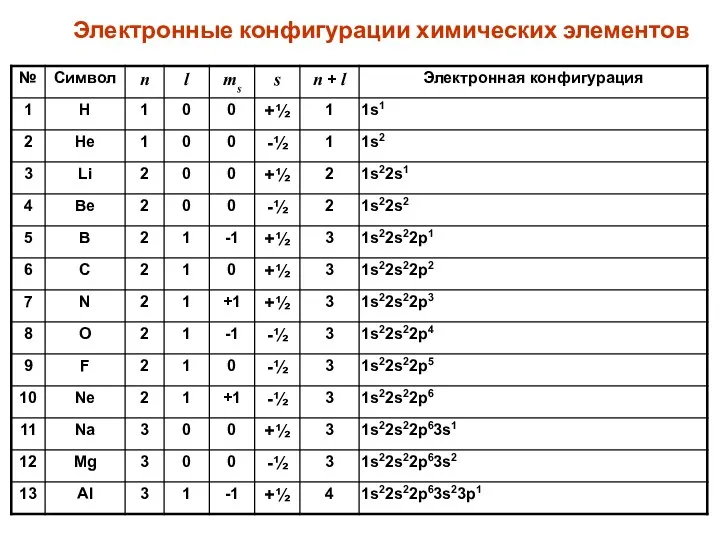
- 5. Электронные конфигурации химических элементов
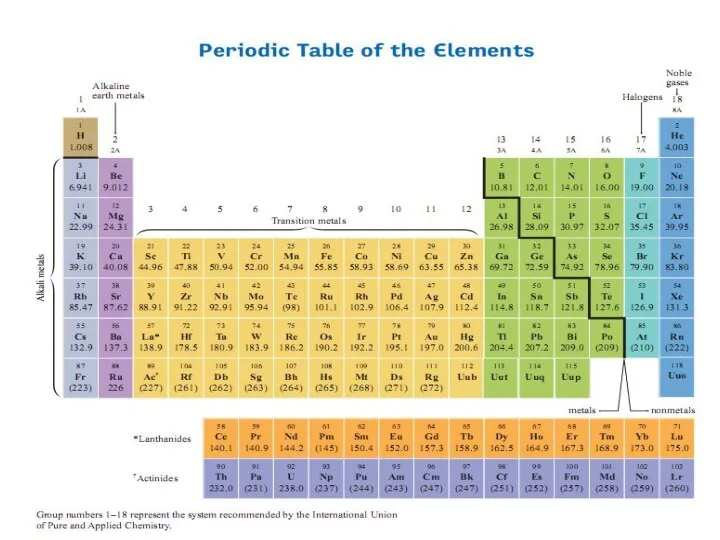
- 8. Современная Периодическая система, в которой элементы расположены в порядке увеличения зарядов ядер. В вертикальных столбцах –
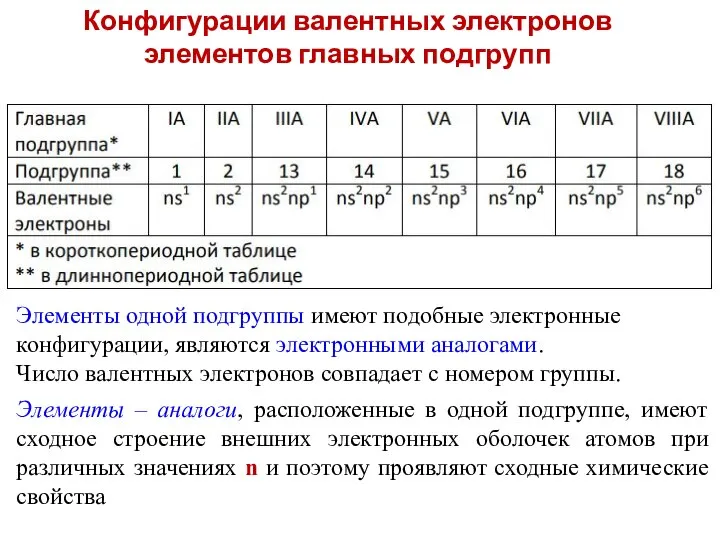
- 10. Конфигурации валентных электронов элементов главных подгрупп Элементы одной подгруппы имеют подобные электронные конфигурации, являются электронными аналогами.
- 11. В периоде с ростом заряда ядра (Z) происходит закономерное изменение конфигураций валентных электронов. С увеличением зарядов
- 12. Современная формулировка Периодического Закона гласит: Свойства химических элементов, а также формы и свойства их соединений находятся
- 13. Схожесть в химических свойствах элементов одной подгруппы определяется подобием электронных конфигураций их внешнего валентного слоя Вертикальная
- 14. Периодически изменяющиеся свойства атомов Атомные и ионные радиусы R 2. Энергия ионизации Еион 3. Сродство атома
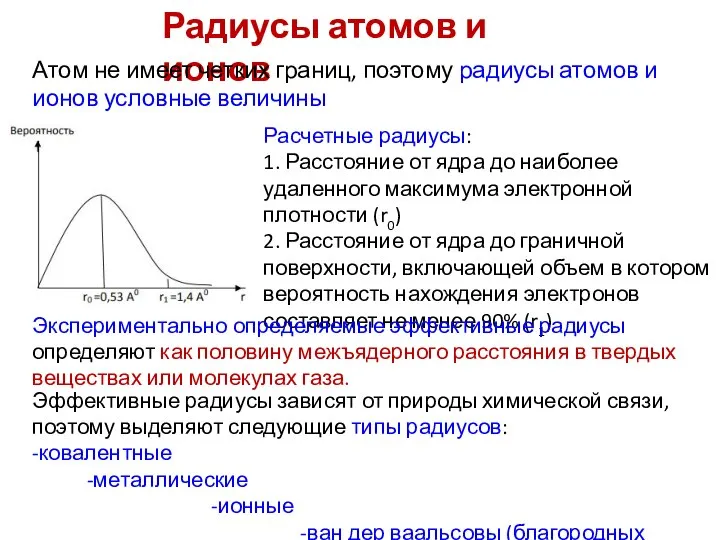
- 15. Радиусы атомов и ионов Атом не имеет четких границ, поэтому радиусы атомов и ионов условные величины
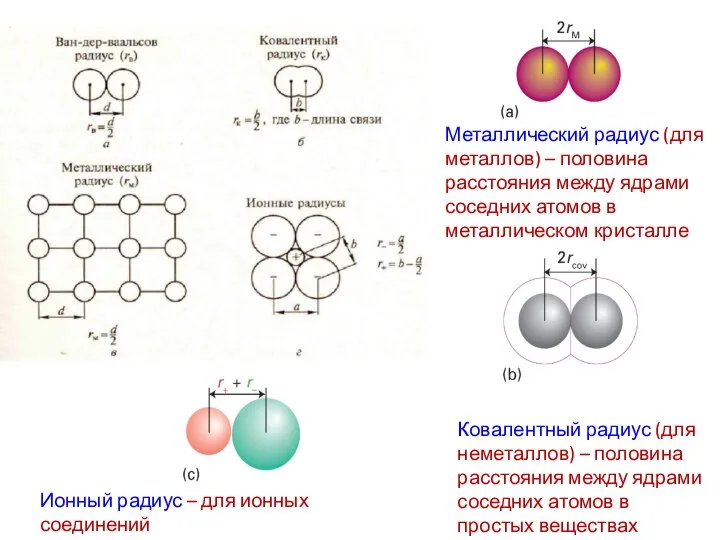
- 16. Металлический радиус (для металлов) – половина расстояния между ядрами соседних атомов в металлическом кристалле Ковалентный радиус
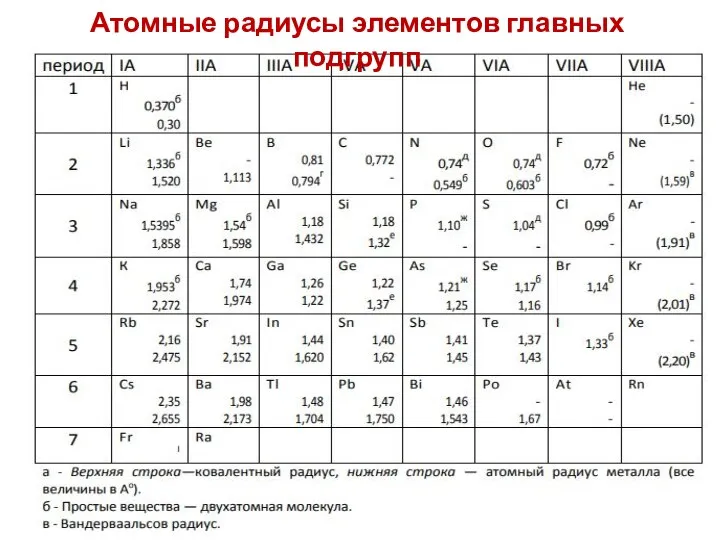
- 17. Атомные радиусы элементов главных подгрупп
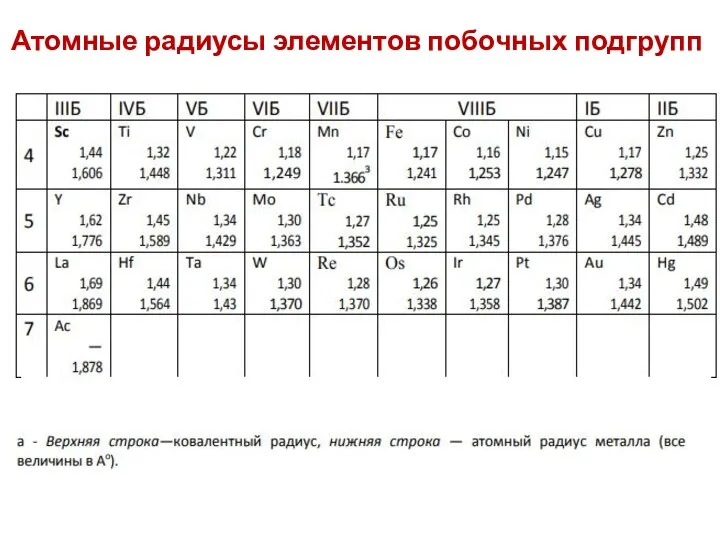
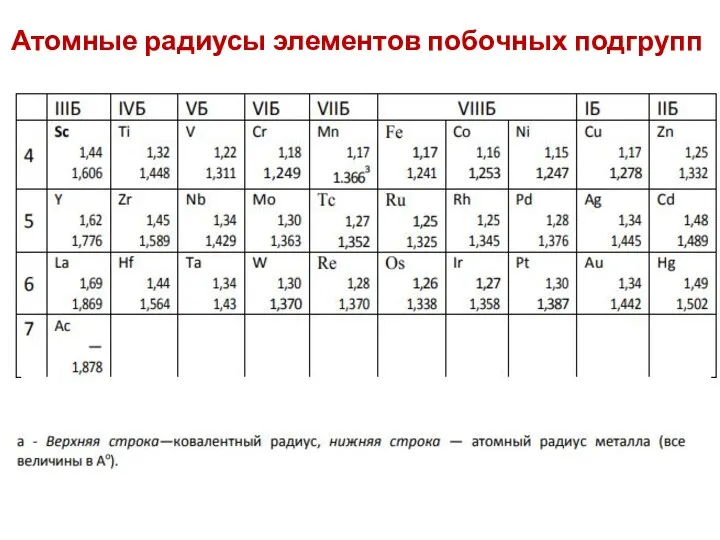
- 18. Атомные радиусы элементов побочных подгрупп
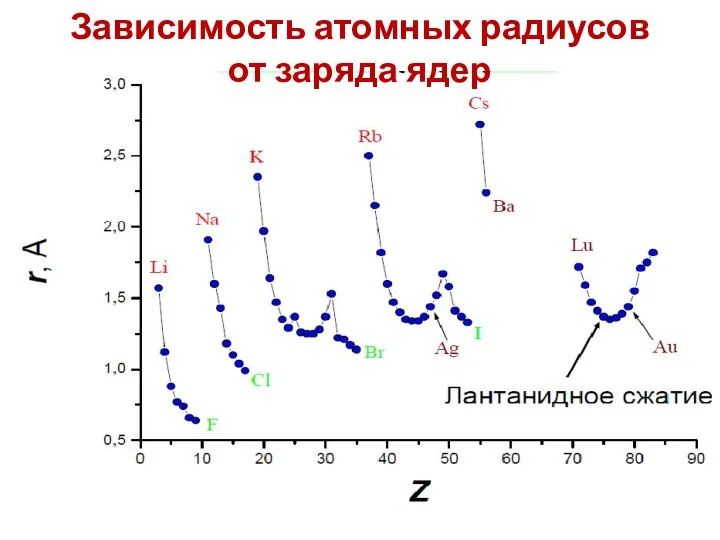
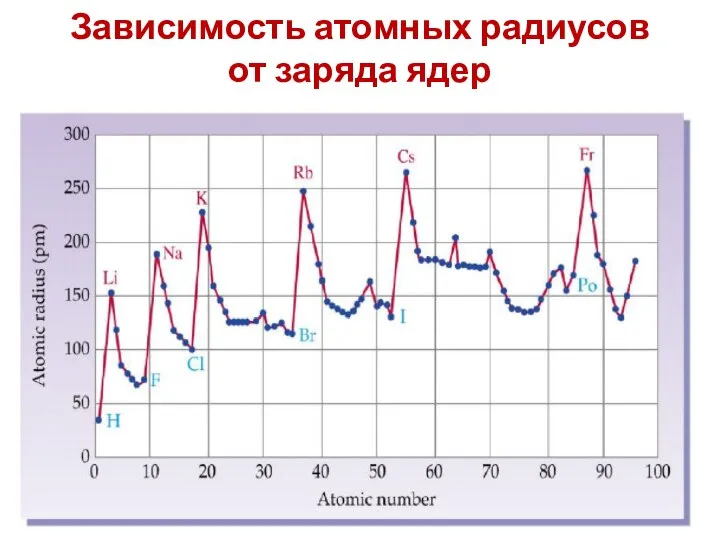
- 19. Зависимость атомных радиусов от заряда ядер
- 20. Зависимость атомных радиусов от заряда ядер
- 21. Атомные радиусы элементов главных подгрупп
- 22. Атомные радиусы элементов побочных подгрупп
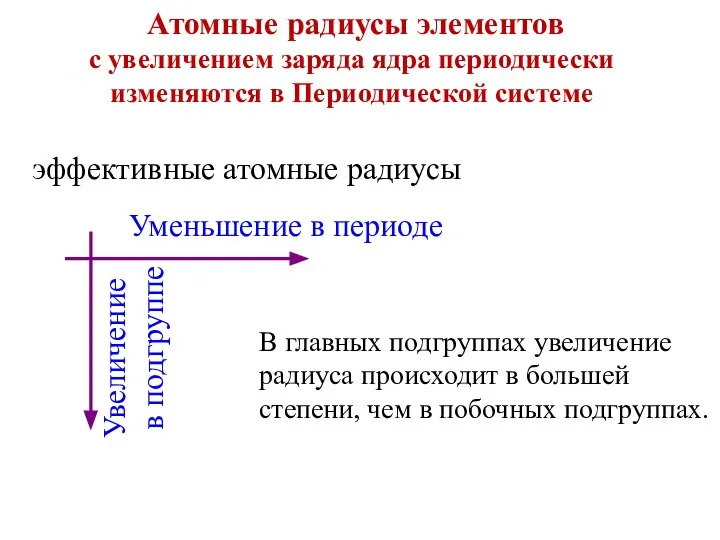
- 23. эффективные атомные радиусы Атомные радиусы элементов с увеличением заряда ядра периодически изменяются в Периодической системе В
- 24. Электронные конфигурации ионов Положительно заряженные ионы (катионы) образуются при отрыве электронов от атома А – ne
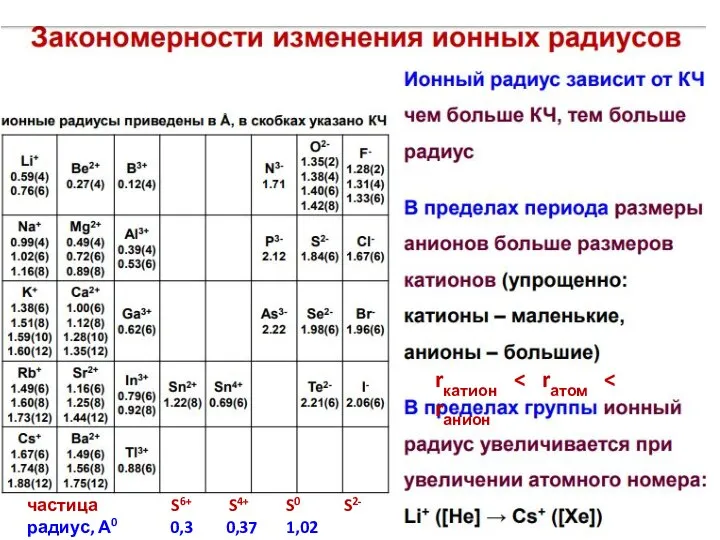
- 25. частица S6+ S4+ S0 S2- радиус, А0 0,3 0,37 1,02 1,86 rкатион
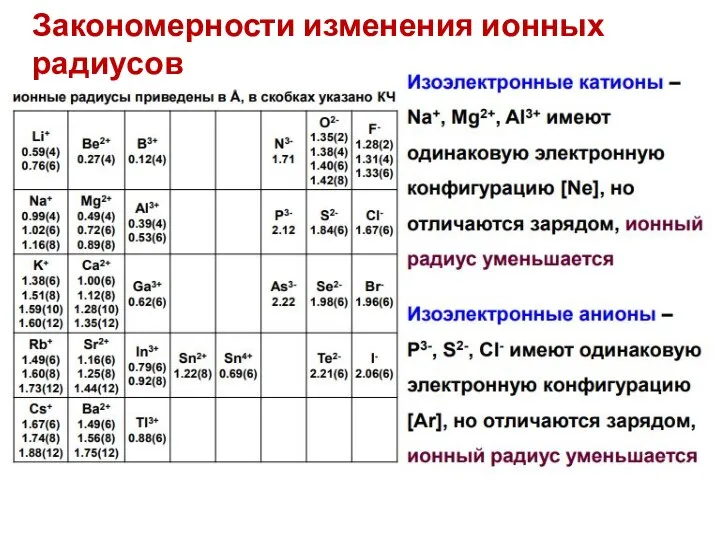
- 27. Закономерности изменения ионных радиусов
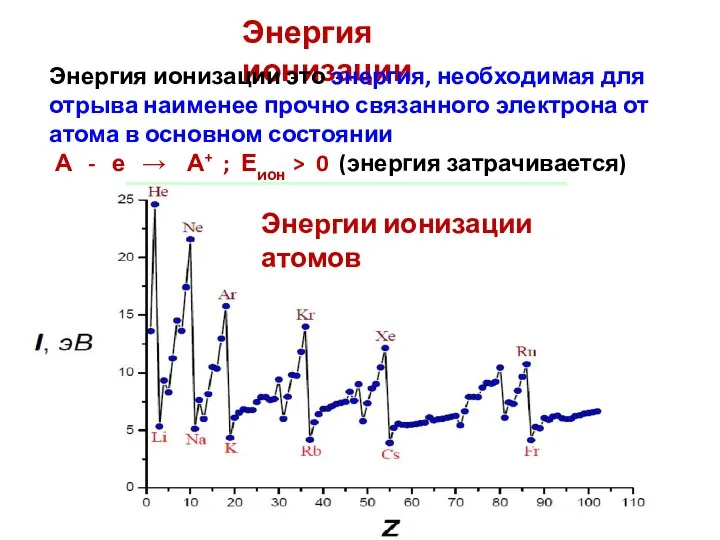
- 29. Энергии ионизации атомов Энергия ионизации Энергия ионизации это энергия, необходимая для отрыва наименее прочно связанного электрона
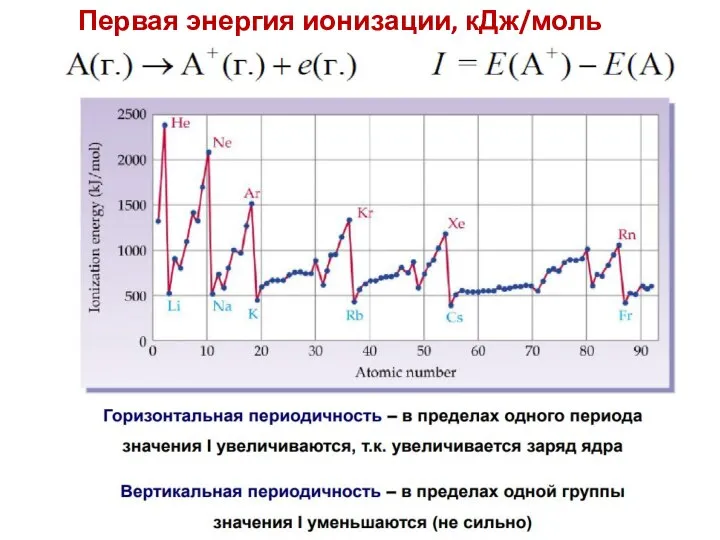
- 30. Первая энергия ионизации, кДж/моль
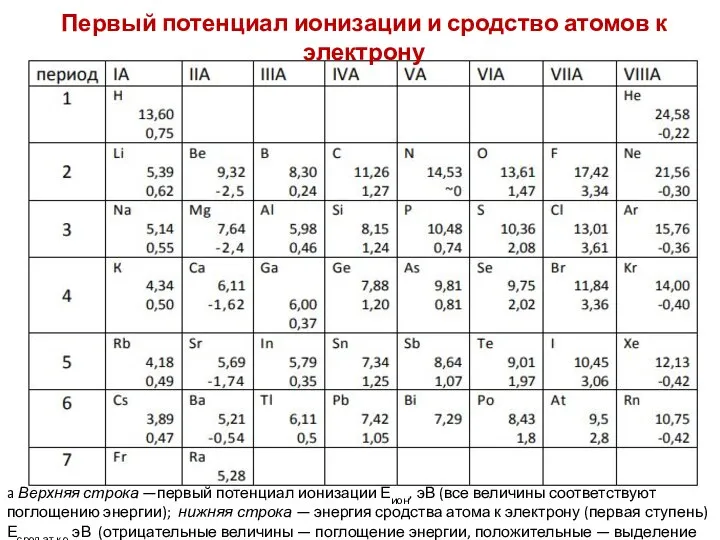
- 31. a Верхняя строка —первый потенциал ионизации Еион, эВ (все величины соответствуют поглощению энергии); нижняя строка —
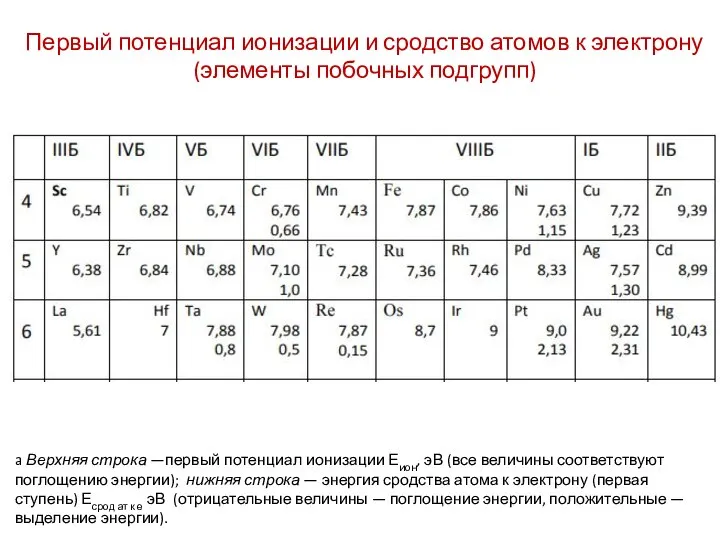
- 32. a Верхняя строка —первый потенциал ионизации Еион, эВ (все величины соответствуют поглощению энергии); нижняя строка —
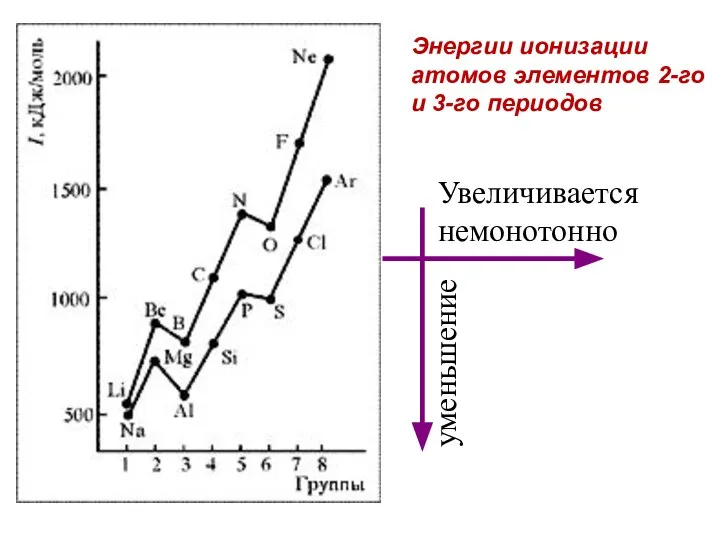
- 33. Энергии ионизации атомов элементов 2-го и 3-го периодов Увеличивается немонотонно уменьшение
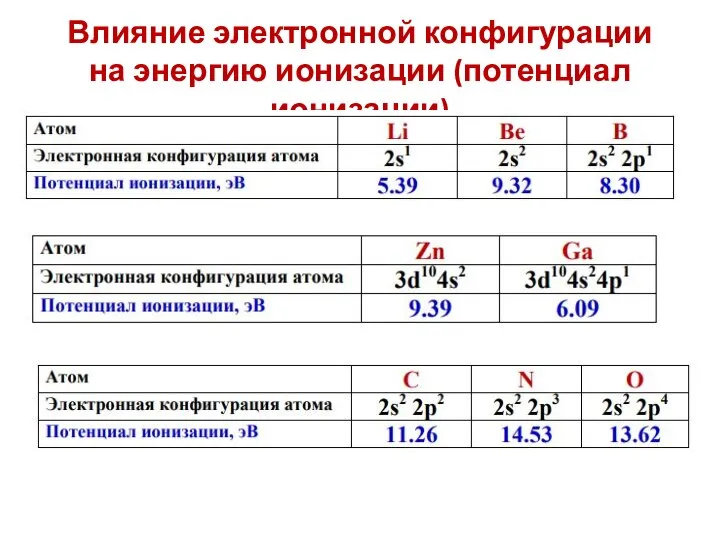
- 34. Влияние электронной конфигурации на энергию ионизации (потенциал ионизации)
- 35. Анализ изменения энергии ионизации позволяет сделать выводы: 1. С ростом заряда ядра в периодах Еион увеличивается,
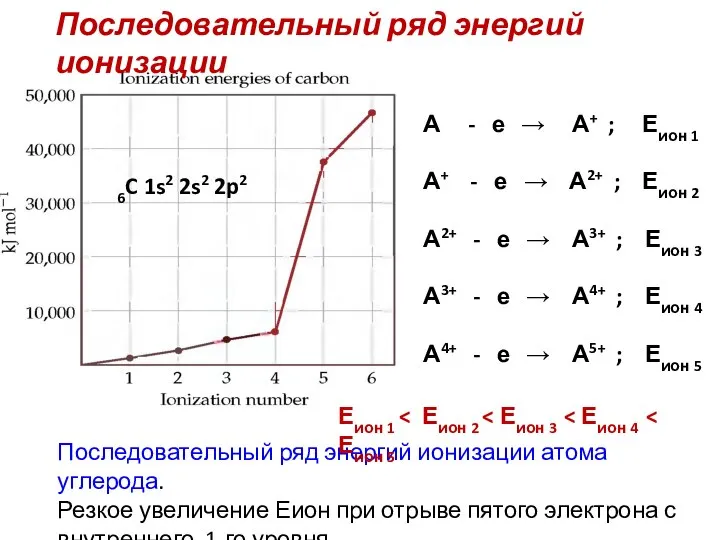
- 36. Последовательный ряд энергий ионизации Последовательный ряд энергий ионизации атома углерода. Резкое увеличение Еион при отрыве пятого
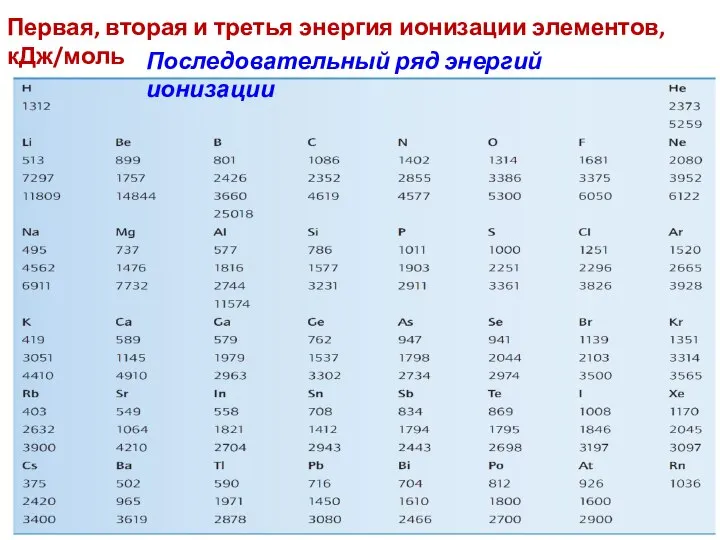
- 37. Первая, вторая и третья энергия ионизации элементов, кДж/моль Последовательный ряд энергий ионизации
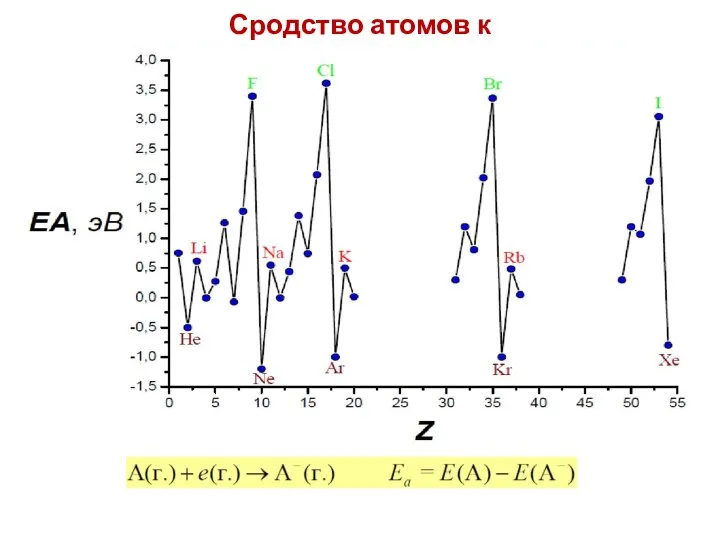
- 38. Сродство атомов к электрону Энергия сродства атома к электрону — энергия, которая выделяется или поглощается при
- 39. Сродство атомов к электрону
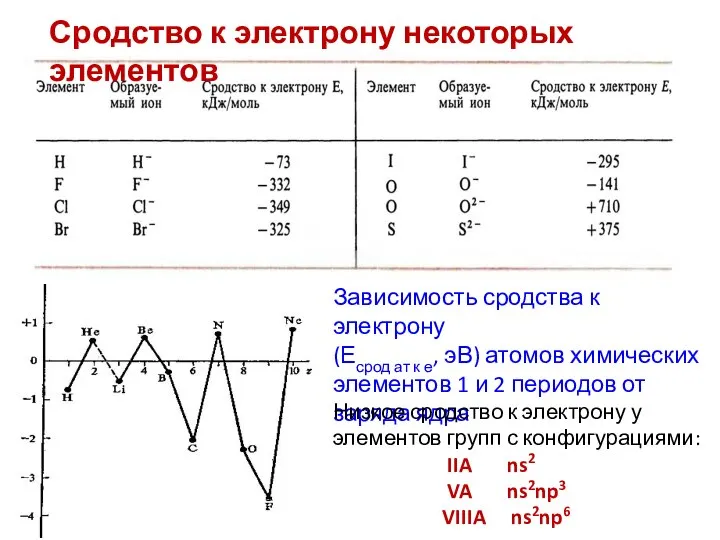
- 40. Зависимость сродства к электрону (Есрод ат к е, эВ) атомов химических элементов 1 и 2 периодов
- 41. Анализ изменения Еср. позволяет сделать выводы: 1. Минимальное «низкое сродство» к электрону наблюдается у атомов, имеющих
- 43. Электроотрицательность (ЭО или χ) [кДж/моль] или [эВ/атом] – характеризует способность атома удерживать свои электроны и притягивать
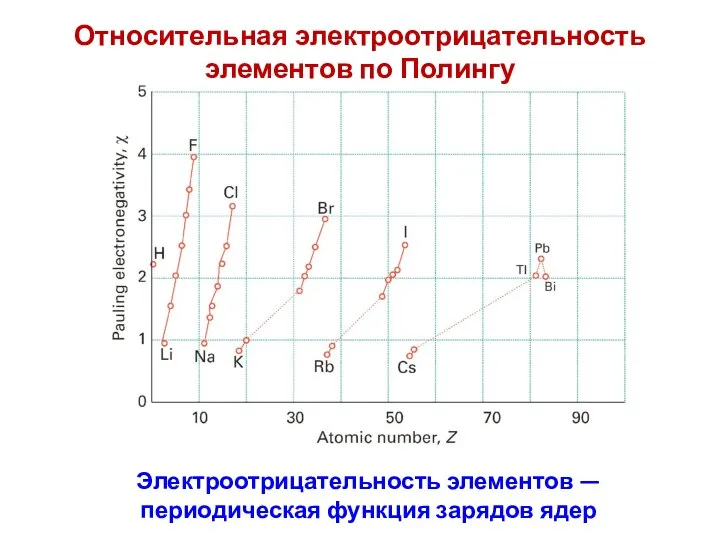
- 44. Относительная электроотрицательность элементов по Полингу
- 45. Относительная электроотрицательность элементов по Полингу Электроотрицательность элементов — периодическая функция зарядов ядер
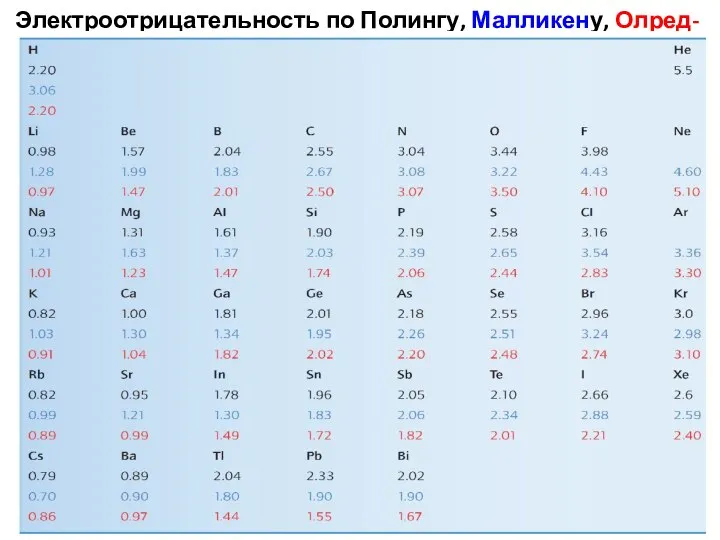
- 46. Электроотрицательность по Полингу, Малликену, Олред-Рохау
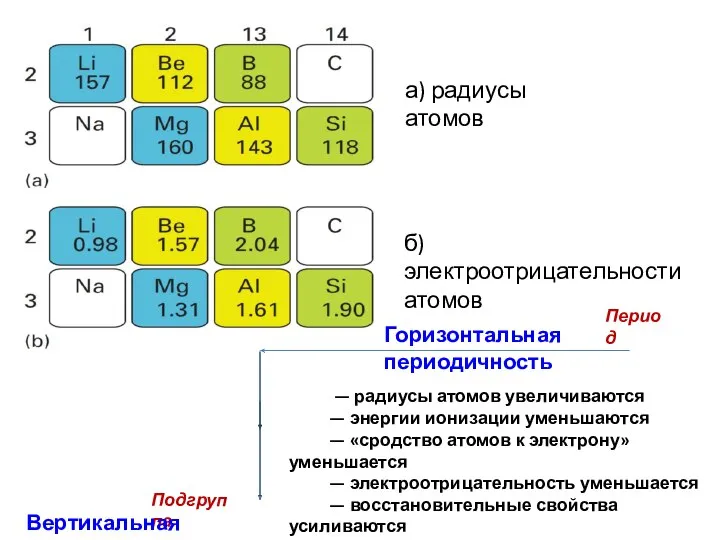
- 47. — радиусы атомов увеличиваются — энергии ионизации уменьшаются — «сродство атомов к электрону» уменьшается — электроотрицательность
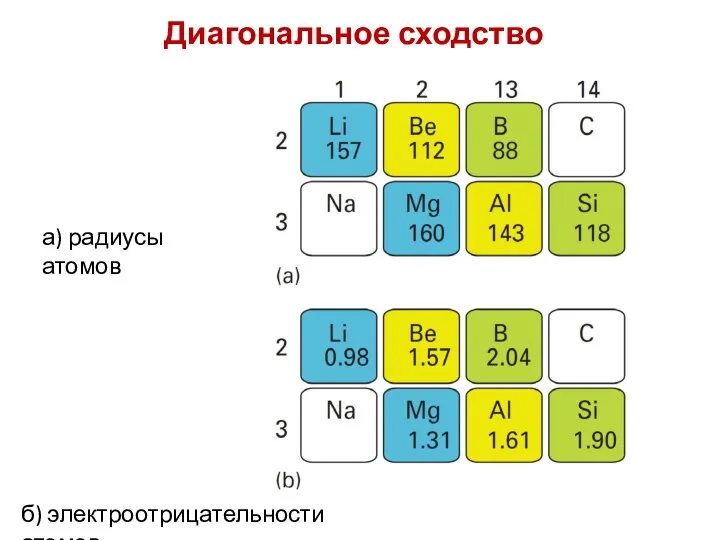
- 48. Диагональное сходство а) радиусы атомов б) электроотрицательности атомов
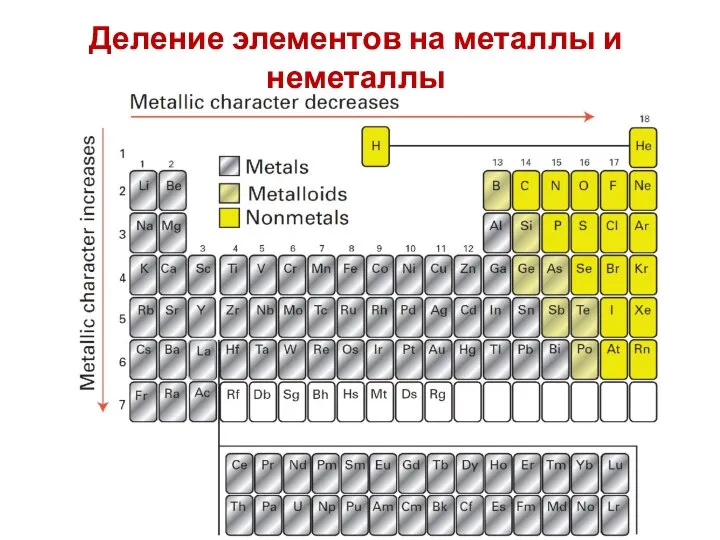
- 50. Деление элементов на металлы и неметаллы
- 53. Скачать презентацию

















![Электроотрицательность (ЭО или χ) [кДж/моль] или [эВ/атом] – характеризует способность атома](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/773910/slide-42.jpg)



 Общие свойства металлов. Сплавы
Общие свойства металлов. Сплавы Ионная химическая связь
Ионная химическая связь Вода и минеральные вещества. (Лекция 2)
Вода и минеральные вещества. (Лекция 2) Обмен нуклеопротеинов. (Лекция 17)
Обмен нуклеопротеинов. (Лекция 17) Структура периодической системы элементов
Структура периодической системы элементов ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ  Современные проблемы химической технологии керамики
Современные проблемы химической технологии керамики Формальдегід. Будова та шкідливість
Формальдегід. Будова та шкідливість Высокомолекулярные соединения и супрамолекулярные структуры. Синтез полимеров (Лекция 1)
Высокомолекулярные соединения и супрамолекулярные структуры. Синтез полимеров (Лекция 1) Титрування. Хімічний посуд в титриметричному аналізі
Титрування. Хімічний посуд в титриметричному аналізі Тема: «Вода – основа жизни на Земле»
Тема: «Вода – основа жизни на Земле»  Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Fuel cells
Fuel cells Экоаналитический контроль воздуха
Экоаналитический контроль воздуха Окислительно-востановительные реакции
Окислительно-востановительные реакции Анализ эфирного масла. Физические и химические показатели
Анализ эфирного масла. Физические и химические показатели Технологічні і біохімічні властивості м´яса і м´ясопродуктів. Лекція 11
Технологічні і біохімічні властивості м´яса і м´ясопродуктів. Лекція 11 Соли и реакции ионного обмена
Соли и реакции ионного обмена Основы молекулярной биологии
Основы молекулярной биологии Сірники Гончарук О. 10-Б
Сірники Гончарук О. 10-Б  Важнейшие бинарные соединения
Важнейшие бинарные соединения Предмет органической химии
Предмет органической химии Экспериментальные методы СВС-технологии. Микровидеосъемка
Экспериментальные методы СВС-технологии. Микровидеосъемка Биологиялық белсенді қосылыстардың иондалу және липофильділік мәселелері
Биологиялық белсенді қосылыстардың иондалу және липофильділік мәселелері Углерод. Кремний
Углерод. Кремний Коррозия металлов
Коррозия металлов Горение водорода
Горение водорода Элективный курс "Решение задач по химии повышенного уровня сложности"
Элективный курс "Решение задач по химии повышенного уровня сложности"