Содержание
- 2. Общие замечания ПГ – это молекулы, состоящие более чем из двух электроотрицательных атомов, которые в свободном
- 3. Условия отнесения вещества к псевдогалогенам или псевдогалогенидам ПГ должен быть летучим веществом, состоящем из симметричной комбинации
- 4. Условия отнесения вещества к псевдогалогенам или псевдогалогенидам радикалы ПГ должны образовывать соединения между собой X-X’ и
- 5. Азидоводород и азиды получение реакция амидов с оксидом азота (I) реакция амидов с нитратами окислением гидразина
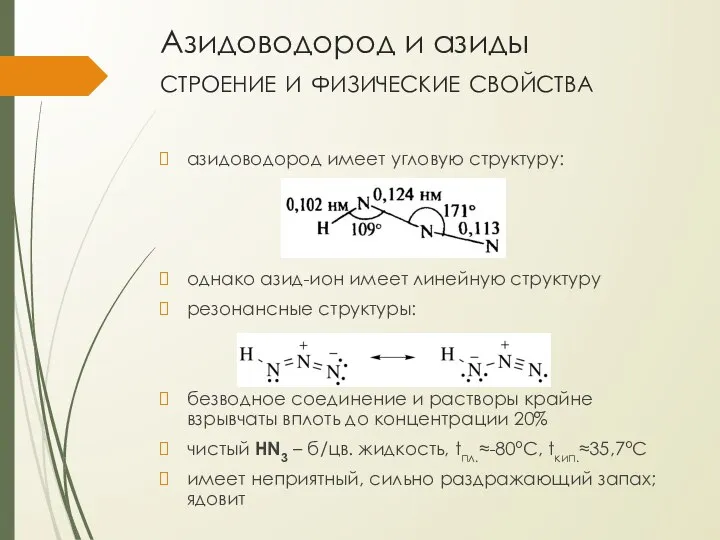
- 6. Азидоводород и азиды строение и физические свойства азидоводород имеет угловую структуру: однако азид-ион имеет линейную структуру
- 7. Азидоводород и азиды химические свойства азидоводородная кислота по силе сравнима с уксусной (pKa=4,64) через водородную связь
- 8. Азидоводород и азиды химические свойства азидоводородная кислота может проявлять как сильные окислительные: HN3 + 3H+ +
- 9. Азидоводород и азиды химические свойства азид-ион может быть лигандом в комплексных соединениях: [As(N3)6]- [Cu2(N3)6]2- [(PPh3)2Cu]2(μ-N3)2
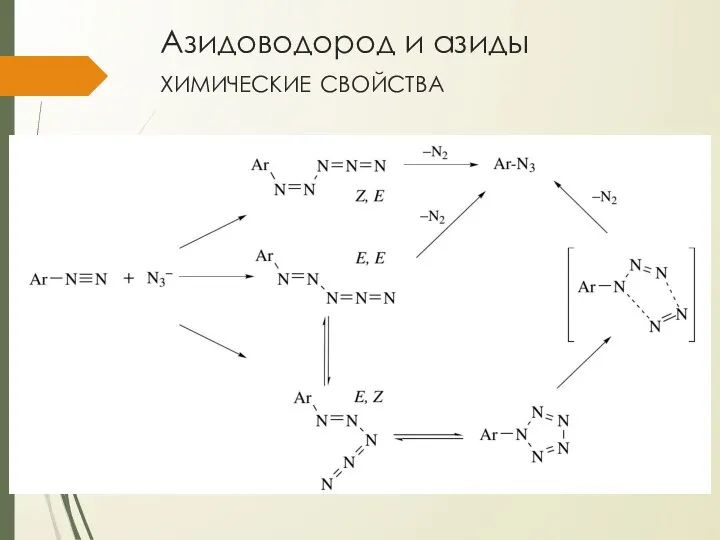
- 10. Азидоводород и азиды химические свойства ковалентные азиды могут быть получены при реакции азидов или азидоводородной кислоты
- 11. Азидоводород и азиды химические свойства
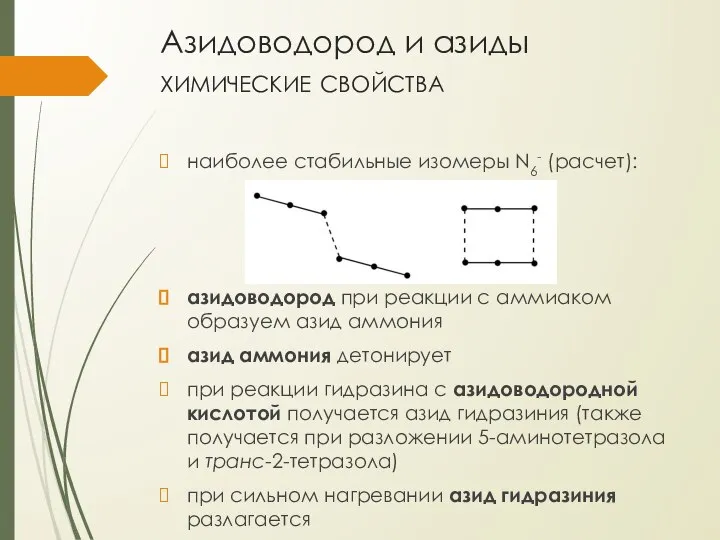
- 12. Азидоводород и азиды химические свойства наиболее стабильные изомеры N6- (расчет): азидоводород при реакции с аммиаком образуем
- 13. Дициан и цианиды получение дициан образуется при горении угля в электрической дуге в атмосфере азота …
- 14. Дициан и цианиды получение … при окислении циановодорода воздухом на серебряном катализаторе … при окислении циановодорода
- 15. Дициан и цианиды получение цианиды ЩМ можно получить при прокаливании амидов с углем … при разложении
- 16. Дициан и цианиды строение и физические свойства дициан имеет линейную структуру это бесцветный, горючий, токсичный газ
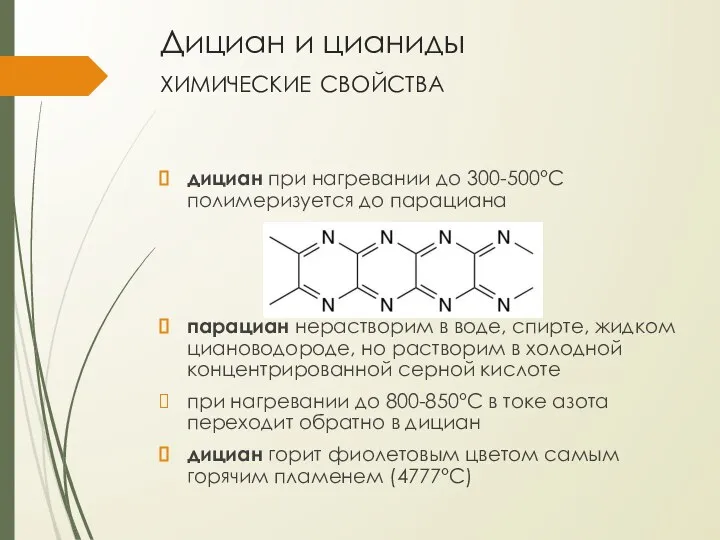
- 17. Дициан и цианиды химические свойства дициан при нагревании до 300-500°С полимеризуется до парациана парациан нерастворим в
- 18. Дициан и цианиды химические свойства дициан в щелочных растворах гидролизуется медленнее в нейтральных растворах при нагревании
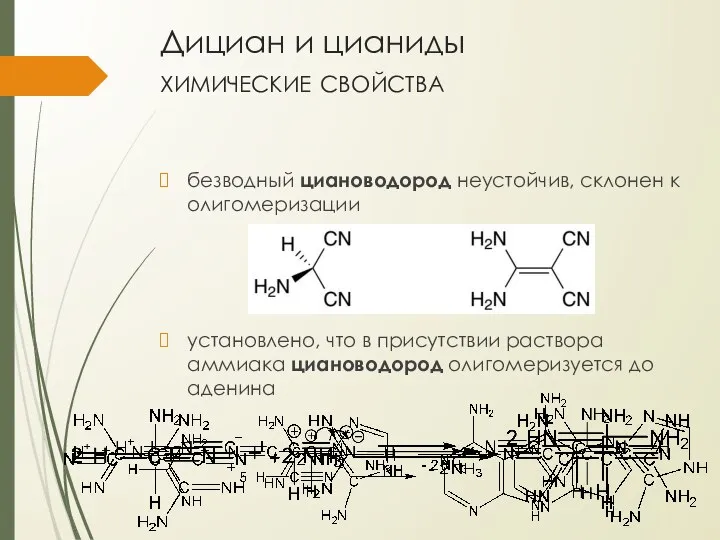
- 19. Дициан и цианиды химические свойства безводный циановодород неустойчив, склонен к олигомеризации установлено, что в присутствии раствора
- 20. Дициан и цианиды химические свойства циановодород и его производные реагируют с азидоводородом с образованием тетразола или
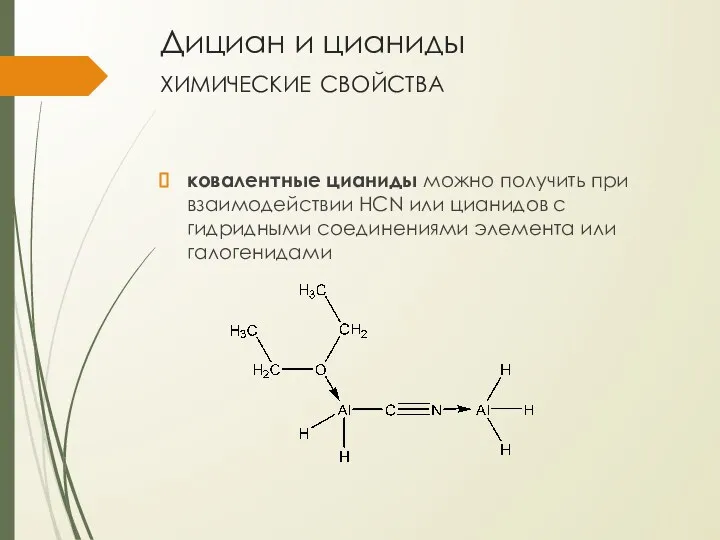
- 21. Дициан и цианиды химические свойства ковалентные цианиды можно получить при взаимодействии HCN или цианидов с гидридными
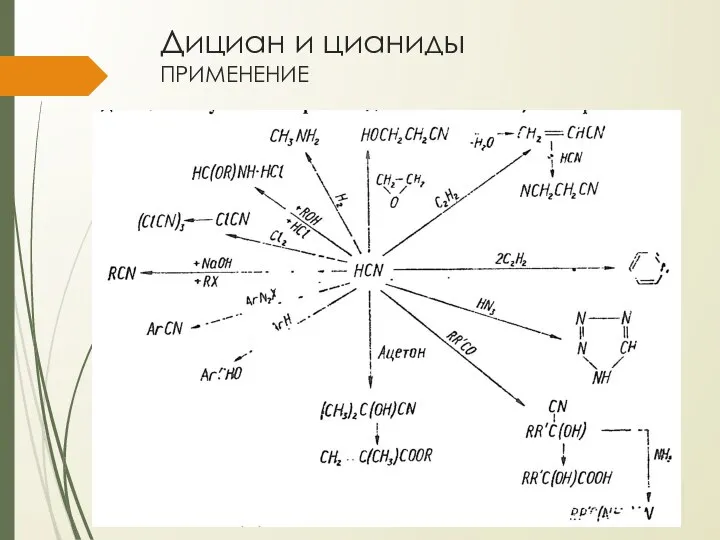
- 22. Дициан и цианиды применение
- 23. Дициан и цианиды химические свойства цианхлорид – токсичный газ – также получается при электролизе водного раствора
- 24. Диоксоциан, цианаты и их изомеры получение есть предположение, что диоксоциан может получаться при реакции AgOCN с
- 25. Диоксоциан, цианаты и их изомеры получение пиролизом циануровой кислоты, полученной при гидролизе цианурхлорида, получают цианатную кислоту
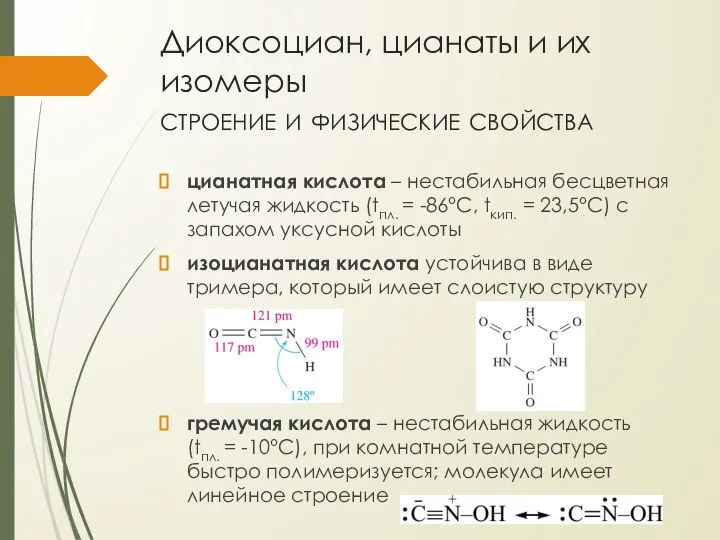
- 26. Диоксоциан, цианаты и их изомеры строение и физические свойства цианатная кислота – нестабильная бесцветная летучая жидкость
- 27. Диоксоциан, цианаты и их изомеры химические свойства цианатная кислота – слабая кислота (pKa = 3,92) в
- 28. Диоксоциан, цианаты и их изомеры химические свойства гремучая кислота примерно в пять раз сильнее азидоводородной при
- 29. Дитиоциан и тиоцианаты получение дитиоциан получается при бромировании тиоцианата металла в апротонном растворителе, … … при
- 30. Дитиоциан и тиоцианаты строение и физические свойства дитиоциан имеет температуру плавления -3°С его молекула имеет угловую
- 31. Дитиоциан и тиоцианаты химические свойства дитиоциан неустойчив и быстро полимеризуется до оранжевого (SCN)n в водном растворе
- 32. Дитиоциан и тиоцианаты химические свойства родановодородная кислота легко окисляется она и ее соли не токсичны, содержатся
- 33. Диселеноциан и селеноцианаты получение диселеноциан получается при действии эфирного раствора иода на селеноцианат серебра, … при
- 34. Диселеноциан и селеноцианаты строение и физические свойства диселеноциан имеет линейную структуру желтый порошок, хорошо растворимый в
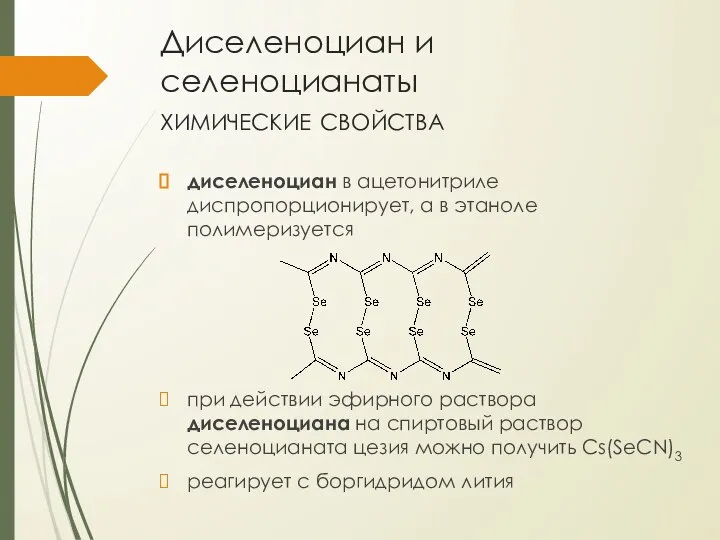
- 35. Диселеноциан и селеноцианаты химические свойства диселеноциан в ацетонитриле диспропорционирует, а в этаноле полимеризуется при действии эфирного
- 37. Скачать презентацию






![Азидоводород и азиды химические свойства азид-ион может быть лигандом в комплексных соединениях: [As(N3)6]- [Cu2(N3)6]2- [(PPh3)2Cu]2(μ-N3)2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1336054/slide-8.jpg)


















 Химическая кинетика
Химическая кинетика Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина друга)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина друга) Неметаллы
Неметаллы Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Концепция метанольной экономики
Концепция метанольной экономики I закон термодинамики, его применение для расчёта тепловых эффектов
I закон термодинамики, его применение для расчёта тепловых эффектов Ковалентная связь. Радикалы
Ковалентная связь. Радикалы Жидкостная хроматография
Жидкостная хроматография Количество вещества, моль, молярная масса, молярный объем
Количество вещества, моль, молярная масса, молярный объем Химический элемент натрий
Химический элемент натрий Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..
Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..  Основы гетерогенного катализа и производство катализаторов
Основы гетерогенного катализа и производство катализаторов Повторение по химии (8 класс)
Повторение по химии (8 класс) Линии и точки диаграммы Fe-Fe3С. Сплавы железа с углеродом. Углеродистые стали, их характеристики и маркировка. (Лекция 4)
Линии и точки диаграммы Fe-Fe3С. Сплавы железа с углеродом. Углеродистые стали, их характеристики и маркировка. (Лекция 4) АБС-пластик. Свойства
АБС-пластик. Свойства Презентация по химии Угарный газ
Презентация по химии Угарный газ  Биологическая эффективность гербицида Miuris 125 в борьбе с однодольными сорными растениями в посевах сой
Биологическая эффективность гербицида Miuris 125 в борьбе с однодольными сорными растениями в посевах сой Аминокислоты. Белки
Аминокислоты. Белки Презентация по химии Удобрения и их классификация
Презентация по химии Удобрения и их классификация Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Техника безопасности на уроках химии
Техника безопасности на уроках химии Гибридизация атома углерода
Гибридизация атома углерода Шестая группа элементов
Шестая группа элементов Требования к осадителю
Требования к осадителю Одноатомные спирты. Химические свойства
Одноатомные спирты. Химические свойства «Химия и повседневная жизнь человека» Программа элективного курса для 9-го класса МОУ СОШ с. Георгиевка Чупра Н.Б. учител
«Химия и повседневная жизнь человека» Программа элективного курса для 9-го класса МОУ СОШ с. Георгиевка Чупра Н.Б. учител Презентация Дисперсные системы
Презентация Дисперсные системы