Содержание
- 2. 1 21.09.2016 Теория химического строения органических соединений Урок 9 класса. Реакции ионного обмена
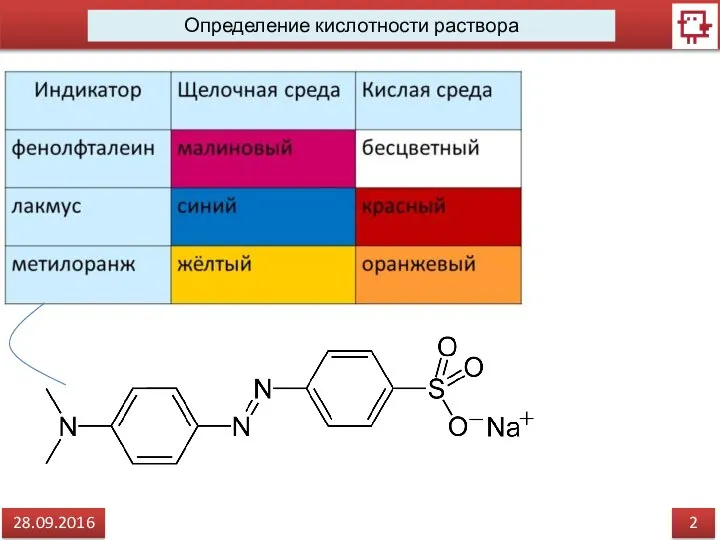
- 3. 2 28.09.2016 Определение кислотности раствора
- 4. 3 28.09.2016 Определение галогенид-ионов Галогенид-ионы определяются при взаимодействиями с солями серебра: AgNO3 + KCl = KNO3
- 5. 4 28.09.2016 Определение галогенид-ионов Качественная реакция на соли меди: Cu2+ +2OH— → Cu(OH)2↓ Качественные реакции на
- 6. 5 28.09.2016 Барий и сульфат-ион Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария;
- 7. 6 28.09.2016 Алюминий, цинк, фосфат-ион Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓ избыток
- 8. 9 28.09.2016 Цвет пламени Многие щелочные и щелочно-земельные металлы не имеют нерастворимых солей. Поэтому их определяют
- 10. Скачать презентацию






 Роль нафти у сучасному світі Підготував учень 11 класу Войтюк Дмитро
Роль нафти у сучасному світі Підготував учень 11 класу Войтюк Дмитро  Багатоатомні спирти
Багатоатомні спирти  Бериллий, магний, щелочноземельные металлы
Бериллий, магний, щелочноземельные металлы Обучающий тест «Виды химической связи»
Обучающий тест «Виды химической связи» Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей
Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей Строение, свойства и функции аминокислот и белков
Строение, свойства и функции аминокислот и белков Комплексные соединения. Химическая связь. (Лекция 9)
Комплексные соединения. Химическая связь. (Лекция 9) Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері
Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері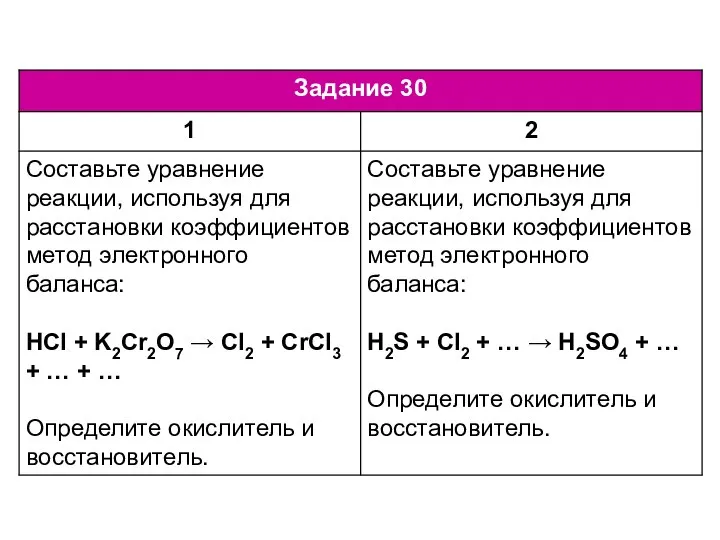 ЕГЭ по химии. Задание 30-34
ЕГЭ по химии. Задание 30-34 Алканы: гомологический ряд, номенклатура и изомерия
Алканы: гомологический ряд, номенклатура и изомерия Производство шампуня. Технология
Производство шампуня. Технология Тема урока: Химические свойства алкенов. Получение.
Тема урока: Химические свойства алкенов. Получение. Гидролиз солей
Гидролиз солей Аттестационная работа. Проектно-исследовательская деятельность учащихся на уроках химии и во внеурочной работе
Аттестационная работа. Проектно-исследовательская деятельность учащихся на уроках химии и во внеурочной работе Галогены
Галогены Полисилоксаны. Классификация полимеров
Полисилоксаны. Классификация полимеров Элементы подгруппы углерода
Элементы подгруппы углерода Производные пурина
Производные пурина Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния Анализ карбоновых кислот и их производных
Анализ карбоновых кислот и их производных Биологиялық қауіп: экопатогендер, қауіпті биологиялық агенттер, биорегуляторлар. Табиғи токсиндер
Биологиялық қауіп: экопатогендер, қауіпті биологиялық агенттер, биорегуляторлар. Табиғи токсиндер Шоу «Юный химик»
Шоу «Юный химик» Нефть — это жидкое горючее полезное ископаемое
Нефть — это жидкое горючее полезное ископаемое Первый закон термодинамики. Термохимия
Первый закон термодинамики. Термохимия Великие иконописцы XIV-XV веков
Великие иконописцы XIV-XV веков Системи удобрення сільськогосподарських культур
Системи удобрення сільськогосподарських культур Хлор. Отравления хлором
Хлор. Отравления хлором