Содержание
- 2. Элементы IIA группы Be Mg Ca Sr Ba Ra Щелочноземельные металлы Ra ― радиоактивный элемент Радий-226
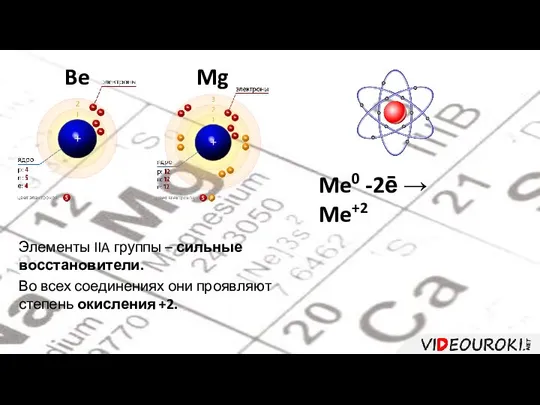
- 3. Be Mg Me0 -2ē → Me+2 Элементы IIA группы – сильные восстановители. Во всех соединениях они
- 4. Be Mg В группе сверху вниз: 1. Увеличивается радиус атомов. 2. Увеличиваются металлические свойства. 3. Увеличиваются
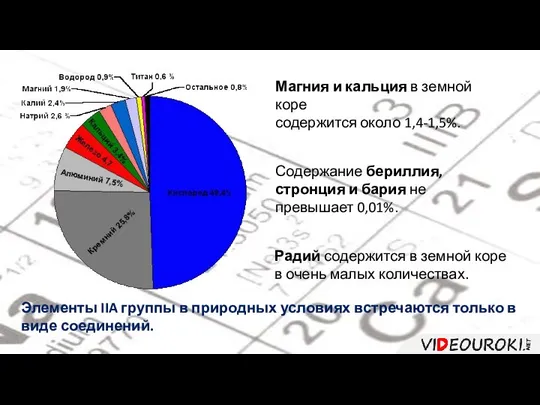
- 5. Магния и кальция в земной коре содержится около 1,4-1,5%. Содержание бериллия, стронция и бария не превышает
- 6. Физические свойства: Это типичные металлы с характерным металлическим блеском. Представляют собой серебристо-белые металлы, а стронций имеет
- 7. Элементы IIA группы являются лёгкими.
- 8. Получение: MgCl2 = Mg + Cl2↑ CaCl2 = Ca + Cl2↑ Электролиз расплавов
- 9. Химические свойства Be Mg + O2 = Только при нагревании 2Ca + O2 = 2CaO 0
- 10. Реакции с азотом Химические свойства Ra реагирует с азотом при комнатной температуре. 3Ba + N2 =
- 11. Реакции с галогенами Химические свойства 0 0 +2 -1 хлорид кальция Ca + Cl2 = CaCl2
- 12. Реакции с серой Химические свойства 0 0 +2 -2 сульфид магния 0 0 +2 -1 гидрид
- 13. Реакции с водой Химические свойства Mg + 2H2O = Mg(OH)2 + H2↑ Ca + 2H2O =
- 14. Реакции с кислотами Химические свойства сульфат кальция хлорид магния Mg + HF ≠ Be + HNO3
- 15. Реакции с щелочами Химические свойства Бериллий проявляет амфотерные свойства Be + 2NaOH + 2H2O = Na2[Be(OH)4]
- 16. Восстановление металлов из их оксидов Химические свойства Магниетермия 2Mg + TiO2 = 2MgO + Ti Кальциетермия
- 17. Реакции с растворами солей Химические свойства Mg + FeSO4 = MgSO4 + Fe
- 18. Нахождение в природе В природе щелочноземельные металлы находятся только в виде соединений. Оксиды имеют состав MeO
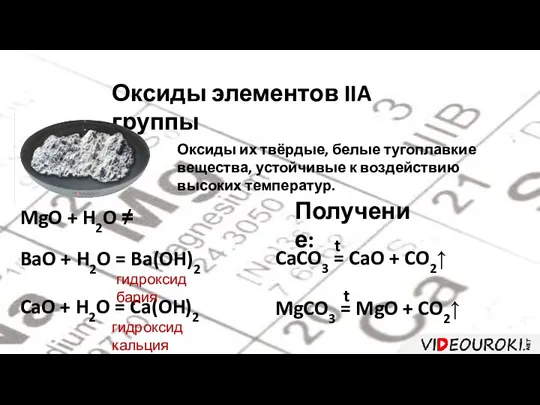
- 19. Оксиды элементов IIA группы Оксиды их твёрдые, белые тугоплавкие вещества, устойчивые к воздействию высоких температур. MgO
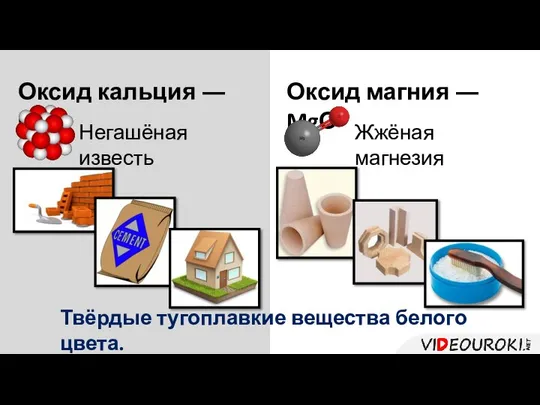
- 20. Оксид кальция ― СаО Оксид магния ― MgО Негашёная известь Жжёная магнезия Твёрдые тугоплавкие вещества белого
- 21. Реакции с кислотами Химические свойства оксидов Реакции со щелочами MgO + 2HCl = MgCl2 + H2O
- 22. Получение гидроксидов Ca(OH)2 → Sr(OH)2 → Ba(OH)2 Растворимость увеличивается CaO + H2O = Ca(OH)2 SrO +
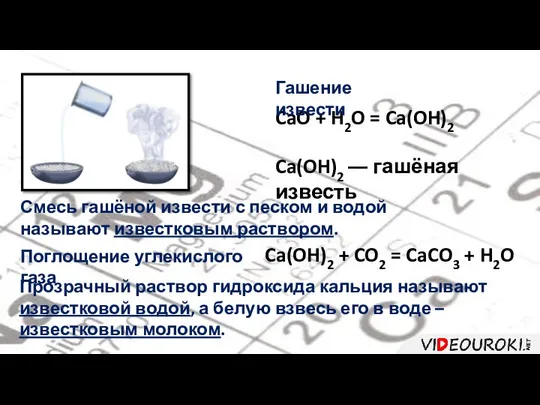
- 23. CaO + H2O = Ca(OH)2 Гашение извести Ca(OH)2 ― гашёная известь Смесь гашёной извести с песком
- 24. Известковое молоко Гашёная известь
- 25. CaO + H2O = Ca(OH)2
- 27. Ca(OH)2 + CO2 = CaCO3↓ + H2O
- 29. Химические свойства гидроксидов Реакции с кислотами Реакции с основаниями Ba(OH)2 + 2HCl = BaCl2 + 2H2O
- 30. Соли бериллия, магния и щелочноземельных металлов представляют собой белые кристаллические вещества, большинство из них растворимы в
- 32. CaCO3 – карбонат кальция Мел, мрамор, известняк.
- 36. Известняк является прекрасным строительным материалом. Известняк используется как сырьё для получения многих материалов: цемента, гашёной и
- 37. Карбонат магния – MgCO3
- 38. Сульфат кальция – CaSO4 Гипс – CaSO4 · 2H2O Алебастр – 2CaSO4 · H2O 2CaSO4 ·
- 39. Кристаллогидрат сульфата магния, горькая, или английская соль.
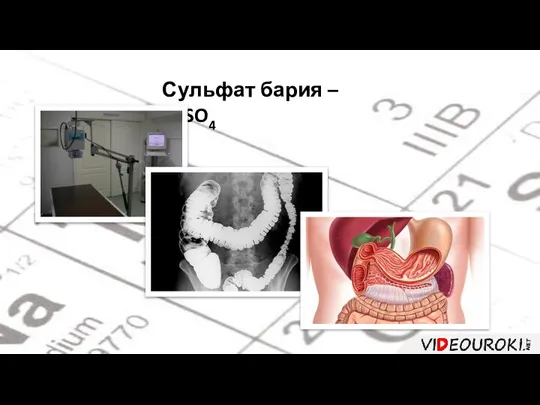
- 40. Сульфат бария – BaSO4
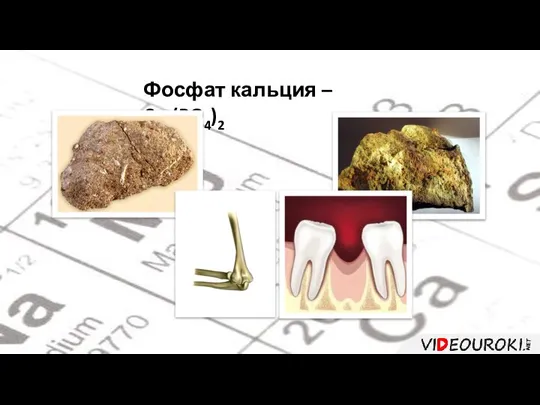
- 41. Фосфат кальция – Ca3(PO4)2
- 42. В организме человека содержится около 1 кг кальция в виде фосфата кальция. Из кальция построен костный
- 43. Человек должен получать в день 1,5 г кальция.
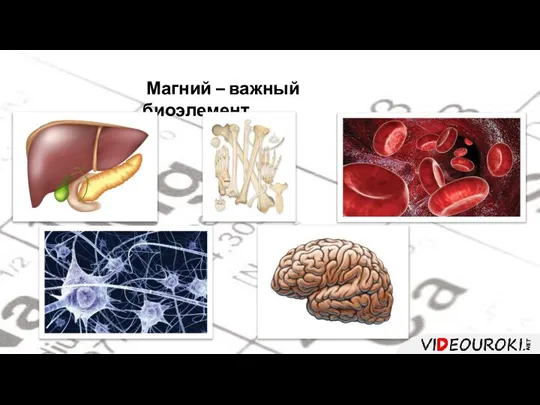
- 44. Магний – важный биоэлемент.
- 45. В организме человека содержится около 40 г магния. Магний входит в состав хлорофилла, поэтому участвует в
- 46. Окраска пламени солями щелочноземельных металлов Ca Sr Ba
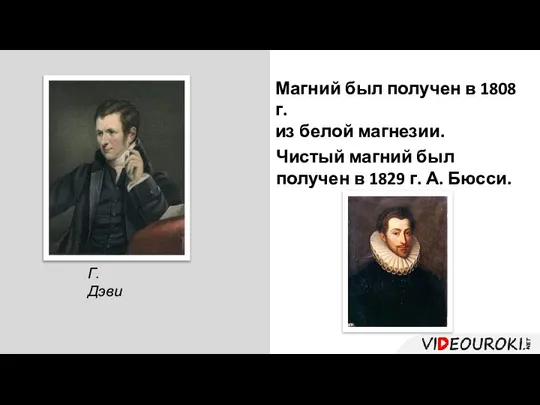
- 47. Г. Дэви Магний был получен в 1808 г. из белой магнезии. Чистый магний был получен в
- 48. Г. Дэви Кальций впервые был получен в 1808 г. Название было дано от латинского слова кальс,
- 49. Элементы IIA группы имеют на внешнем энергетическом уровне два электрона. Они являются восстановителями. В соединениях они
- 50. Для них характерны такие физические свойства, как металлический блеск, тепло- и электропроводность, они лёгкие, температуры плавления
- 52. Скачать презентацию








































 Лимонная кислота
Лимонная кислота Державна система забезпечення якості лікарських засобів в Україні
Державна система забезпечення якості лікарських засобів в Україні Хімічні явища в побуті
Хімічні явища в побуті Carbohydrate metabolism
Carbohydrate metabolism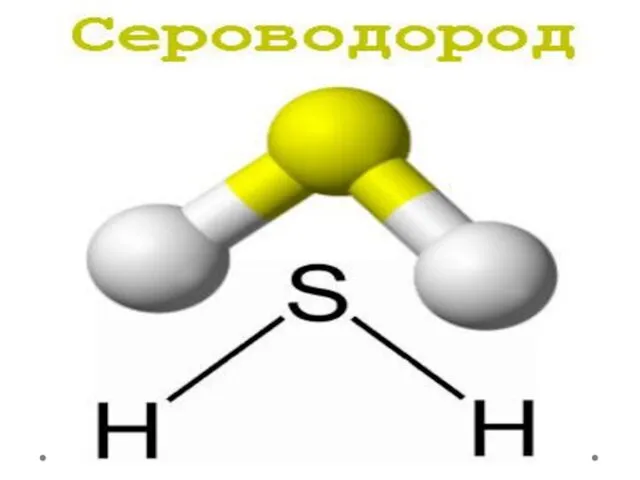 Сероводород. Физические и химические свойства
Сероводород. Физические и химические свойства Гірські породи
Гірські породи Сахароза
Сахароза Презентация Характеристика щелочных металлов 9 класс
Презентация Характеристика щелочных металлов 9 класс  Химическая очистка воды
Химическая очистка воды Органическая химия
Органическая химия Щелочноземельные металлы
Щелочноземельные металлы Метаболизм источников энергии
Метаболизм источников энергии Основы кристаллического строения. Лекция 1
Основы кристаллического строения. Лекция 1 Промышленная очистка воды
Промышленная очистка воды Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Степень окисления Автор презентации: учитель химии МОУ лицея «Технический» г. Обнинска Калужской области Яснова Юлия Анатоль
Степень окисления Автор презентации: учитель химии МОУ лицея «Технический» г. Обнинска Калужской области Яснова Юлия Анатоль General, specific properties are common to all matters
General, specific properties are common to all matters Урок химии в 8 классе Козлова Валентина Васильевна НОУ СОШ №50 ОАО «РЖД» пгт Ерофей Павлович Сковородинский район
Урок химии в 8 классе Козлова Валентина Васильевна НОУ СОШ №50 ОАО «РЖД» пгт Ерофей Павлович Сковородинский район  Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность
Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность Химический КВН
Химический КВН Презентация по Химии "Белирий, магний и щелочноземельные металлы" - скачать смотреть
Презентация по Химии "Белирий, магний и щелочноземельные металлы" - скачать смотреть  Электропроводность растворов электролитов. Числа переноса
Электропроводность растворов электролитов. Числа переноса Vocabulary Game
Vocabulary Game ЕГЭ по Химии. Задание №7
ЕГЭ по Химии. Задание №7 Презентация по Химии "Химия вокруг нас" - скачать смотреть
Презентация по Химии "Химия вокруг нас" - скачать смотреть  Термический анализ
Термический анализ Резина и каучук
Резина и каучук Нитраттарды қолдану
Нитраттарды қолдану