Содержание
- 2. образование малорастворимых веществ (осадки ↓) 2) образование газообразных или летучих веществ (↑) 3) образование малодиссоциирующих веществ
- 3. Реакции с образованием малорастворимых веществ, выпадающих в осадок молекулярное уравнение: AgNO3 + HCl → AgCl↓ +
- 4. 2. Реакции, протекающие с образованием газообразных или летучих веществ молекулярное уравнение: Na2CO3 + 2HCl → 2NaCl
- 5. Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих
- 6. Диссоциация воды. Водородный показатель Водородный показатель рН - это отрицательный десятичный логарифм концентрации ионов водорода Н+
- 7. Если [Н+] = 10-7 моль/л , то рН = - lg 10-7 = 7 среда раствора
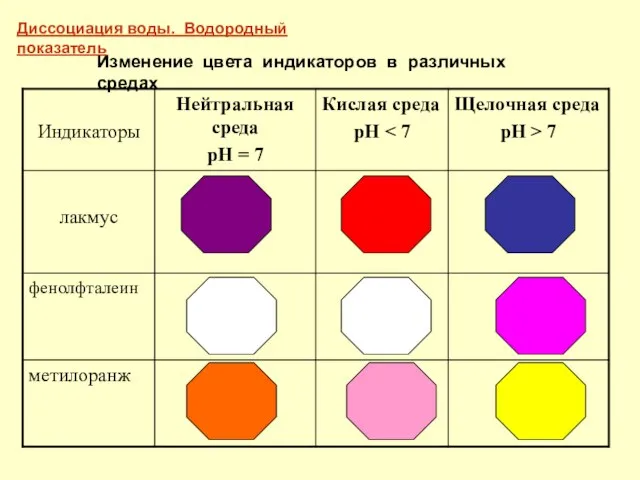
- 8. Изменение цвета индикаторов в различных средах Диссоциация воды. Водородный показатель
- 9. Источники информации: http://slovari.yandex.ru/ http://www.lyceum8.ru/himiya/4.htm http://900igr.net/fotografii/khimija/Dissotsiatsija/010-Mekhanizm-dissotsiatsii-veschestv.html http://him.1september.ru/2003/34/7.htm http://900igr.net/kartinki/khimija/Povarennaja-sol/059-K-r-i-s-t-a-l-l-y-g-a-l-i-t-a.html
- 11. Скачать презентацию





![Если [Н+] = 10-7 моль/л , то рН = - lg](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/602183/slide-6.jpg)

 Кислоты
Кислоты Химический анализ веществ
Химический анализ веществ Кислоты. Физические свойства кислот
Кислоты. Физические свойства кислот Биохимия центральной нервной системы
Биохимия центральной нервной системы Карбоновые кислоты
Карбоновые кислоты Предмет физической и коллоидной химии. Термодинамика
Предмет физической и коллоидной химии. Термодинамика Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности  Химическая термодинамика и биоэнергетика. Второй закон термодинамики
Химическая термодинамика и биоэнергетика. Второй закон термодинамики Ацетилен
Ацетилен Диены. Тест. Учитель: Антонова Е.Л. Учитель: Антонова Е.Л.
Диены. Тест. Учитель: Антонова Е.Л. Учитель: Антонова Е.Л. Химические реакции органических соединений
Химические реакции органических соединений Агрегатные состояния вещества
Агрегатные состояния вещества Металдардың физикалық қасиеттерін ажырата білу
Металдардың физикалық қасиеттерін ажырата білу Хімія у нашому житті вода
Хімія у нашому житті вода  Огнеупорные материалы
Огнеупорные материалы Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской облас
Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской облас Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7
Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7 Link reaction
Link reaction Химические соединения растительного и животного мира - углеводы
Химические соединения растительного и животного мира - углеводы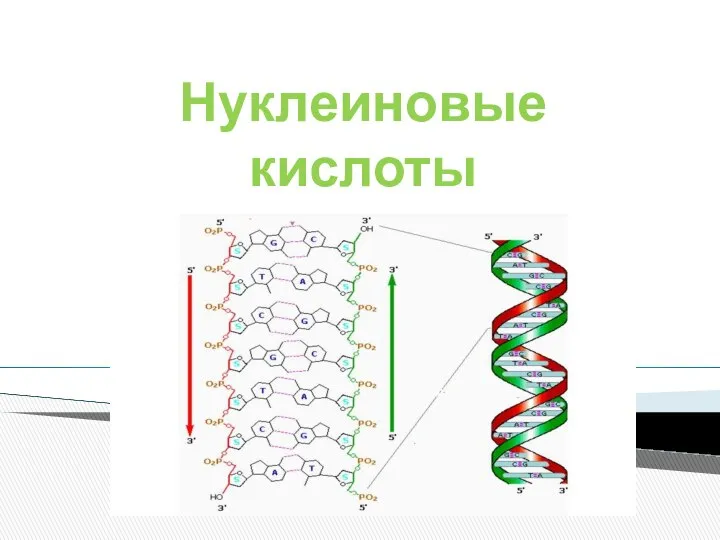 Нуклеиновые кислоты
Нуклеиновые кислоты КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ
КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ  Спазган: применение, форма, свойства, состав
Спазган: применение, форма, свойства, состав Презентация по Химии "Игра 9 класс. Знаешь ли ты классы неорганических веществ?" - скачать смотреть
Презентация по Химии "Игра 9 класс. Знаешь ли ты классы неорганических веществ?" - скачать смотреть  Полівінілхлорид
Полівінілхлорид Минерал гранат
Минерал гранат Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Углерод и его соединения
Углерод и его соединения Реакции ионного обмена
Реакции ионного обмена