Содержание
- 2. Регуляция каталитической активности фермента осуществляется: 1) присоединением эффекторных молекул (активаторы и ингибиторы); 2) регуляция с помощью
- 3. Активаторы ферментов – это вещества: 1) формирующие активный центр фермента (Со2+, Mg2+ Zn2+ Fe2+, Са2+); 2)
- 4. Активируют ферментативные реакции обычно катионы (в таблице Менделеева с 19 по 30). Анионы менее активны, хотя
- 5. Ингибиторы ферментов — это соединения, которые взаимодействуя с ферментом, препятствуют образованию нормального фермент-субстратного комплекса, уменьшая тем
- 6. Ингибиторы делят на две группы — неспецифические и специфические. Неспецифические ингибиторы вызывают денатурацию белка-фермента (соли тяжелых
- 7. При необратимом ингибировании происходит непрерывная модификация молекул фермента, в результате чего фермент частично или полностью теряет
- 8. 1. Ингибиторы металлосодержащих ферментов (HCN, RCN, HF, СО и др.). Эти соединения связываются с металлами с
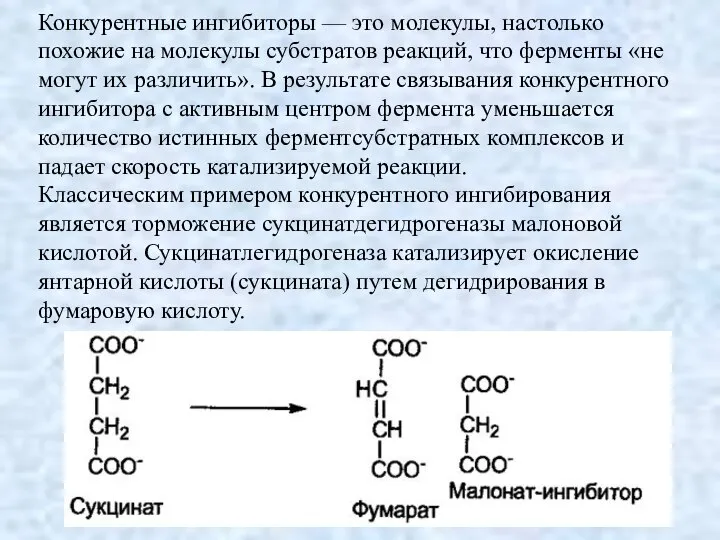
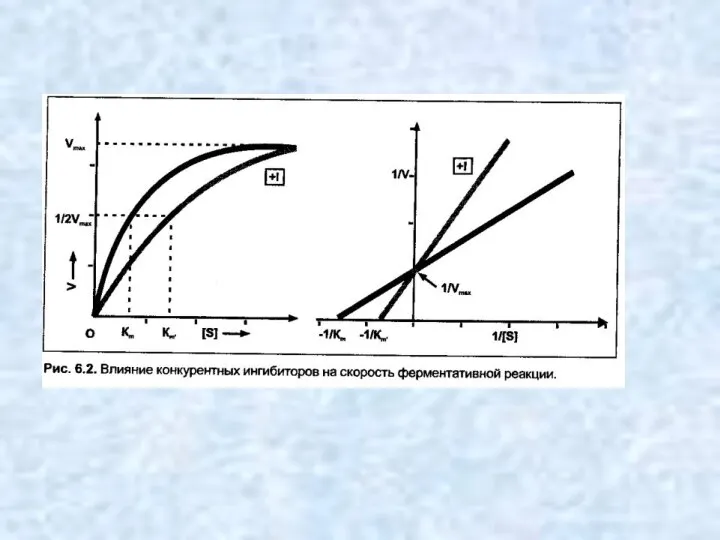
- 9. Конкурентные ингибиторы — это молекулы, настолько похожие на молекулы субстратов реакций, что ферменты «не могут их
- 11. Неконкурентные ингибиторы — вещества, не имеющие структурного сходства с субстратами. Неконкурентные ингибиторы связываются не с активным
- 13. Аллостерическая регуляция Происходит путем присоединения к аллостерическому центру фермента эффекторов — активаторов и ингибиторов. Если в
- 14. 1. Аллостерические ферменты состоят из 2-х или более, часто симметричных, субъединиц, т. е. имеют четвертичную структуру.
- 15. Предложено 2 модели кооперативного эффекта. Симметричная модель: субъединицы должны находиться в одном и том же конформационном
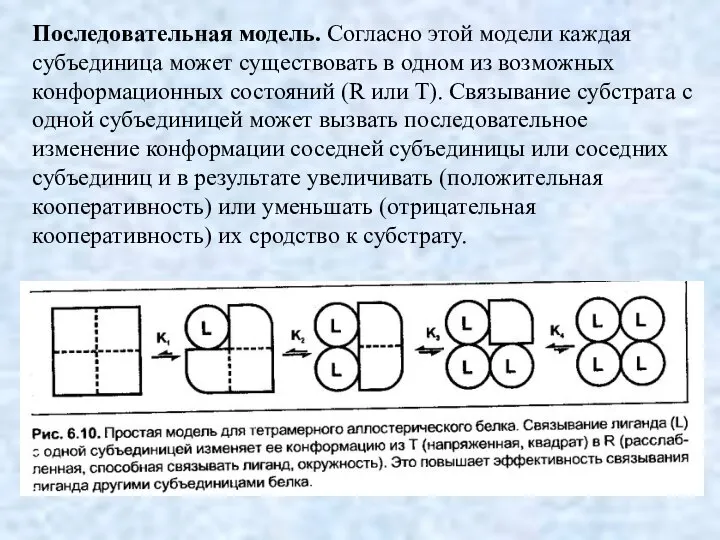
- 16. Последовательная модель. Согласно этой модели каждая субъединица может существовать в одном из возможных конформационных состояний (R
- 17. Регуляция активности по принципу обратной связи (ретроингибирование) Во многих биосинтетических процессах основным типом регуляции скорости многоступенчатого
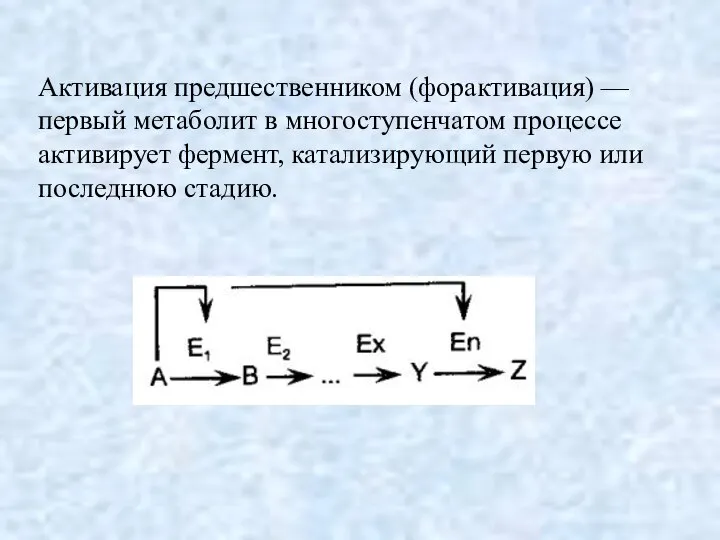
- 18. Активация предшественником (форактивация) — первый метаболит в многоступенчатом процессе активирует фермент, катализирующий первую или последнюю стадию.
- 19. Химическая (ковалентная) модификация. Заключается в присоединении к ферменту или отщеплении от него низкомолекулярной молекулы, при котором
- 20. Фосфорилирование-дефосфорилирование является наиболее эффективным способом контроля активности белков по следующим причинам: 1. Фосфорильныс группы приносят два
- 21. 4. Фосфорилирование-дефосфорилирование занимает примерно секунду, что по скорости увязывается с физиологическими процессами. 5. Фосфорилирование носит, как
- 23. Активация проферментов. Происходит путем отщепления части полипептидной цепи от молекулы предшественника с образованием активного центра фермента.
- 24. Специфический частичный протеолиз является распростра-ненным способом активации ферментов и других белков в биологических системах. 1. Свертывание
- 26. Скачать презентацию



















 Ионная химическая связь
Ионная химическая связь Ароматические углеводороды
Ароматические углеводороды Комплексные соединения
Комплексные соединения Контроль в процессе обучения химии на старшей ступени школы
Контроль в процессе обучения химии на старшей ступени школы Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Урок по химии в 10 классе по теме Каучуки
Урок по химии в 10 классе по теме Каучуки Углеводы. Глюкоза
Углеводы. Глюкоза Алюминий и его свойства
Алюминий и его свойства Массовая и объемная доля компонентов смеси
Массовая и объемная доля компонентов смеси Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Гликозилирование, эффективная синтетическая стратегия для повышения биодоступности терапевтических пептидов
Гликозилирование, эффективная синтетическая стратегия для повышения биодоступности терапевтических пептидов Интересные факты о нефти
Интересные факты о нефти Фармацевтические суспензии и эмульсии
Фармацевтические суспензии и эмульсии Бальзам-ополаскиватель для волос
Бальзам-ополаскиватель для волос Углеводы. Структура
Углеводы. Структура Внеурочная работа по химии. Краеведение
Внеурочная работа по химии. Краеведение Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Решение задач на вывод формул органических веществ относительно плотности
Решение задач на вывод формул органических веществ относительно плотности Обмен белков - 1
Обмен белков - 1 Мембранные липиды: строение и функции
Мембранные липиды: строение и функции Cтроение и спектры молекул
Cтроение и спектры молекул L’introduction a la biochimie. La structure et les proprietes des proteines
L’introduction a la biochimie. La structure et les proprietes des proteines Углерод. Нахождение в природе
Углерод. Нахождение в природе Интернет-тренажеры
Интернет-тренажеры Исследование химических моделей (11 класс)
Исследование химических моделей (11 класс) Окислительные методы получения органических соединений
Окислительные методы получения органических соединений Презентация по Химии "Вода - найдивовижніша речовина в світі" - скачать смотреть бесплатно
Презентация по Химии "Вода - найдивовижніша речовина в світі" - скачать смотреть бесплатно Фотосинтез. Суммарное уравнение, общий вид
Фотосинтез. Суммарное уравнение, общий вид