Содержание
- 2. Вид завода в Оппау после взрыва №1 2H2 + N2 + 1,5 O2 = NH4NO3 №2
- 3. Объект изучения термодинамики – термодинамические системы Системы бывают: открытые, закрытые и изолированные; гомогенные и гетерогенные простые
- 4. Параметры химической термодинамики U - внутренняя энергия Н - энтальпия S - энтропия G - энергия
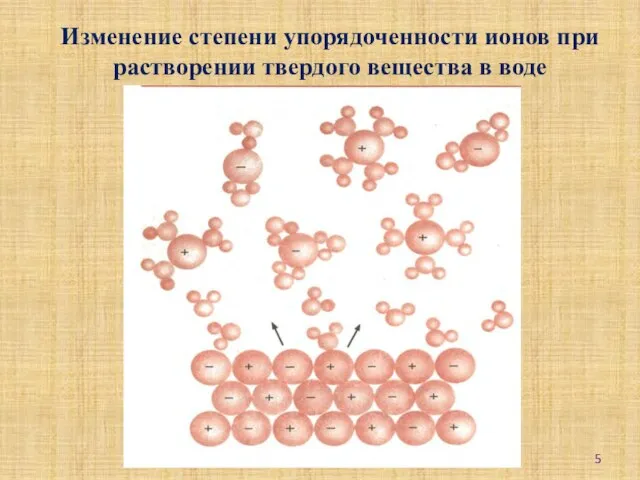
- 5. Изменение степени упорядоченности ионов при растворении твердого вещества в воде
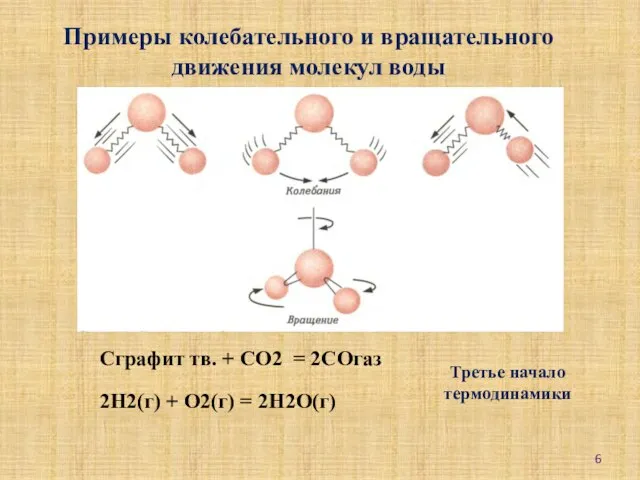
- 6. Примеры колебательного и вращательного движения молекул воды Сграфит тв. + СО2 = 2СОгаз 2Н2(г) + О2(г)
- 7. Второй закон термодинамики Все процессы в изолированной системе происходят в направлении увеличения энтропии Энтропия химической реакции
- 8. Возможность и направление протекания химических реакций Энтропийный и энтальпийный факторы обычно действуют в противоположных направлениях и
- 9. Термохимические расчеты Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑ Энтальпию образования глюкозы нельзя
- 10. Задача 2. Вычислите энергию Гиббса и определите возможность протекания реакции при температурах 1000 и 3000 К.
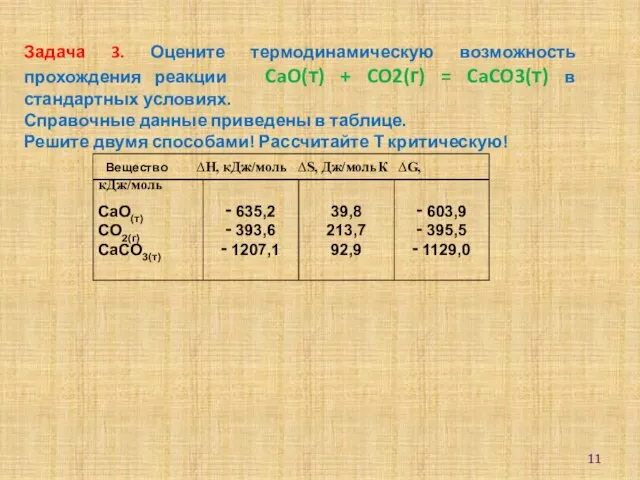
- 11. Задача 3. Оцените термодинамическую возможность прохождения реакции CaO(т) + CO2(г) = CaCO3(т) в стандартных условиях. Справочные
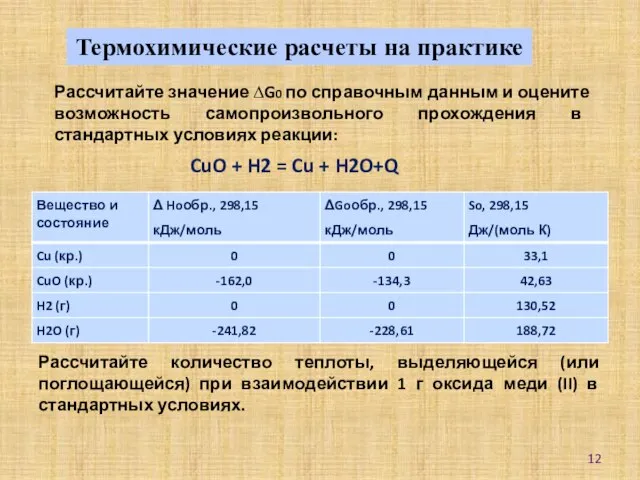
- 12. CuO + H2 = Cu + H2O+Q Термохимические расчеты на практике Рассчитайте значение ∆G0 по справочным
- 13. Домашнее задание 1. Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. М.: Высш. шк. Издательский
- 15. Скачать презентацию








 Антибиотики-аминогликозиды: получение, свойства, исследование и применение. Связь между химическим строением и действием
Антибиотики-аминогликозиды: получение, свойства, исследование и применение. Связь между химическим строением и действием Геологические структуры МПИ. Группа доминерализационных структур
Геологические структуры МПИ. Группа доминерализационных структур История получения алюминия. Применение
История получения алюминия. Применение Определение активности ферментов
Определение активности ферментов Ионно-координационная полимеризация
Ионно-координационная полимеризация Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Металдар мен бейметалдардың табиғатта таралуы. ҚР-дағы кен орындары
Металдар мен бейметалдардың табиғатта таралуы. ҚР-дағы кен орындары Материалы с особыми тепловыми свойствами
Материалы с особыми тепловыми свойствами Углеводороды: номенклатура
Углеводороды: номенклатура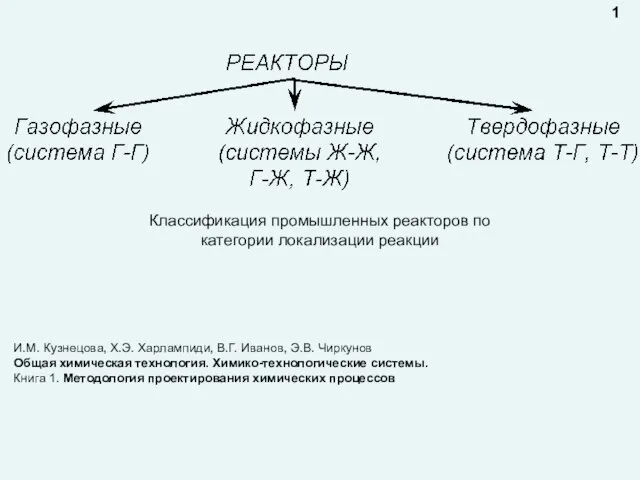 Презентация лекция конструкция реактора 1
Презентация лекция конструкция реактора 1 Фосфор, фосфор оксидтері
Фосфор, фосфор оксидтері Побутові хімікати Підготувала Нечай Катерина, учениця 41 групи
Побутові хімікати Підготувала Нечай Катерина, учениця 41 групи  Природные источники углеводородов
Природные источники углеводородов Презентация по Химии "«Таблица Менделеева внутри нас»" - скачать смотреть _
Презентация по Химии "«Таблица Менделеева внутри нас»" - скачать смотреть _ Анализ ассортимента и экспертиза качества одноразовой посуды из полимерных и комбинированных материалов
Анализ ассортимента и экспертиза качества одноразовой посуды из полимерных и комбинированных материалов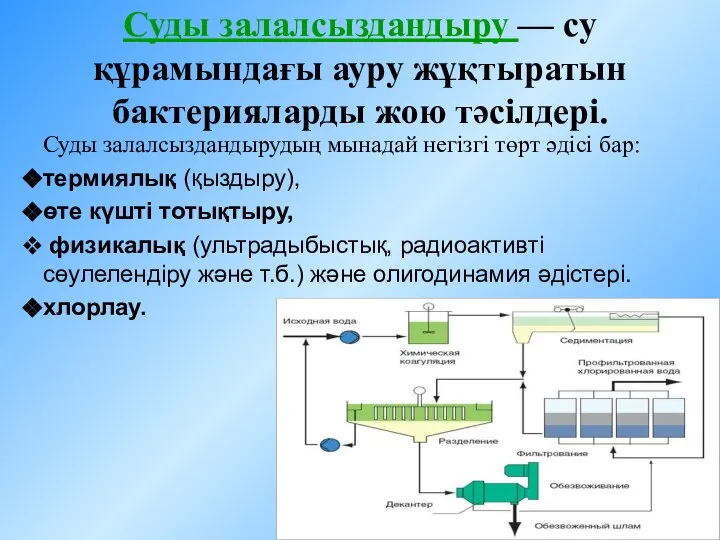 Суды залалсыздандыру - су құрамындағы ауру жұқтыратын бактерияларды жою тәсілдері
Суды залалсыздандыру - су құрамындағы ауру жұқтыратын бактерияларды жою тәсілдері Производная в химии
Производная в химии Классификация, виды бензинов и их свойства
Классификация, виды бензинов и их свойства Занимательная химия
Занимательная химия Презентация по химии Эпоха теории флогистона Пневматическая химия Развитие аналитической химии
Презентация по химии Эпоха теории флогистона Пневматическая химия Развитие аналитической химии  Полимеры с включением атомов бора и карборановой группировки - полиборорганосилоксаны и поликарборанорганосилосксаны
Полимеры с включением атомов бора и карборановой группировки - полиборорганосилоксаны и поликарборанорганосилосксаны Методы определения основных групп токсических веществ. Этапы химико-токсикологического анализа
Методы определения основных групп токсических веществ. Этапы химико-токсикологического анализа Основные диагностические признаки рубина и его имитаций
Основные диагностические признаки рубина и его имитаций Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Серная кислота
Серная кислота Моделирование химико-технологических процессов. Лекция № 1-2
Моделирование химико-технологических процессов. Лекция № 1-2 Ароматические вещества и их значение для человека
Ароматические вещества и их значение для человека Липидтер, жіктелуі (қарапайым және күрделі липидтер), қызметі, май қышқылдары
Липидтер, жіктелуі (қарапайым және күрделі липидтер), қызметі, май қышқылдары