Содержание
- 2. История Ртуть – 1 из 7 металлов древности. Она известна более 1500 лет до н.э. в
- 3. Народам Индии и Китая самородная ртуть была известна за 2000 лет до н. э. Ими же,
- 4. Распространение Ртути в природе Ртуть принадлежит к числу весьма редких элементов. Приблизительно в таких количествах она
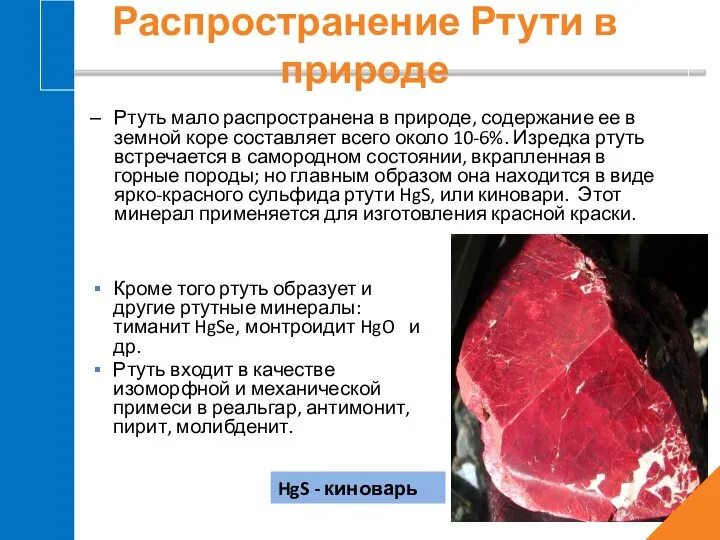
- 5. Ртуть мало распространена в природе, содержание ее в земной коре составляет всего около 10-6%. Изредка ртуть
- 6. Самородная ртуть Hg Ртуть на киноварь-кварцевом агрегате. Levigliani, Тоскана, Италия Ртуть на барите. Шахта Анна, Зигерланд,
- 7. Каломель (Hg2)2+(Cl,Br)2 Терлингуа, Техас San-Onofre. Мексика Авала, Сербия
- 8. Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
- 9. Химический элемент Ртуть (Hg, от лат. Hydrargyrum) — элемент шестого периода периодической системы химических элементов Д.
- 10. Физические свойства Простое вещество ртуть — переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость,
- 11. Физические свойства Температура плавления составляет 234,32 K (-38,83 °C), кипит при 629,88 K (356,73 °C). Обладает
- 12. Химические свойства Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть
- 13. Химические свойства Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами,
- 14. Химические свойства Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути: При
- 15. Химические свойства При нагревании до 300 °C ртуть вступает в реакцию с кислородом: При этом образуется
- 16. Химические свойства При нагревании ртути с серой образуется сульфид ртути(II): Сульфид ртути Реакция демеркуризации
- 17. Химические свойства Ртуть также реагирует с галогенами (причём на холоде — медленно). Ртуть можно окислить также
- 18. Получение Ртуть получают обжигом киновари (сульфида ртути(II)) или металлотермическим методом: Пары ртути конденсируют и собирают. Этот
- 19. Ртуть широко применяется при изготовлении научных приборов:(барометры, термометры, манометры, вакуумные насосы и др.), в ртутных лампах,
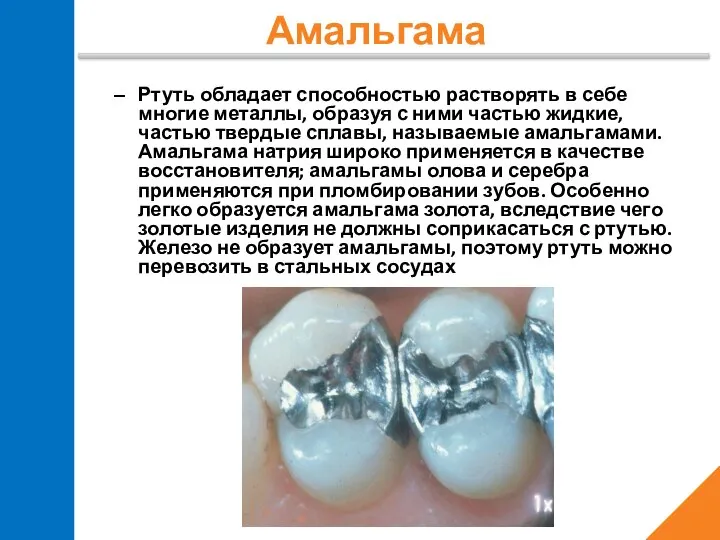
- 20. Ртуть обладает способностью растворять в себе многие металлы, образуя с ними частью жидкие, частью твердые сплавы,
- 21. Соединения ртути Оксид ртути(II) — HgO Это твёрдое непрочное при нормальных условиях вещество красного или оранжевого
- 22. Соединения ртути Фульминат ртути(II) Hg(ONC)2 («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (Детонаторы). «Гремучую ртуть»
- 23. Соединения ртути Сулема - хлорид ртути HgCl2 был первым веществом на основе Hg, которое начали использовать
- 24. Соединения ртути Ка́ломель, хлористая ртуть, хлорид одновалентной ртути Hg2Cl2 - бесцветные, мало растворимые в воде кристаллы.
- 25. Соединения ртути Циани́д рту́ти(II) Hg(CN)2 — неорганическое соединение, ртутная соль синильной кислоты. Содержит 79% ртути. Белое
- 26. Безобидная, на первый взгляд, капля, но в ней таится большая опасность
- 27. Основной опасность представляют пары металлической ртути, выделение которых с открытых поверхностей возрастает при повышении температуры воздуха.
- 28. Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что
- 29. Домашнее задание: П.18, стр. 244-245, №30
- 31. Скачать презентацию


























 Хроматография талдау әдістері
Хроматография талдау әдістері Горение жидкостей
Горение жидкостей Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Примерная рабочая программа основного общего образования предмета Химия
Примерная рабочая программа основного общего образования предмета Химия Практическая работа. Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: используя знания о свойствах соедине
Практическая работа. Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: используя знания о свойствах соедине Оксиды азота.
Оксиды азота. Классы органических и неорганических веществ
Классы органических и неорганических веществ Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Дисахариды и полисахариды
Дисахариды и полисахариды Урок в 8 классе
Урок в 8 классе Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка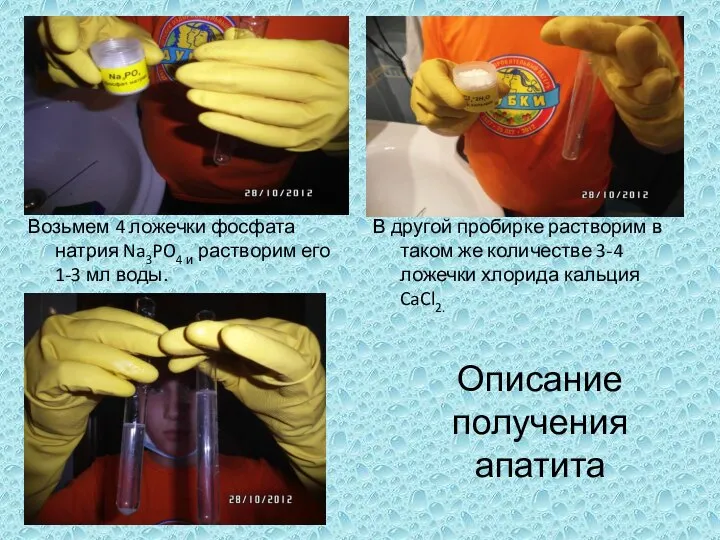 Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды.
Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды. Методы аналитического контроля в производстве материалов современной энергетики. Физические основы методов
Методы аналитического контроля в производстве материалов современной энергетики. Физические основы методов Презентация по Химии "Фосфор" - скачать смотреть бесплатно_
Презентация по Химии "Фосфор" - скачать смотреть бесплатно_ Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Органогенні елементи. Хімія в організмах
Органогенні елементи. Хімія в організмах Золоторудное поле «Дуэт»
Золоторудное поле «Дуэт» Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро
Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро Химические реакторы
Химические реакторы Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака
Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака Общая и неорганическая химия. Лекция 19. Общая характеристика элементов VIA-группы (халькогены). Кислород
Общая и неорганическая химия. Лекция 19. Общая характеристика элементов VIA-группы (халькогены). Кислород Щелочные металлы
Щелочные металлы Фосфорные удобрения
Фосфорные удобрения Значение химии в жизни человека
Значение химии в жизни человека Научная работа на тему «Уголь» Научная работа на тему «Уголь» Подготовила: Шакарова Ксения Руководитель: Э.М. Курант
Научная работа на тему «Уголь» Научная работа на тему «Уголь» Подготовила: Шакарова Ксения Руководитель: Э.М. Курант pH жидкостей, необходимых для человека
pH жидкостей, необходимых для человека  Применение алкенов
Применение алкенов