Содержание
- 2. Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей
- 3. В живой природе: Входит в состав животных и растительных белков, витаминов, гормонов. СЕРА В ПРИРОДЕ Сера
- 4. Самородная сера, серный колчедан FeS2, медный колчедан CuFeS2, свинцовый блеск PbS с цинковой обманкой ZnS Ангидрит
- 5. СЕРА nº=16 p+=16 ē=16 Z=+16 Степени окисления серы: −2 (окислительные свойства); 0; +2, +4, +6 (восстановительные
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА СЕРЫ Сера – твердое кристаллическое вещество, не имеет запаха Не растворяется в воде. Хорошо
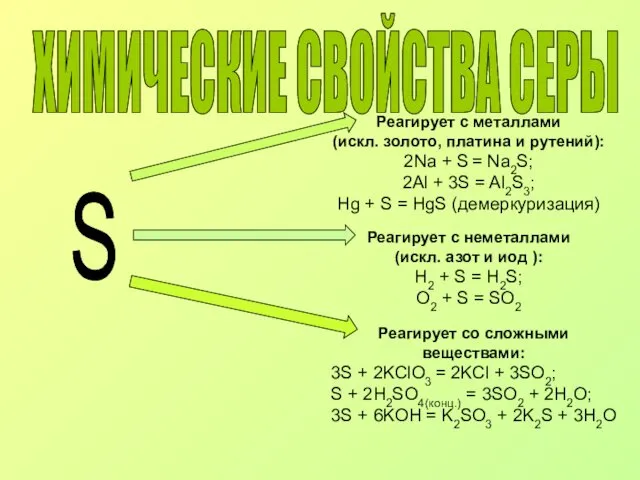
- 7. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ S Реагирует с металлами (искл. золото, платина и рутений): 2Na + S =
- 8. Поместите в пробирку кусочек серы величиной в половину горошины и слегка нагрейте, чтобы сера прилипла к
- 9. Заполните кислородом колбу емкостью 250–300 мл. Заполнение проверьте тлеющей лучиной, поднеся ее к краю сосуда. Прикройте
- 10. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ Сера ромбическая Сера пластическая Сера моноклинная Цвет – лимонно-желтый; tпл. = 112,8ºС; ρ
- 11. В пробирку объемом 10 мл поместите мелкие кусочки серы и нагрейте ее до расплавления (при 119OС).
- 12. ПОЛУЧЕНИЕ СЕРЫ Неполное окисление сероводорода: 2H2S + O2 = 2S↓ + 2H2O (недостаток O2). 2. Реакция
- 13. ПРИМЕНЕНИЕ СЕРЫ S
- 15. Скачать презентацию










 Метаболизм липидов. Липолиз. Окисление жирных кислот и глицерола
Метаболизм липидов. Липолиз. Окисление жирных кислот и глицерола Закон сохранения массы веществ Омельянчук Т.Е. учитель химии МАОУ ДСОШ №2 г. Домодедово
Закон сохранения массы веществ Омельянчук Т.Е. учитель химии МАОУ ДСОШ №2 г. Домодедово Получение и исследование свойств хромата калия
Получение и исследование свойств хромата калия Конфигурация макромолекулы
Конфигурация макромолекулы Презентация по Химии "Техника безопасности в кабинете химии" - скачать смотреть
Презентация по Химии "Техника безопасности в кабинете химии" - скачать смотреть  Валентность
Валентность Нафта, сланцевий газ, екологія середовища Підготувала учениця 11 Б класу Кандибка Ольга
Нафта, сланцевий газ, екологія середовища Підготувала учениця 11 Б класу Кандибка Ольга  Алкины
Алкины Алюминий
Алюминий Основные классы неорганических соединений
Основные классы неорганических соединений неметаллы Общая характеристика
неметаллы Общая характеристика Нуклеин қышқылдары
Нуклеин қышқылдары Поверхностные явления. Уравнение Гиббса
Поверхностные явления. Уравнение Гиббса Защита металлов от коррозии
Защита металлов от коррозии Дисахариды Ширяева София ХБ-4 г.Липецк 2012
Дисахариды Ширяева София ХБ-4 г.Липецк 2012 Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Обозначения химического состава и пищевой ценности продовольственных товаров
Обозначения химического состава и пищевой ценности продовольственных товаров Ископаемое топливо
Ископаемое топливо Химическая термодинамика
Химическая термодинамика ПОРТФОЛІО вчителя хімії та біології Турбівської загальноосвітньої школи І – ІІІ ступенів 2014 рік
ПОРТФОЛІО вчителя хімії та біології Турбівської загальноосвітньої школи І – ІІІ ступенів 2014 рік ФИЗИОЛОГИЯ ПИТАНИЯ. Урок по кулинарии. 7 класс. Разработал: учитель технологии Дятлова Елена Владимировна
ФИЗИОЛОГИЯ ПИТАНИЯ. Урок по кулинарии. 7 класс. Разработал: учитель технологии Дятлова Елена Владимировна  Нуклеиновые кислоты
Нуклеиновые кислоты Строение атома
Строение атома Теория строения химических веществ
Теория строения химических веществ Презентация по Химии "АЗОТНАЯ КИСЛОТА И ЕЕ СВОЙСТВА" - скачать смотреть бесплатно
Презентация по Химии "АЗОТНАЯ КИСЛОТА И ЕЕ СВОЙСТВА" - скачать смотреть бесплатно Кислородсодержащие органические соединения. Предельные одноатомные спирты
Кислородсодержащие органические соединения. Предельные одноатомные спирты Обмен холестерола
Обмен холестерола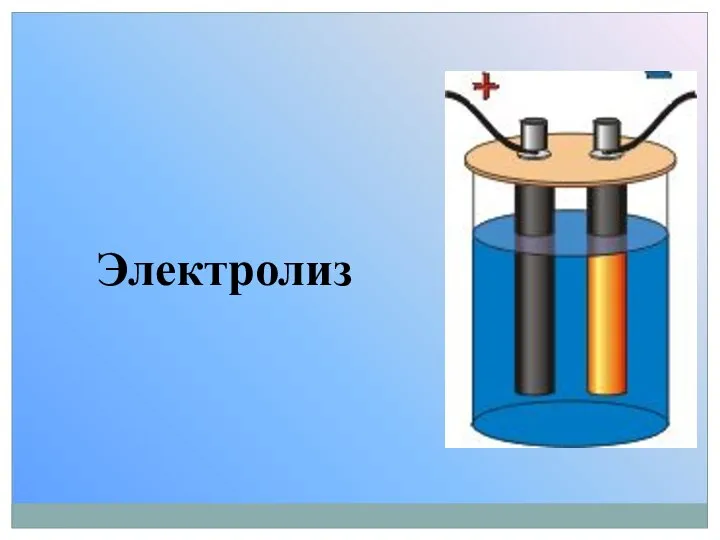 Электролиз
Электролиз