Содержание
- 2. Цели урока Дать понятие о составе атома и составе атомного ядра Раскрыть взаимосвязь понятий: протон; нейтрон;
- 3. Актуализация знаний 1. В предложение вставьте слова „атом” и „молекула” а) …водорода образована … водорода. б)
- 4. Основные положения атомно-молекулярного учения (М. Ломоносов) Вещества состоят из молекул, а молекулы из атомов. Молекула –мельчайшая
- 5. Атом - сложная частица Введение понятия „электрон” (Стони) Открытие катодных лучей. Катодные лучи- поток электронов (Томсон
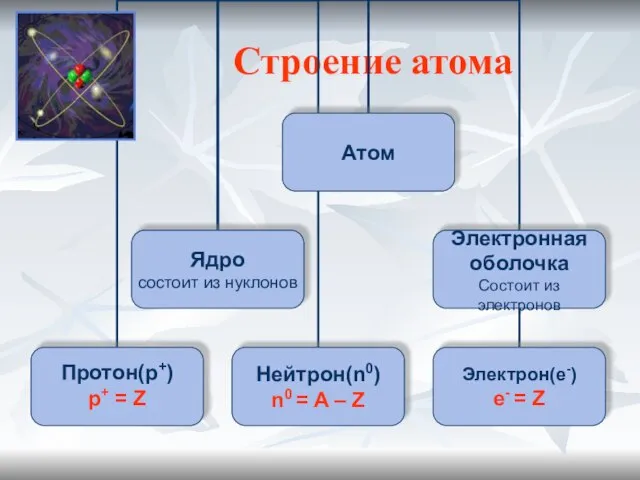
- 6. Строение атома
- 7. Планетарная модель атома (Резерфорд) Атом –это микрочастица, которая имеет форму шара. Атом –сложная система, состоящая из
- 8. Строение атома Связь строения атома и Периодической системы химических элементов Д.И. Менделеева Порядковый Заряд Число Число
- 9. Самостоятельная работа Укажите состав атома железа Укажите состав ядра атома железа Укажите состав атома фосфора, состав
- 10. Домашнее задание § 6 Задание №3, №5 (с.43) Творческое задание: Пользуясь этимологическим словарем, объясните, почему планетарную
- 11. Изменения в составе ядер атомов химических элементов. Изотопы
- 12. Что произойдет с атомом элемента, если в его ядре изменить число протонов? Например, в ядро атома
- 13. Что произойдет с атомом элемента, если в его ядре изменить число нейтронов? Например, в ядро атома
- 14. Изотопы Укажите состав изотопов хлора: 35Сl и 37Сl +1735Сl(17p++18n0) 17е- Аr=35 +1737Сl(17p++20n0) 17е- Аr=37 Атомы изотопов
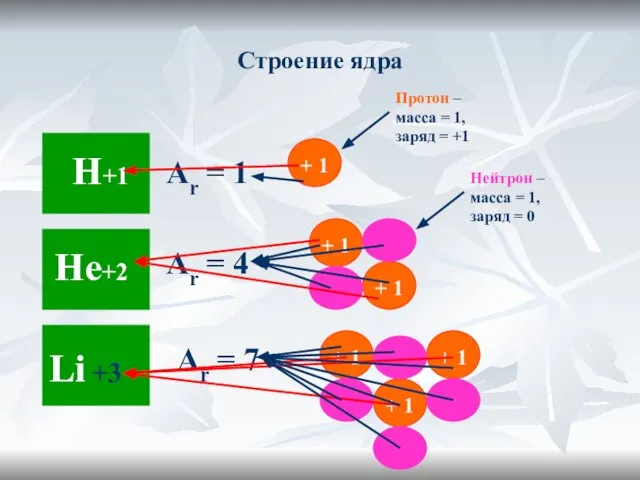
- 15. Строение ядра Аr = 1 Аr = 4 Аr = 7 Протон – масса = 1,
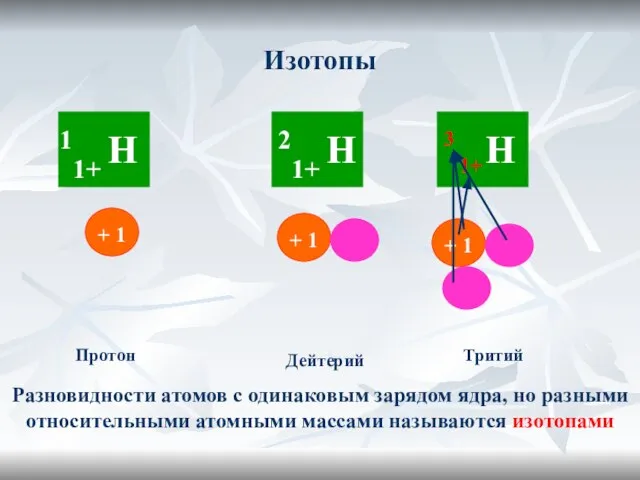
- 16. Изотопы Протон Дейтерий Тритий 1+ 3 Разновидности атомов с одинаковым зарядом ядра, но разными относительными атомными
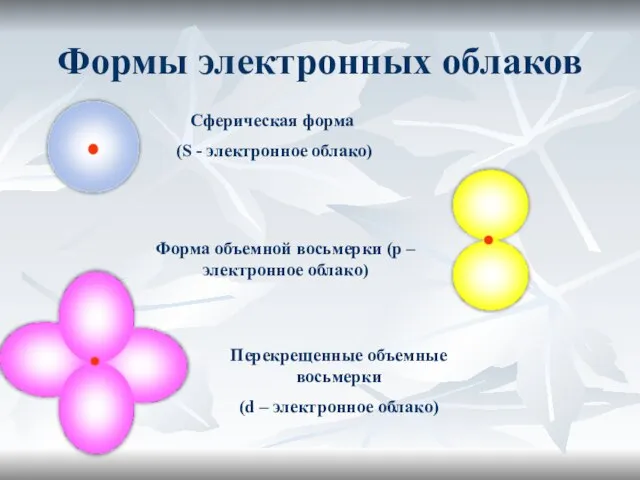
- 17. Электронное облако
- 18. Формы электронных облаков Сферическая форма (S - электронное облако) Форма объемной восьмерки (p – электронное облако)
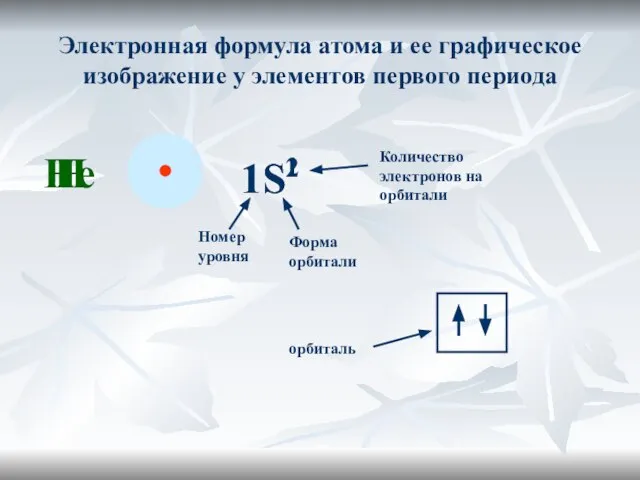
- 20. Электронная формула атома и ее графическое изображение у элементов первого периода Н 1S1 Номер уровня Форма
- 21. Задание 1 Символ изотопа элемента +1939Э. Определите, какой это элемент, состав атома этого элемента. Z=19. Элемент
- 22. Задание 2 Природный хлор состоит из 75% изотопа с массовым числом 35 и из 25% изотопа
- 23. Задание 3 Символ изотопа элемента +1939Э. Определите, какой это элемент, состав атома этого элемента. Z=19 Элемент
- 24. Задание 4 Относительная атомная масса хлора 35,5. Хлор существует в природе в виде двух изотопов: 35Cl
- 26. Скачать презентацию


















 Области применения серной, соляной, азотной, и уксусной кислот
Области применения серной, соляной, азотной, и уксусной кислот Углерод. Металлы. 9 класс
Углерод. Металлы. 9 класс Алюминий и его соединения
Алюминий и его соединения Біогеохімічні цикли та їх еволюція
Біогеохімічні цикли та їх еволюція Презентация Витамин Е
Презентация Витамин Е  Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C
Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C Естествознание. Раздел II. Химия с элементами экологии Урок по теме:
Естествознание. Раздел II. Химия с элементами экологии Урок по теме: Презентация по Химии "Презентация Войди в природу другом" - скачать смотреть
Презентация по Химии "Презентация Войди в природу другом" - скачать смотреть  Презентация по Химии "Пластмаса" - скачать смотреть бесплатно
Презентация по Химии "Пластмаса" - скачать смотреть бесплатно Кислотно-основное титрование. 4 лекция. Часть 2
Кислотно-основное титрование. 4 лекция. Часть 2 Реакции координированных лигандов
Реакции координированных лигандов Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Презентация по Химии "Глюкоза" - скачать смотреть
Презентация по Химии "Глюкоза" - скачать смотреть  Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Основные классы неорганических соединений
Основные классы неорганических соединений Электролиз
Электролиз ГОД ЭКОЛОГИИ-2013
ГОД ЭКОЛОГИИ-2013  Растворы
Растворы Что объединяет вещества. Классификация твёрдых веществ
Что объединяет вещества. Классификация твёрдых веществ Химия и здоровье
Химия и здоровье  Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей В чём вкус хлеба?
В чём вкус хлеба? Катализ.Лекция
Катализ.Лекция Антибиотики как ЛС
Антибиотики как ЛС Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров
Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров КВН В МИРЕ ВЕЩЕСТВ
КВН В МИРЕ ВЕЩЕСТВ Полимерные реагенты в бурении
Полимерные реагенты в бурении Хімічний лабіринт
Хімічний лабіринт