Содержание
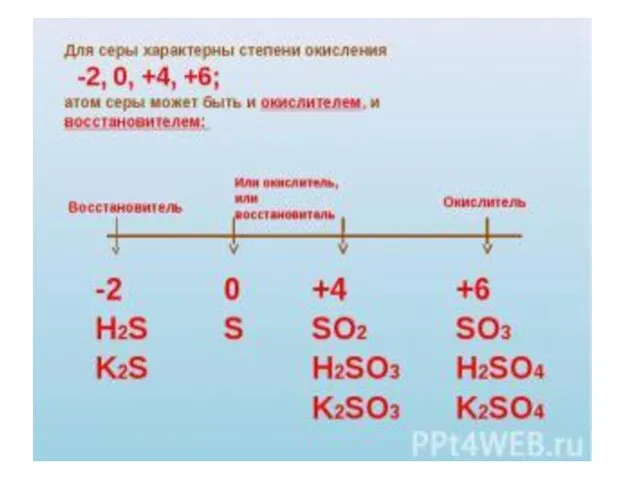
- 3. Сера Сера- твёрдое, хрупкое вещество жёлтого цвета, молекула содержит 8 атомов серы и имеет циклическую форму;
- 4. Сера В этом состоянии сера настолько вязка, что её нельзя вылить из сосуда, в котором она
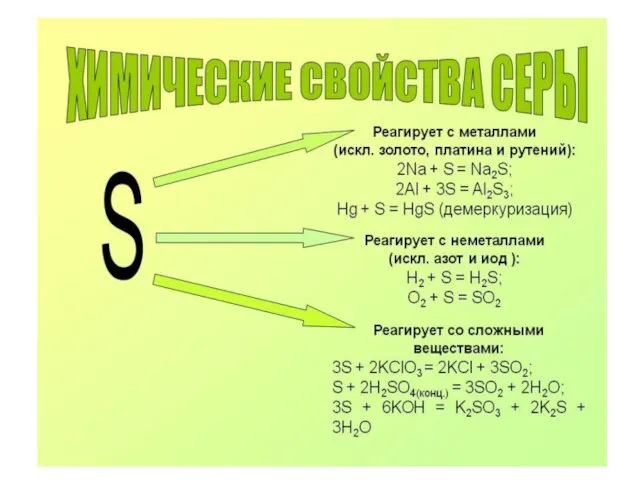
- 6. Оксиды серы Сера образует два оксида – SO2 и SO3, растворимые в воде. SO2 - Н2SO3
- 7. 1. SO2 + 2 Н2S = 3S + 2Н2О S+4 +4е -------- S0 ок-ль 2. SO2
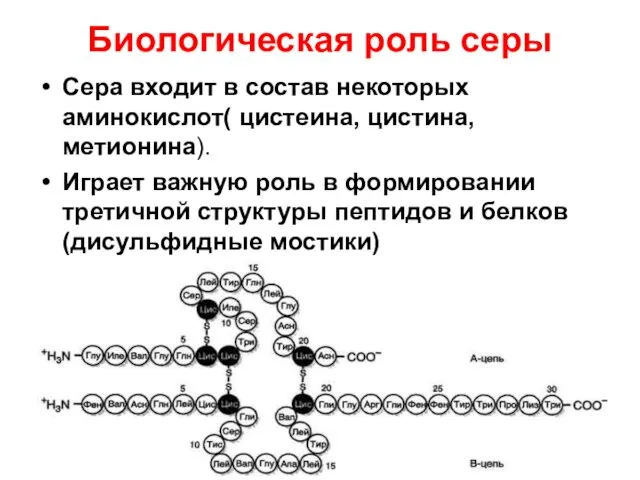
- 8. Биологическая роль серы Сера входит в состав некоторых аминокислот( цистеина, цистина, метионина). Играет важную роль в
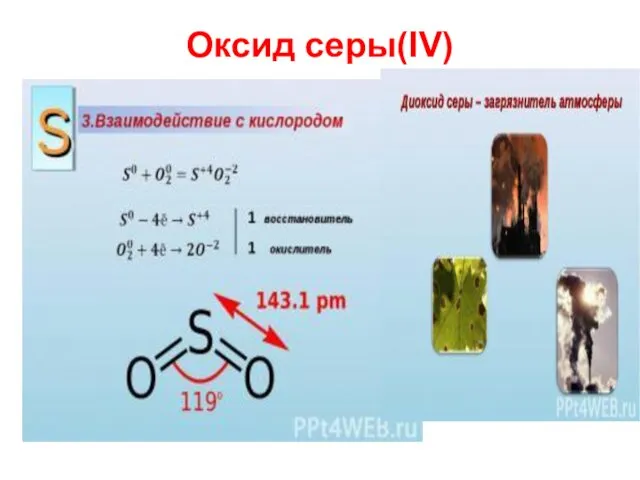
- 9. Оксид серы(IV)
- 10. SO2 –соответствует слабая сернистая кислота, проявляющая в ОВР окислительно-восстановительную двойственность: 2Н2SО3 + О2 = 2 Н2SО4
- 11. Оксид серы(VI) Оксид серы(VI) –проявляет только окислительные свойства, т.к. сера находится в высшей степени окисления: 5SO3
- 12. Сероводород
- 14. Сероводород Сероводород горит при поджигании: 2H2S + O2 = 2S + 2H2O Если данная реакция проходит
- 15. Серная кислота Чистая серная кислота представляет собой бесцветную маслянистую жидкость, превращающуюся при 10, 4°С в твёрдую
- 16. Способностью поглощать воду объясняется и обугливание многих органических веществ, особенно относящихся к классу углеводов (клетчатка, сахар
- 17. Серная кислота Серная кислота является энергичным окислителем; её окислительные свойства проявляются при взаимодействии со многими веществами.
- 18. Серная кислота Концентрированная серная кислота является окислителем за счёт серы. Она окисляет металлы, стоящие в ряду
- 19. Серная кислота При взаимодействии с более активными металлами продуктами восстановления могут быть как SO2, так и
- 20. SO3 способен растворяться в серной кислоте(к) с образованием олеума, из которого можно получить кислоты: пиросерную-H2S2O7( соли
- 21. Серная кислота опасна и может вызывать тяжелые ожоги. Вместе с другими сильными кислотами и щелочами, она
- 22. Она быстро атакует роговицу при попадании в глаза, приводя к постоянной слепоте. Более того, она может
- 23. Стандартным средством первой помощи для разлива кислоты на коже, является промывание обильным количеством воды. Промывание продолжается
- 25. Скачать презентацию


















 Исследование минерализата в клинической фармации
Исследование минерализата в клинической фармации Алкины. Ацетилен – представитель алкинов.
Алкины. Ацетилен – представитель алкинов. Презентация по Химии "Вода как растворитель" - скачать смотреть
Презентация по Химии "Вода как растворитель" - скачать смотреть  Изучение ТЭД и ОВР в школьном курсе химии
Изучение ТЭД и ОВР в школьном курсе химии Кто многим увлекается, тот многое обретает. П.
Кто многим увлекается, тот многое обретает. П.  Фармацевтическая химия. Фармакокинетика. Фармакодинамика. Молекулярные мишени
Фармацевтическая химия. Фармакокинетика. Фармакодинамика. Молекулярные мишени Нуклеиновые кислоты. Строение. Схема образования
Нуклеиновые кислоты. Строение. Схема образования Соляная кислота и ее свойства
Соляная кислота и ее свойства Строение атома
Строение атома Спирты
Спирты Энергетический обмен
Энергетический обмен Anorganická chemie
Anorganická chemie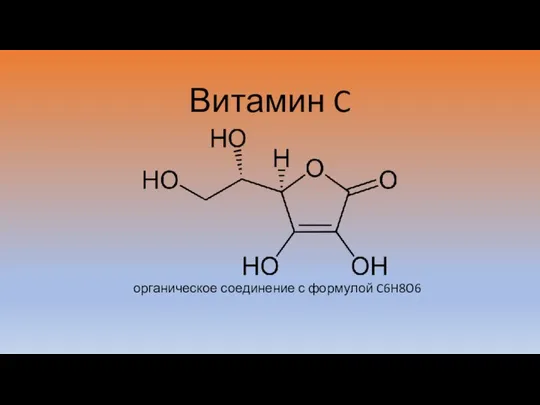 Витамин C
Витамин C G12 - класс антифризов
G12 - класс антифризов Альдегиды и кетоны
Альдегиды и кетоны Весы. Камни Весов
Весы. Камни Весов Гетероциклді қосылыстар. Алкалоидтар
Гетероциклді қосылыстар. Алкалоидтар Презентація на тему: “Поняття про полімери на прикладі поліетилену”
Презентація на тему: “Поняття про полімери на прикладі поліетилену”  Презентация Фенолы
Презентация Фенолы Лекарственные растения и сырье, содержащие флавоноиды. (Лекция 12)
Лекарственные растения и сырье, содержащие флавоноиды. (Лекция 12) Алкины (Ацетилены)
Алкины (Ацетилены) КАЛЬЦИЙ учитель: Дерюжина Алеся Владимировна Alesya2312@nextmail.ru МОУ «Гимназия №4» г.о. Электросталь, МО Ca 9 класс
КАЛЬЦИЙ учитель: Дерюжина Алеся Владимировна Alesya2312@nextmail.ru МОУ «Гимназия №4» г.о. Электросталь, МО Ca 9 класс  Сырьё для получения фенолальдегидных полимеров
Сырьё для получения фенолальдегидных полимеров фізичні властивості полімеру спиртів та карбонових кислот
фізичні властивості полімеру спиртів та карбонових кислот  Кафедра биохимии УГМУ в прошлом и настоящем. Локализация
Кафедра биохимии УГМУ в прошлом и настоящем. Локализация Соединения галогенов
Соединения галогенов Классификация неорганических веществ
Классификация неорганических веществ Окислительные методы получения органических соединений
Окислительные методы получения органических соединений