Содержание
- 2. Цели урока Охарактеризовать положение серы в Периодической системе, строение атома, физические и химические свойства серы. Охарактеризовать
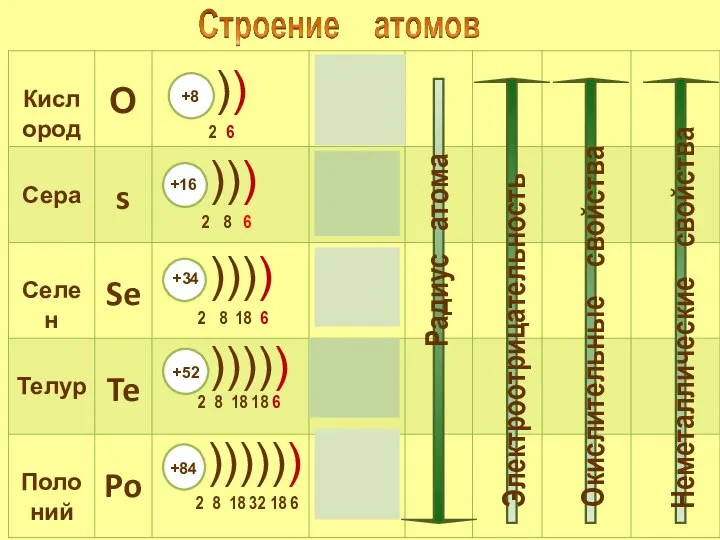
- 3. Визитка химического элемента. Химический знак - S Порядковый номер – 16 Аr - 32.066 Период -
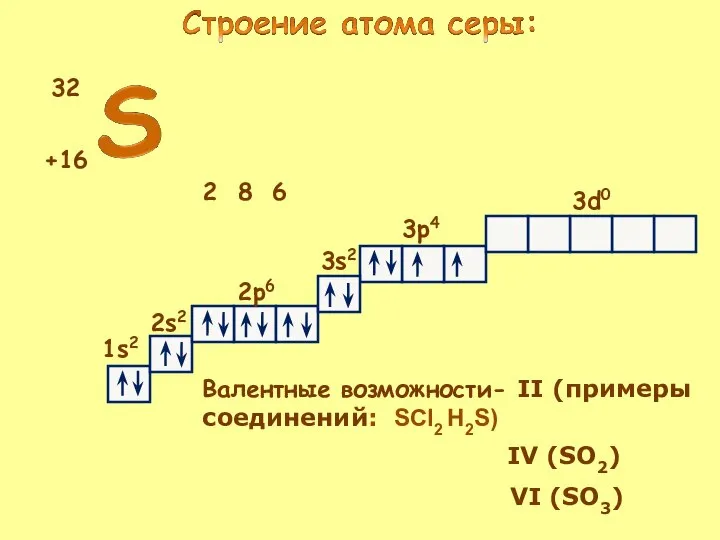
- 5. +16 32 2 6 8 1s2 2s2 2p6 3s2 3p4 3d0 Валентные возможности- II (примеры соединений:
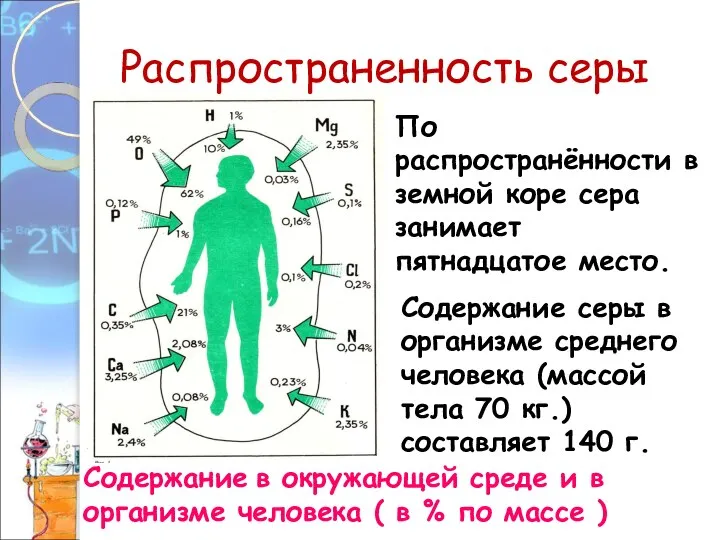
- 6. Распространенность серы Содержание в окружающей среде и в организме человека ( в % по массе )
- 7. Нахождение серы в природе. Сера в природе Самородная сера -S Сульфиды Пирит –FeS2 Сульфаты Гипс-СаSO4*2H2O Мирабилит
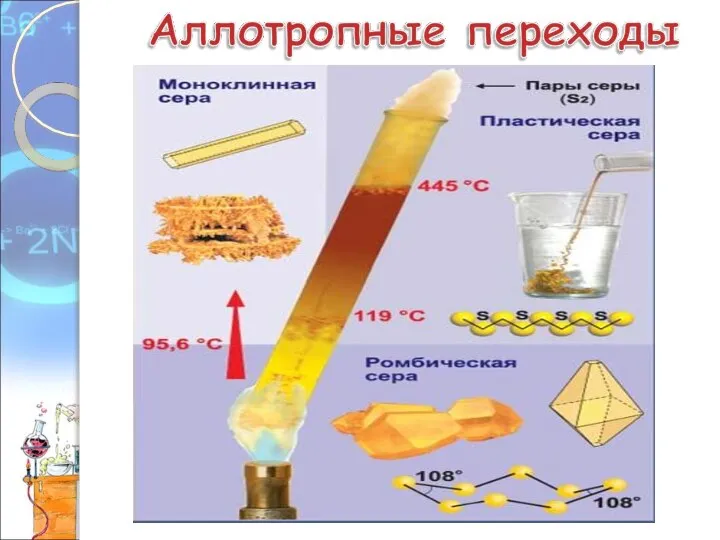
- 8. Аллотропные модификации серы. 1. Ромбическая сера - устойчива при комнатной температуре 2. Моноклинная сера – образуется
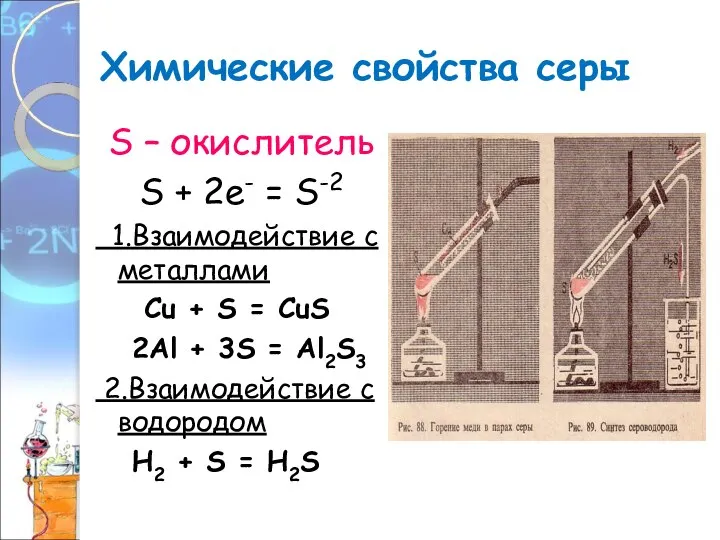
- 11. Химические свойства серы S – окислитель S + 2е- = S-2 1.Взаимодействие с металлами Сu +
- 12. Химические свойства серы. S – восстановитель S – 2e- = S+2 S - 4e- = S+4
- 14. Сероводород – высокотоксичное, крайне ядовитое вещество. Вдыхание H2S вызывает головокружение и головную боль, происходит разрушение гемоглобина
- 15. Кто есть кто на данном семейном портрете?
- 18. Нет, я не понимаю Я не полностью уверен Да, я понимаю А В С
- 20. Скачать презентацию










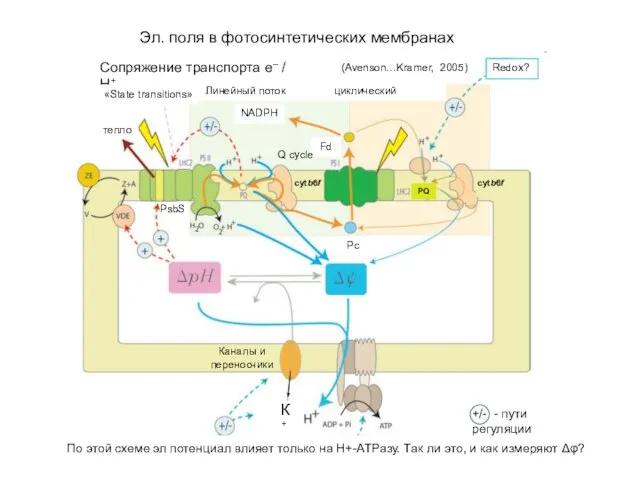 Электрические поля в фотосинтетических мембранах
Электрические поля в фотосинтетических мембранах Коррозия металлов. Причины
Коррозия металлов. Причины Алюміній: будова атома, поширення в природі. Фізичні і хімічні властивості алюмінію. Застосування алюмінію Підготував
Алюміній: будова атома, поширення в природі. Фізичні і хімічні властивості алюмінію. Застосування алюмінію Підготував  Химический диктант
Химический диктант Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Кинетика сложных реакций
Кинетика сложных реакций Способы количественного определения белка
Способы количественного определения белка Chimie bioorganique
Chimie bioorganique Алюминий
Алюминий  Применение эксклюзионной хроматографии в биологии
Применение эксклюзионной хроматографии в биологии Вопрос о природе химической связи – сердце всей химии
Вопрос о природе химической связи – сердце всей химии Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака
Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака Чугуны. Виды чугунов. химическое сопротивление чугунов
Чугуны. Виды чугунов. химическое сопротивление чугунов Презентация по Химии "Определение рода вещества (жидкости) по его плотности" - скачать смотреть
Презентация по Химии "Определение рода вещества (жидкости) по его плотности" - скачать смотреть  Электродные потенциалы. Окислительно-восстановительные потенциалы. Потенциометрия в медицинской практике
Электродные потенциалы. Окислительно-восстановительные потенциалы. Потенциометрия в медицинской практике Горные породы
Горные породы Коллоидные растворы. Методы получения и очистки коллоидных растворов. Строение мицеллы гидрофобных систем. (Часть 1)
Коллоидные растворы. Методы получения и очистки коллоидных растворов. Строение мицеллы гидрофобных систем. (Часть 1) Брейн-ринг. Відгадай елемент
Брейн-ринг. Відгадай елемент Степень окисления
Степень окисления Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки
Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки Презентация по Химии "Избранные главы металлоорганической химии" - скачать смотреть
Презентация по Химии "Избранные главы металлоорганической химии" - скачать смотреть  Угольная кислота и ее соли
Угольная кислота и ее соли Презентация по Химии "Подгруппа углерода." - скачать смотреть
Презентация по Химии "Подгруппа углерода." - скачать смотреть  Діагностика за показами газоаналізатора. Типи газоаналізаторів
Діагностика за показами газоаналізатора. Типи газоаналізаторів Химия и здоровье
Химия и здоровье Химиялық кинетика және химиялық тепе-теңдік
Химиялық кинетика және химиялық тепе-теңдік Знаки химических элементов
Знаки химических элементов Полимеры и сополимеры акриловой и метакриловой кислот и их производных
Полимеры и сополимеры акриловой и метакриловой кислот и их производных