Содержание
- 2. Цель урока: Изучить свойства концентрированной серной кислоты. Сравнить свойства концентрированной и разбавленной серной кислоты
- 3. Маршрут путешествия Станция Информационная Станция Экспериментальная Станция Сказочная Станция Экзаменационная Станция Практическая Станция Экологическая Станция Менделеевская
- 4. Структурная формула и молекула серной кислоты + + 6 - 2 H2 SO4
- 5. Характеристика Серная кислота – двухосновная, кислородсодержащая, растворимая, нелетучая, сильная, стабильная.
- 6. Бесцветная маслянистая жидкость =1,83кг/дм3 Большая вязкость Обладает сильным гигроскопическим свойством Физические свойства серной кислоты t кип.
- 7. «Опыт - это единственный верный путь спрашивать природу и слышать ответ в ее лаборатории». (Д.И.Менделеев)
- 8. Лабораторные опыты: Химические свойства разбавленной серной кислоты 1. Ознакомьтесь с инструкцией по выполнению лабораторных опытов (учебник
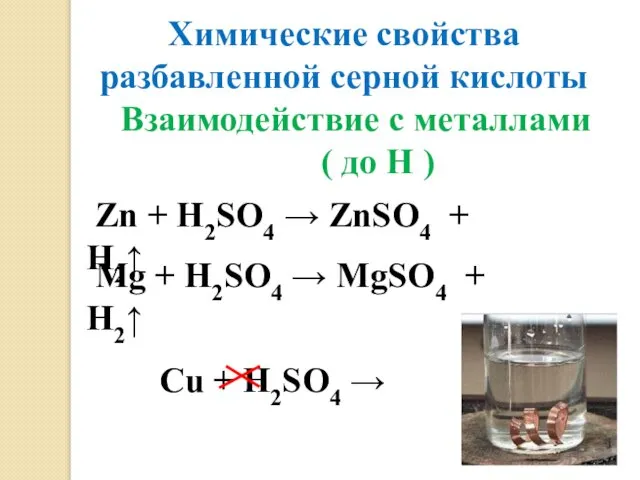
- 9. Химические свойства разбавленной серной кислоты Взаимодействие с металлами ( до Н ) Zn + H2SO4 →
- 10. Взаимодействие с оксидами металлов CuO + H2SO4 → CuSO4 + H2O ZnO + H2SO4 → ZnSO4
- 11. Взаимодействие с основаниями 2NaOH + H2SO4 → Na2SO4 +2 H2O H+ + ОН- → H2O NaOH
- 12. Na2CO3 + H2SO4 = Na2SO4 + H2CO3 2H++ CO32- = H2O + CO2 Взаимодействие с солями
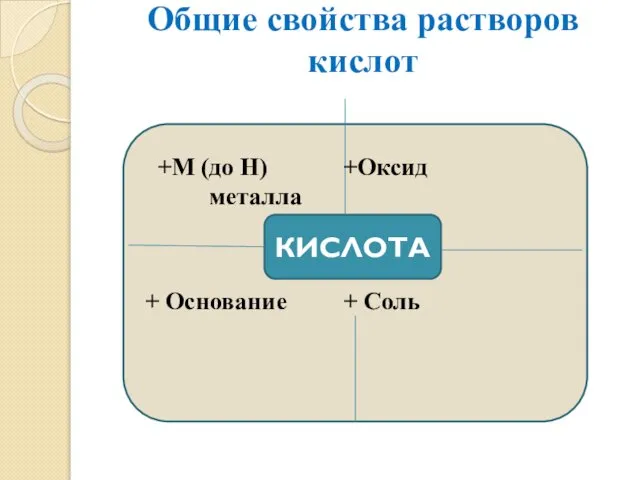
- 13. Общие свойства растворов кислот КИСЛОТА +М (до Н) +Оксид металла + Основание + Соль
- 14. Правило разбавления кислот Сначала вода, потом кислота – иначе случится большая беда! Н2О
- 15. Обугливание сахарозы серной кислотой C12H22O11 + 2H2SO4→11C + 13H2O + CO2 + 2SO2 +Q
- 16. Разрушающее действие концентрированной серной кислоты (обугливание древесины) Серная кислота - сильное водоотнимающее средство: она отнимает молекулы
- 17. Взаимодействие серной кислоты с металлами
- 18. Окислительные свойства конц. H2SO4 Hg0 + H2S+6O4 → S+4O2 + Hg+2SO4 + H2О H2S H2SO4(конц.) +
- 19. Разбавленная и концентрированная серные кислоты ведут себя по разному по отношению к металлам. Разбавленная серная кислота
- 20. Применение серной кислоты «Серная кислота – хлеб химической промышленности.»
- 21. Схема образования кислотных дождей
- 22. Тест 1.Формулы продуктов взаимодействия концентрированной серной кислоты с серебром 1) H2 и Ag2SO4 2) SO2 ,
- 23. Ключ для проверки теста 1) 2 2) 2 «5» - 7 заданий 3) 3 «4» –
- 25. Скачать презентацию




















 Миметик глицина на основе производного Гераниола
Миметик глицина на основе производного Гераниола Цеолиты. Свойства и область применения
Цеолиты. Свойства и область применения Химические процессы
Химические процессы Бор (Borum)
Бор (Borum) Химия и стирка
Химия и стирка  Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть
Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть  Аттестационная работа. Использование цифровой лаборатории Архимед во внеурочной деятельности по химии
Аттестационная работа. Использование цифровой лаборатории Архимед во внеурочной деятельности по химии д.з.051
д.з.051 Химические и физико-химические методы стандартизации и контроля качества лекарственных. (Лекция 3)
Химические и физико-химические методы стандартизации и контроля качества лекарственных. (Лекция 3) Азотная кислота
Азотная кислота Окислительно-восстановительные реакции. (Лекция 18)
Окислительно-восстановительные реакции. (Лекция 18) Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата. (Тема 6)
Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата. (Тема 6) Майда еритін витаминдер. А,D,E,K витаминдері
Майда еритін витаминдер. А,D,E,K витаминдері Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Презентация Соли
Презентация Соли Lekcii_ - 2017-lech_ped 11
Lekcii_ - 2017-lech_ped 11 V група періодичної системи Менделєєва
V група періодичної системи Менделєєва Химико-технологические процессы современных производств
Химико-технологические процессы современных производств Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Химия. Вопросы. Практическая работа
Химия. Вопросы. Практическая работа Химическая идентификация
Химическая идентификация Почему протекают химические реакции
Почему протекают химические реакции Презентация по Химии "Солі в природі" - скачать смотреть бесплатно
Презентация по Химии "Солі в природі" - скачать смотреть бесплатно Пегматитовые месторождения
Пегматитовые месторождения Ароматичні вуглеводні Арени Підготував Учень 11-А класу Пазуханич Руслан
Ароматичні вуглеводні Арени Підготував Учень 11-А класу Пазуханич Руслан 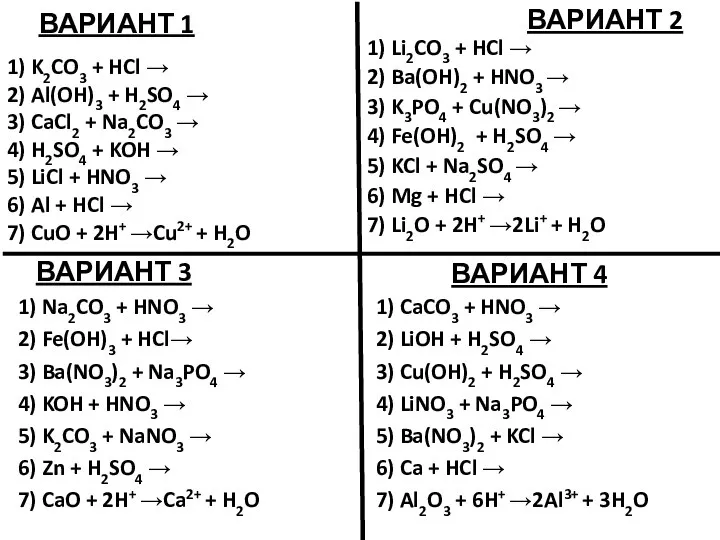 Уравнения возможных реакций. Задание
Уравнения возможных реакций. Задание Методы измерения и приборное обеспечение радиационно-экологического мониторинга. (Лекция 6)
Методы измерения и приборное обеспечение радиационно-экологического мониторинга. (Лекция 6)