Содержание
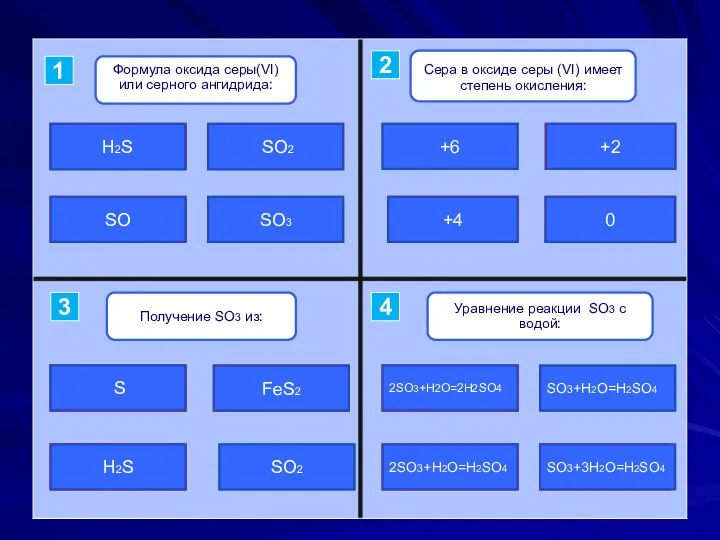
- 2. ошибка ошибка подумай верно SO2 SO H2S SO3 верно подумай ошибка ошибка +6 +4 +2 0
- 3. Разбавление серной кислоты водой. 034.wmv
- 4. Физические свойства серной кислоты Образование гидратов, при взаимодействии серной кислоты с водой: H2SO4 + nH2O =
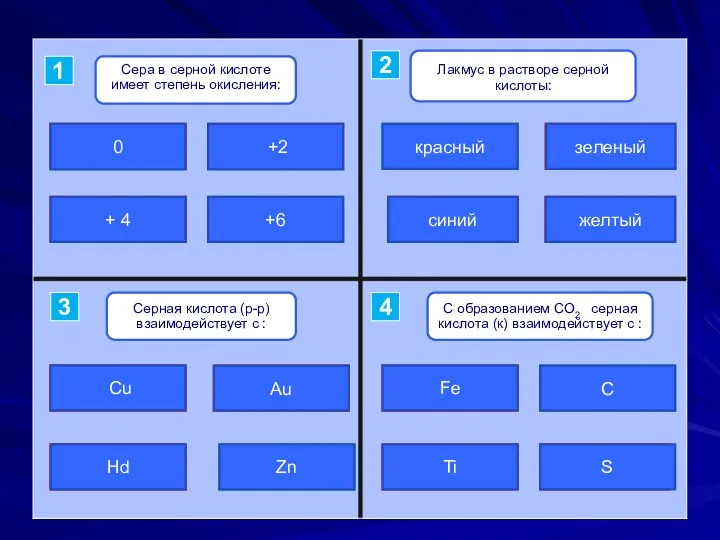
- 5. Химические свойства серной кислоты. 1. Индикатор: (5 группа) а) лакмус б) метиловый оранжевый 2. С металлами,
- 6. Химические свойства серной кислоты. H2+SO4 +Zn0 =Zn+2SO4 +H2↑ H+ – окислитель Zn0 – восстановитель НЕ РЕАГИРУЕТ
- 7. Химические свойства концентрированной серной кислоты. mmlab.chemistry.404i.oms
- 8. Химические свойства серной кислоты. H2SO4 + 2NaOH = Na2SO4 + 2H2O 2H+ + SO42– + 2Na+
- 9. Химические свойства концентрированной серной кислоты. mmlab.chemistry.404i.oms
- 10. Химические свойства концентрированной серной кислоты. 032.wmv
- 11. ВЫВОД: H2SO4 - сильный окислитель. Свойства разбавленной и концентрированной серной кислоты отличаются, так как разные окислители:
- 12. ошибка ошибка подумай верно +2 + 4 0 +6 верно подумай ошибка ошибка красный синий зеленый
- 13. Домашнее задание. §20, стр. 98-104. Упражнение № 1-2, стр. 105 – на «3». Упражнение № 4,
- 14. ПРОВЕРЬ СЕБЯ: В двух одинаковых сосудах без этикеток налиты равные объемы разбавленной и концентрированной серной кислоты.
- 16. Скачать презентацию











 Фосфор. Философский камень
Фосфор. Философский камень Презентация по Химии "Давление твёрдых тел, жидкостей и газов" - скачать смотреть
Презентация по Химии "Давление твёрдых тел, жидкостей и газов" - скачать смотреть  Lipid metabolism
Lipid metabolism Методы термического обезвреживания промышленных газов
Методы термического обезвреживания промышленных газов Сера Работа учителя химии I квалификационной категории МОУ «Красночетайская СОШ» Красночетайского района Чувашской
Сера Работа учителя химии I квалификационной категории МОУ «Красночетайская СОШ» Красночетайского района Чувашской  Минералы
Минералы Химия гетероциклических соединений
Химия гетероциклических соединений Химиялық элемент алюминий
Химиялық элемент алюминий Углеводы
Углеводы  Структура белка
Структура белка Группа рассеянных химических элементов
Группа рассеянных химических элементов Горные породы: гранит, базальт
Горные породы: гранит, базальт Аттестацианная работа. Основы исследовательской деятельности по химии
Аттестацианная работа. Основы исследовательской деятельности по химии Углеводы (сахариды)
Углеводы (сахариды) Методы пробоотбора и пробоподготовки
Методы пробоотбора и пробоподготовки Защита полимеров от старения
Защита полимеров от старения Железо в сплавах и природе. Состав железа
Железо в сплавах и природе. Состав железа Азотсодержащие органические соединения. Амины. Анилинароматический амин
Азотсодержащие органические соединения. Амины. Анилинароматический амин Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химические свойства металлов
Химические свойства металлов Nucleic acids
Nucleic acids Исследование химических моделей (11 класс)
Исследование химических моделей (11 класс) General, specific properties are common to all matters
General, specific properties are common to all matters Методика расчета горения топлива
Методика расчета горения топлива Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Хлор
Хлор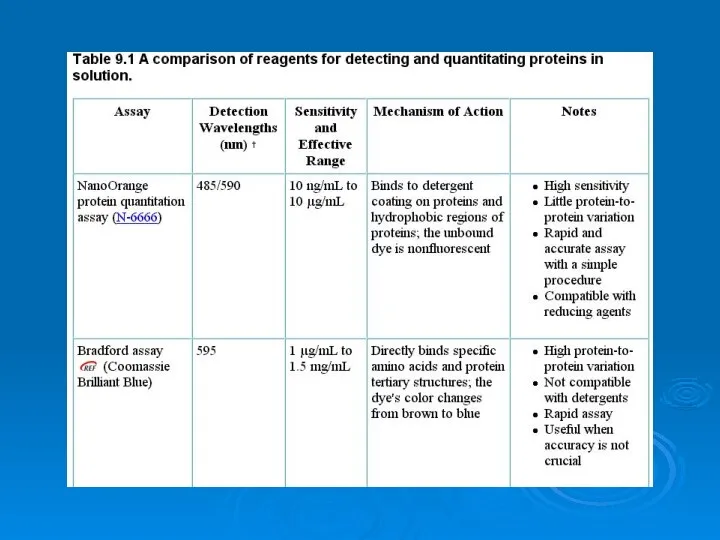 Analysis of proteins
Analysis of proteins Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №9 с углубленным изучением отдельн
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №9 с углубленным изучением отдельн