Содержание
- 2. Занимательные опыты Обугливание сахара Пламя-художник "Вода" зажигает костер
- 3. Я растворю любой металл. Меня алхимик получал В реторте глиняной простой. Слыву я главной кислотой... Когда
- 4. «Сами, трудясь, Вы сделаете все для близких людей и для себя, а если при труде успеха
- 5. Цель урока: познакомиться с историей открытия серной кислоты и распространением ее в природе; изучить химические и
- 6. Содержание 1. История открытия 2. Серная кислота в природе 3. Физические свойства 4. Химические свойства а)
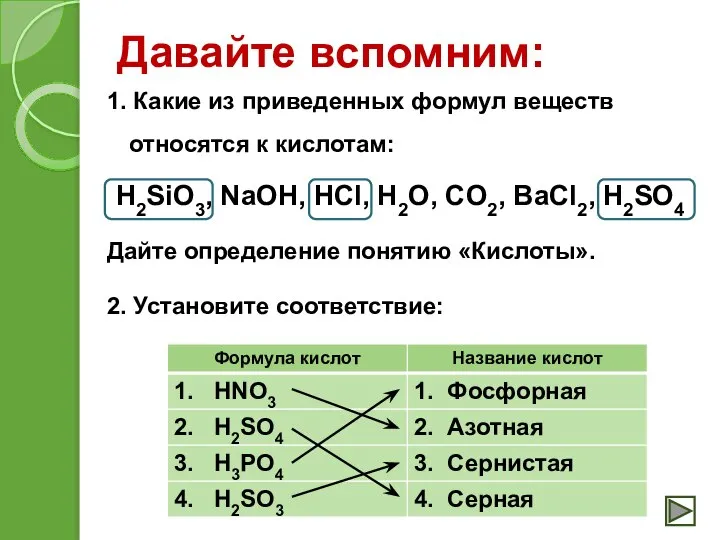
- 7. Давайте вспомним: 1. Какие из приведенных формул веществ относятся к кислотам: H2SiO3, NaOH, HCl, H2O, CO2,
- 8. 3. В предложенных рядах исключите «лишнее вещество». Объясните свой выбор: а. NaOH, KOH, HCl; б. H2SO4,
- 9. История открытия 1. Первое упоминание – алхимик Гебер (при нагревании квасцов перегоняется «спирт», обладающий сильной растворя-
- 10. Серная кислота в природе Кислотное озеро на глубине вулкана Малый Семячик Кипящее озеро (Курильские острова) Европа
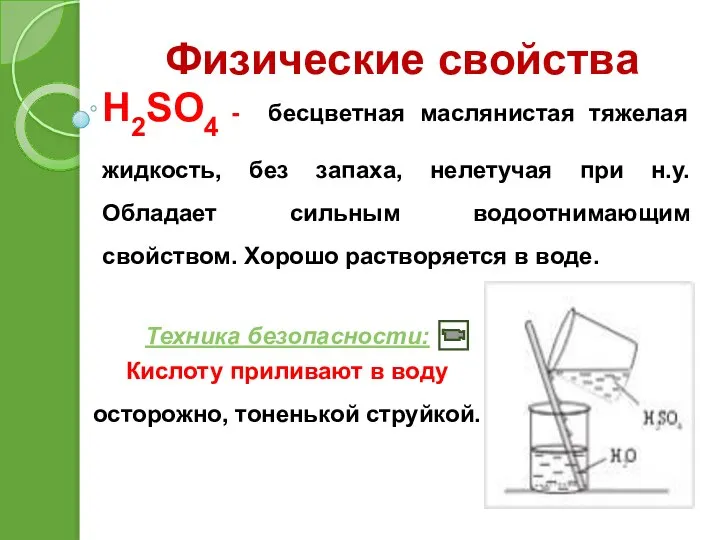
- 11. Физические свойства H2SO4 - бесцветная маслянистая тяжелая жидкость, без запаха, нелетучая при н.у. Обладает сильным водоотнимающим
- 12. Разбавление серной кислоты
- 13. Химические свойства
- 14. Химические свойства разбавленной H2SO4
- 15. Химические свойства разбавленной H2SO4 1. Взаимодействие с металлами (Стоящими до Н в ЭРНМ) Zn + H2SO4
- 16. Химические свойства разбавленной H2SO4 2. Взаимодействие с основными и амфотерными оксидами H2SO4 + CuO = CuSO4
- 17. Химические свойства разбавленной H2SO4 3. Взаимодействие с основаниями: а) щелочами H2SO4 + 2NaOH = Na2SO4 +
- 18. Химические свойства разбавленной H2SO4 4. Взаимодействие с солями H2SO4 + BaCl2 = BaSO4↓+ 2HCl 2H+ +
- 19. Химические свойства концентрированной H2SO4 Концентрированная H2SO4 - сильный окислитель за счет S(+6) 1. Взаимодействие с металлами
- 20. Взаимодействие концентрированной серной кислоты с металлами
- 21. Химические свойства концентрированной H2SO4 2. Взаимодействие с неметаллами 2H2SO4 + C = CO2 + 2SO2 +
- 22. Гигроскопичность серной кислоты
- 23. Применение H2SO4 HNO3 Производство кислот Взрывчатые вещества Электролитическая медь Минеральные удобрения Лекарства Производство солей Искусственный шелк
- 24. Соли серной кислоты
- 25. Тест 1. Концентрированная серная кислота при комнатной температуре не действует на каждое из двух веществ: А)
- 26. Тест (ответы) 1 – Г 2 – Б 3 – Г 4 – А
- 27. Продолжите предложение
- 28. Домашнее задание Параграф 27 (с. 197-202). Выполнение домашнего задания по уровням: «3» - с. 204 №
- 30. Скачать презентацию
























 Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. (Лекция 50.15)
Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. (Лекция 50.15) Протолитические равновесия в растворах электролитах
Протолитические равновесия в растворах электролитах Смеси и растворы
Смеси и растворы Микробты липидтерді алу
Микробты липидтерді алу ДНК і РНК - нуклеїнові кислоти
ДНК і РНК - нуклеїнові кислоти Соли угольной кислоты
Соли угольной кислоты Презентация по Химии "Охорона навколишнього середовища під час виробництва і використання металів" - скачать смотреть беспла
Презентация по Химии "Охорона навколишнього середовища під час виробництва і використання металів" - скачать смотреть беспла Сульфати Підготувала учениця 8 – В Грошева Олександра
Сульфати Підготувала учениця 8 – В Грошева Олександра Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз
Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз ХРОМ Учитель химии МБОУ лицей №1 г. Волжский Волгоградская область Солдатова Татьяна Михайловна.
ХРОМ Учитель химии МБОУ лицей №1 г. Волжский Волгоградская область Солдатова Татьяна Михайловна.  Презентация по Химии "Золото" - скачать смотреть бесплатно
Презентация по Химии "Золото" - скачать смотреть бесплатно Алканы. Хлороформ
Алканы. Хлороформ Радиоактивные превращения . Закон радиоактивного распада.
Радиоактивные превращения . Закон радиоактивного распада. Непредельные углеводороды
Непредельные углеводороды Корень как часть слова
Корень как часть слова  Металлы и неметаллы
Металлы и неметаллы Ванадатты фосфаттар. Орынбасар фосфаттар. Төменгі оксоқышқылдар
Ванадатты фосфаттар. Орынбасар фосфаттар. Төменгі оксоқышқылдар Гидроксиды металлов
Гидроксиды металлов Cвойства цементного камня с введением кольматирующей добавки системы Пенетрон-Адмикс
Cвойства цементного камня с введением кольматирующей добавки системы Пенетрон-Адмикс Средства для борьбы с бытовыми насекомыми
Средства для борьбы с бытовыми насекомыми Спирты и их влияние на здоровье человека
Спирты и их влияние на здоровье человека Электролитическая диссоциация
Электролитическая диссоциация Теоретическая кинетика. Влияние температуры на скорость реакции. Правило Вант-Гоффа
Теоретическая кинетика. Влияние температуры на скорость реакции. Правило Вант-Гоффа Почему вода в море солёная
Почему вода в море солёная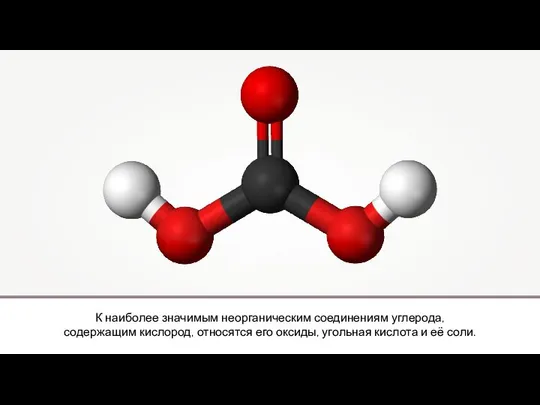 Кислородные соединения углерода
Кислородные соединения углерода Кристаллография. История развития
Кристаллография. История развития Карбонові кислоти
Карбонові кислоти Углекислый газ
Углекислый газ