Содержание
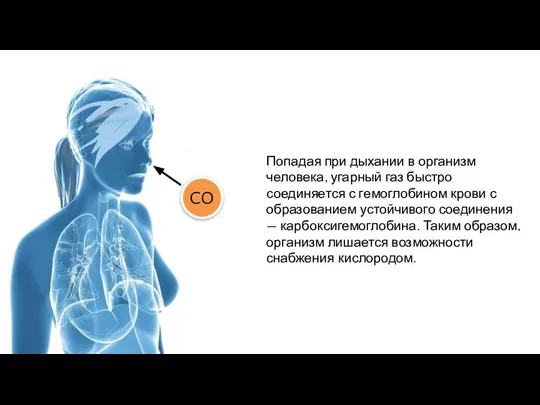
- 2. CO
- 3. Попадая при дыхании в организм человека, угарный газ быстро соединяется с гемоглобином крови с образованием устойчивого
- 4. Угарный газ образуется при неполном сгорании топлива или при недостатке кислорода в воздухе. 2С + О2
- 7. СО взаимодействует с кислородом: 2СО + О2 = 2СО2↑ Взаимодействуя с оксидами металлов СО восстанавливает металл
- 9. Из углекислого газа делают «сухой лёд», который используют для хранения пищевых продуктов.
- 10. СО2 является солеобразующим оксидом. Углекислый газ обладает свойствами типичными для кислотных оксидов: СО2 + 2NaOH =
- 11. Углекислый газ не поддерживает процессы дыхания и горения. По этой причине его применяют для тушения пожаров.
- 12. Получение СО2 2HCl + CaCO3 = CaCl2 + H2O + CO2↑ Лабораторный способ: СаСО3 = СаО
- 13. Углекислый газ используют для производства газированных напитков, а также для получения соды.
- 14. При растворении СО2 в воде образуется слабая двухосновная угольная кислота: СО2 + Н2О = Н2СО3 Na2CO3,
- 15. Карбонаты и гидрокарбонаты способны переходить друг в друга: СаСО3 + Н2О + СО2 = Са(НСО3)2 Са(НСО3)2
- 16. Временная жёсткость воды обусловлена наличием в ней гидрокарбонатов магния и кальция. Са(НСО3)2 = СаСО3↓ + Н2О
- 18. Скачать презентацию













 Тесты по неорганической химии
Тесты по неорганической химии Характеристика ПМ общетехнического, инженерного и констркуционного назначения
Характеристика ПМ общетехнического, инженерного и констркуционного назначения Серная кислота и её соли, применение
Серная кислота и её соли, применение Лекция № 14. Виды лакокрасочных составов, свойства и применение
Лекция № 14. Виды лакокрасочных составов, свойства и применение Homecredit Bank. Показатели и зоны роста
Homecredit Bank. Показатели и зоны роста Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4)
Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4) Дисахаридттер. Сахароза
Дисахаридттер. Сахароза Изучение растворимости веществ. Приготовление растворов и анализ состава растворов путем выпаривания
Изучение растворимости веществ. Приготовление растворов и анализ состава растворов путем выпаривания Химические свойства и применение алканов 10 класс Презентацию подготовила учитель химии МОУ «СОШ с. Тёпловка Новобурасского ра
Химические свойства и применение алканов 10 класс Презентацию подготовила учитель химии МОУ «СОШ с. Тёпловка Новобурасского ра Защита полимеров от старения
Защита полимеров от старения Чистые вещества и смеси. 5 класс
Чистые вещества и смеси. 5 класс Презентация по Химии "История развития химии" - скачать смотреть бесплатно
Презентация по Химии "История развития химии" - скачать смотреть бесплатно Электронное и пространственное строение молекул органических соединений – основа биологической активности
Электронное и пространственное строение молекул органических соединений – основа биологической активности Презентация по Химии "Самородки" - скачать смотреть
Презентация по Химии "Самородки" - скачать смотреть  Характеристика дефектов. Растворы влияющие на степень износа тканей
Характеристика дефектов. Растворы влияющие на степень износа тканей Моно- та дикарбонові кислоти. Функціональні похідні карбонових кислот
Моно- та дикарбонові кислоти. Функціональні похідні карбонових кислот Электролиз воды
Электролиз воды епло- и массообмен в химической технологии
епло- и массообмен в химической технологии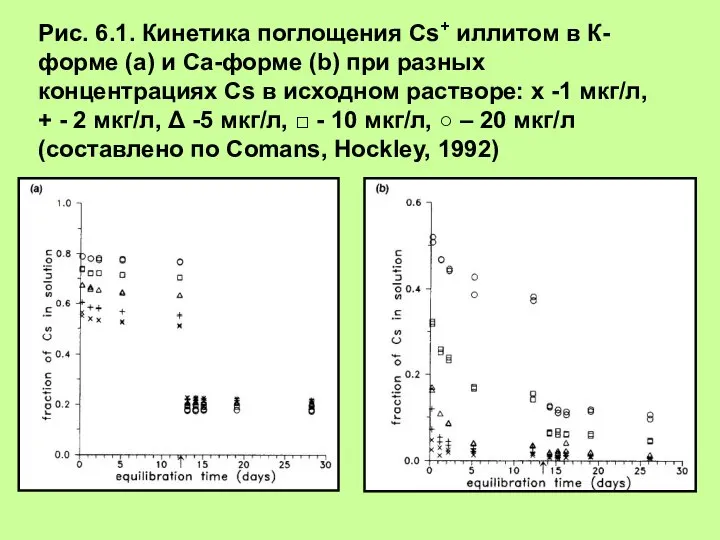 Определение коэффициента селективности при бинарном обмене
Определение коэффициента селективности при бинарном обмене Презентация по Химии "Хімія в медицині" - скачать смотреть бесплатно
Презентация по Химии "Хімія в медицині" - скачать смотреть бесплатно Высокопроизводительное моторное масло для бензиновых и дизельных двигателей
Высокопроизводительное моторное масло для бензиновых и дизельных двигателей ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна
ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна  Синтетические топлива
Синтетические топлива Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химические Недотроги
Химические Недотроги  Хроматография талдау әдістері
Хроматография талдау әдістері Алкадиены. Строение, изомерия, номенклатура, физические и химические свойства
Алкадиены. Строение, изомерия, номенклатура, физические и химические свойства Способы получения оксидов, оснований, кислот и солей. Урок №2
Способы получения оксидов, оснований, кислот и солей. Урок №2