Содержание
- 2. Сероводоро́д, сернистый водород (H2S) (физические свойства) Химическая формула - Относит. молек. масса - Молярная масса -
- 3. Сероводоро́д, сернистый водород (физические свойства) Химическая формула - H2S Относит. молек. масса - 34 а. е.
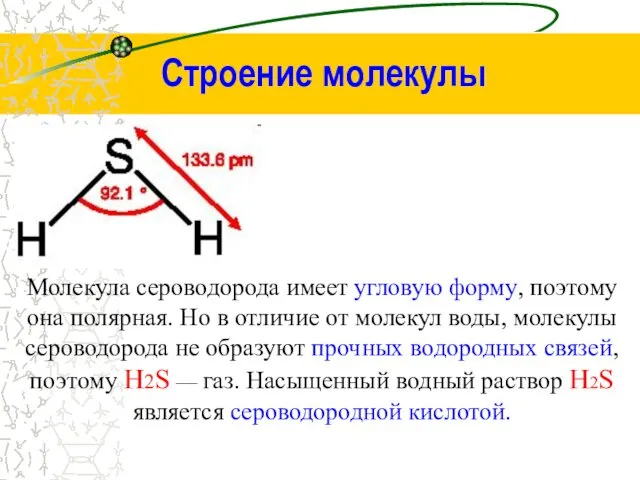
- 4. Строение молекулы Молекула сероводорода имеет угловую форму, поэтому она полярная. Но в отличие от молекул воды,
- 5. Откуда сероводород в Черном море? CaSO4 + CH4 => CaS + CO2 + 2H2O CaS +
- 6. Химические свойства Проявляет все свойства кислот. с основными оксидами: H2S + CaO = CaS + H2O
- 7. с солями: CuCl2+ H2S = CuS↓ + 2HCl с металлами: Ca + H2S = CaS +
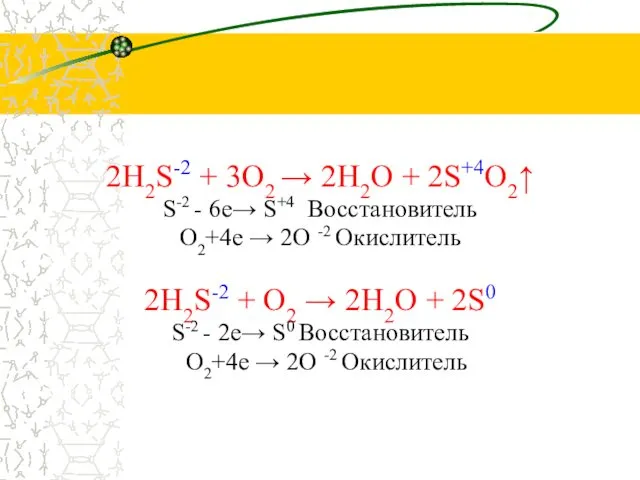
- 8. 2H2S-2 + 3O2 → 2H2O + 2S+4O2↑ S-2 - 6е→ S+4 Восстановитель O2+4е → 2O -2
- 9. Качественная реакция на сульфид-ион Pb(NO3)2 + Na2S → PbS↓ + 2NaNO3 осадок черного цвета Na2S +
- 10. Получение В лаборатории обычно получают действием разбавленных кислот на сульфиды: FeS + 2HCl = FeCl2 +
- 11. Применение Сероводород из-за своей токсичности находит ограниченное применение: - в аналитической химии сероводород и сероводородная вода
- 12. Токсикология Очень токсичен. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно
- 14. Скачать презентацию









 Электрохимия. Электродные потенциалы
Электрохимия. Электродные потенциалы Каталитический риформинг
Каталитический риформинг Новогаленовые. Максимально очищенные экстракционные препараты
Новогаленовые. Максимально очищенные экстракционные препараты Химия гетероциклических соединений. Трехчленные циклы
Химия гетероциклических соединений. Трехчленные циклы Вакуумная перегонка мазута
Вакуумная перегонка мазута Жиры. Тема 2.5
Жиры. Тема 2.5 Основные законы в химии
Основные законы в химии Математический аппарат квантовой механики
Математический аппарат квантовой механики Химическая игра Своя игра
Химическая игра Своя игра Основы теории плавления и отвердевания металлов
Основы теории плавления и отвердевания металлов Чистые вещества и смеси. Уголь и вода
Чистые вещества и смеси. Уголь и вода ПРИРОДНИЙ ГАЗ
ПРИРОДНИЙ ГАЗ  Дослід Ознайомлення зі змістом етикеток харчових продуктів
Дослід Ознайомлення зі змістом етикеток харчових продуктів  Классификация моторных масел по стандартам API
Классификация моторных масел по стандартам API Степень окисления
Степень окисления Роль химии в нашей жизни
Роль химии в нашей жизни Термические превращения углеводородов и других компонентов нефти
Термические превращения углеводородов и других компонентов нефти Методы анализа живых систем, группы методов
Методы анализа живых систем, группы методов Гликогенді және кетогенді аминқышқылдары. Биологиялық рөлі
Гликогенді және кетогенді аминқышқылдары. Биологиялық рөлі Свойства кислот Сульфура H2SO4, H2SO3, H2S
Свойства кислот Сульфура H2SO4, H2SO3, H2S Полимерные материалы и изделия. (Лекция 16)
Полимерные материалы и изделия. (Лекция 16) Изопроцессы в идеальном газе
Изопроцессы в идеальном газе Обратимость химических реакций. Химическое равновесие, условия его смещения
Обратимость химических реакций. Химическое равновесие, условия его смещения Значення хімії у повсякденному житті Значення хімії у побуті
Значення хімії у повсякденному житті Значення хімії у побуті  Оксиды азота
Оксиды азота Презентация по Химии "«Самородки»" - скачать смотреть
Презентация по Химии "«Самородки»" - скачать смотреть  «Көмірсулар» Қайталау сабағы
«Көмірсулар» Қайталау сабағы Обмен аминокислот и белков
Обмен аминокислот и белков