Содержание
- 2. Ве - амфотерный «сладкий» (1797г. Вокелен, 1828 Вёлер); Mg – «магнезия» (1808г. Дэви, 1829г. Бюсси); Сa,
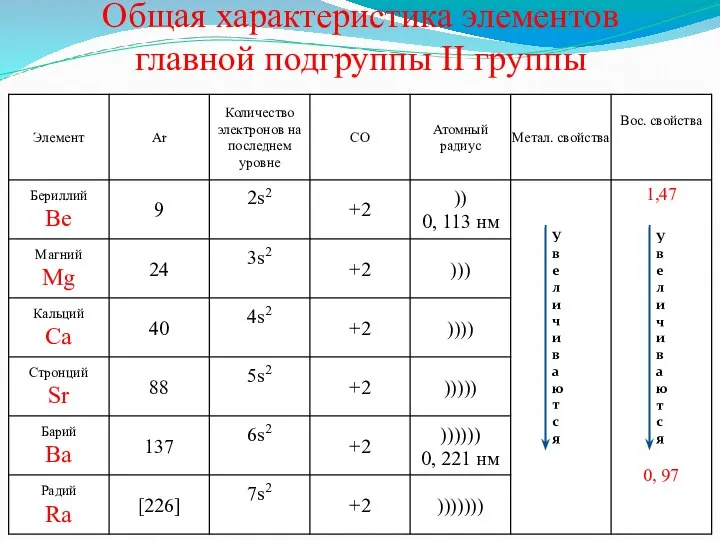
- 3. Общая характеристика элементов главной подгруппы II группы У в е л и ч и в а
- 4. Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя – ns2 Элементы проявляют
- 5. Be – светло-серый, твердый, хрупкий Ca – твердый, пластичный Mg – относительно мягкий, пластичный, ковкий Sr
- 6. Физические свойства ЩЗ металлов
- 7. Химические свойства
- 9. Химические свойства оксидов BeO – амфотерный оксид MgO CaO SrO BaO Основные оксиды
- 10. Химические свойства амфотерных оксидов С кислотами, образуя соль и воду: ВеO + 2HCl = ВеCl2 +
- 11. Взаимодействие с кислотами, с образованием соли и воды: MgO + 2HCl = MgCl2 + H2O 2.
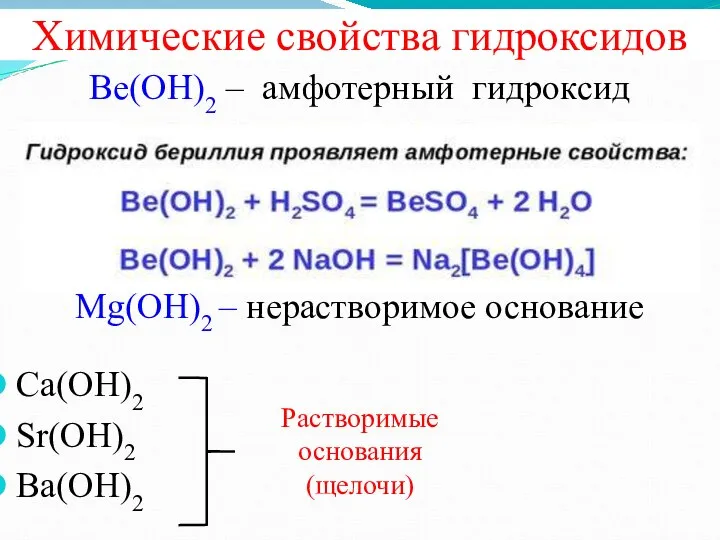
- 12. Химические свойства гидроксидов Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое основание Ca(OH)2 Sr(OH)2 Ba(OH)2 Растворимые основания
- 13. Химические свойства 1. Изменяют окраску индикатора: Сa(OH)2 + фенолфталеин → малиновая окраска Сa(OH)2 + лакмус →
- 16. Скачать презентацию











 Химические элементы человеческого организма и их свойства
Химические элементы человеческого организма и их свойства Хочу хорошо сдать ЕГЭ
Хочу хорошо сдать ЕГЭ Дисперсные системы
Дисперсные системы Praktická cvičení z biochemie
Praktická cvičení z biochemie Бионеорганическая химия. Биогенные элементы. (Лекция 5.2)
Бионеорганическая химия. Биогенные элементы. (Лекция 5.2) Неорганические вещества клетки
Неорганические вещества клетки Органические вяжущие. Битумы
Органические вяжущие. Битумы Хімія в житті людини
Хімія в житті людини Солюбилизация в прямых мицеллах ПАВ
Солюбилизация в прямых мицеллах ПАВ Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Валериановая кислота
Валериановая кислота Синтетические каучуки, строение, свойства, применение.
Синтетические каучуки, строение, свойства, применение. Щелочные металлы
Щелочные металлы The law of mass conservation
The law of mass conservation Жиры и мыло
Жиры и мыло Radical Approach to the Chiral Quaternary Center in Asperaculin A: Synthesis of 9‑Deoxyasperaculin A
Radical Approach to the Chiral Quaternary Center in Asperaculin A: Synthesis of 9‑Deoxyasperaculin A Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Етиловий спирт та його вплив на організм людини
Етиловий спирт та його вплив на організм людини Валентность. Порядок действий при составлении химической формулы
Валентность. Порядок действий при составлении химической формулы Мыло. Компоненты мыла
Мыло. Компоненты мыла Презентация по Химии "История открытия периодического закона и его экспериментальное подтверждение" - скачать смотреть
Презентация по Химии "История открытия периодического закона и его экспериментальное подтверждение" - скачать смотреть  Нуклеиновые кислоты История открытия Строение Функции Свойства
Нуклеиновые кислоты История открытия Строение Функции Свойства  Wybrane sybstancje chemiczne i ich działanie
Wybrane sybstancje chemiczne i ich działanie Натрій. Знаходження в періодичній системі і основні характеристики
Натрій. Знаходження в періодичній системі і основні характеристики Жёсткость воды и способы её устранения
Жёсткость воды и способы её устранения Циклоалканы. Физические свойства циклоалканов
Циклоалканы. Физические свойства циклоалканов Көмірсулар. Моносахаридтер. Жіктелуі. Гексозалар. Құрылысы
Көмірсулар. Моносахаридтер. Жіктелуі. Гексозалар. Құрылысы Минералы. Классы минералов
Минералы. Классы минералов