Содержание
- 2. Актуальность По мере истощения мировых запасов невозобновляемого топлива (нефти, угля и газа), ученые все активнее работают
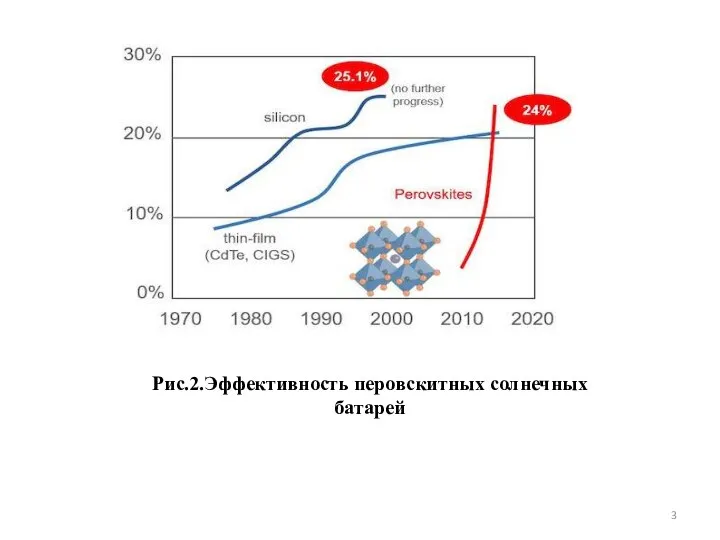
- 3. Рис.2.Эффективность перовскитных солнечных батарей
- 4. Цели и задачи Цель работы: изучить синтез оксида меди и йодида меди для формирования буферных слоев
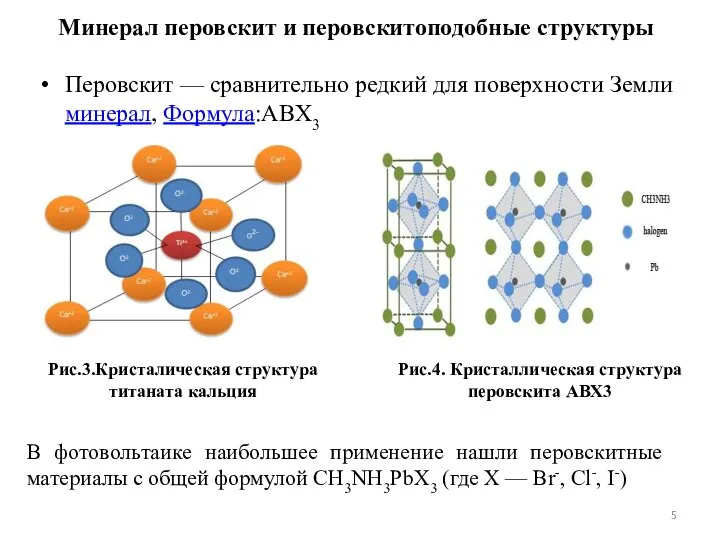
- 5. Перовскит — сравнительно редкий для поверхности Земли минерал, Формула:ABX3 Рис.3.Кристалическая структура титаната кальция Рис.4. Кристаллическая структура
- 6. Используемые буферные слой для переноса носителей зарядов p-слой – HTM - hole transport material (материал, служащий
- 7. Причины создания буферного слоя из оксида и йодида меди В основе выбора оксида и йодида меди
- 8. Оксид меди - полупроводник. Он является промежуточным проводником, где электричество может течь свободно, и изолятор, где
- 9. Преимущества Главным преимуществом перовскитов является то, что они могут быть изготовлены из обычных металлов и промышленных
- 10. Еще одним важным достоинством перовскитов является их стабильность. Даже в условиях непрерывного освещения преобразование тока уменьшается
- 11. Получение оксида меди (Ⅰ) 4Cu + O2 → 2Cu2O (200℃) 2Cu + N2O → Cu2O +
- 12. Получение йодида меди (Ⅰ) Способ 1. 2CuSO4·5Н2O + 2KI + 2Na2S2O3·5Н2O => 2CuI + K2SO4 +
- 13. Экспериментальная часть Получение оксида меди Ⅰ. Рис.6.Глюкоза (слева глюкоза, справа приготовленный раствор глюкозы)
- 14. Далее был приготовлен раствор Cu(OH)2. CuSO4+NaOH→Cu(OH)2+Na2SO4 Рис.7. Раствор Cu(OH)2
- 15. C6H12O6+Cu(OH)2→C6H12O6+Cu2O+H2O Рис.8. Полученный раствор до начала нагревания Рис.9.Полученный раствор Cu2O (после нагревания)
- 17. Скачать презентацию












 Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування
Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування Презентация по Химии "Разрешите вам представить - иод" - скачать смотреть
Презентация по Химии "Разрешите вам представить - иод" - скачать смотреть  Строение белков и их значение для организма “Жизнь – форма существования белковых тел.”
Строение белков и их значение для организма “Жизнь – форма существования белковых тел.” Кремний (Silicium). Химические свойства
Кремний (Silicium). Химические свойства Предельные углеводороды
Предельные углеводороды Нефть. Состав и свойства
Нефть. Состав и свойства Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Неорганические полимеры
Неорганические полимеры Атоми і хімічні елементи. Молекули, їх рух. Дифузія
Атоми і хімічні елементи. Молекули, їх рух. Дифузія Понятие об ЭДС Электролиты и неэлектролиты электролитическая диссоциация
Понятие об ЭДС Электролиты и неэлектролиты электролитическая диссоциация Электрофизические и электрохимические методы обработки материалов
Электрофизические и электрохимические методы обработки материалов Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Шкала рН
Шкала рН Кислородосодержащие соединения - спирты
Кислородосодержащие соединения - спирты Твердое тело и его характеристики. Закон Гука. Плавление и кристаллизация. Лекция №26
Твердое тело и его характеристики. Закон Гука. Плавление и кристаллизация. Лекция №26 Методика проведения исследовательской части работы по химии и экологии учитель химии и биологии высшей
Методика проведения исследовательской части работы по химии и экологии учитель химии и биологии высшей Metode cromatografice
Metode cromatografice Типы окисления. Понятие об антиоксидантной системе
Типы окисления. Понятие об антиоксидантной системе  Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Хімічні властивості карбонових кислот
Хімічні властивості карбонових кислот Общий путь катаболизма. (Лекция 9)
Общий путь катаболизма. (Лекция 9) Галогены. История открытия галогенов
Галогены. История открытия галогенов Репликация ДНК и РНК
Репликация ДНК и РНК Горение топлива
Горение топлива Основи прийняття рішень, щодо захисту населення під час різних фаз радіаційної аварії. Критерії для прийняття рішень
Основи прийняття рішень, щодо захисту населення під час різних фаз радіаційної аварії. Критерії для прийняття рішень Общая характеристика неметаллов
Общая характеристика неметаллов Термодинамика и термохимия процессов горения и взрыва
Термодинамика и термохимия процессов горения и взрыва