Содержание
- 2. Основные функции воды в организме Обеспечение процессов всасывания и механического передвижения питательных веществ Поддержание оптимального осмотического
- 3. Изменение теплоемкости воды в зависимости от температуры
- 4. Значение растворов в жизнедеятельности организмов. Важнейшие биологические жидкости - кровь, лимфа моча, слюна, пот являются растворами
- 5. Отвечают за осмолярность (концентрацию всех видов ионов) и величину ионной силы биосред Значение электролитов в организме
- 6. Схема действия Na+-, К+-АТФ-фазы и возникновение разности потенциалов на клеточных мембранах Потенциал покоя клеточных мембран –
- 7. Участие активного центра карбоангидразы в гидратации углекислого газа При поступлении крови в легкие карбоангидраза эритроцитов расщепляет
- 8. Участвуют в свертывающей системы крови
- 9. Образование защитного эмалевого слоя Лечение кариеса фторидами Стабилизируют костные ткани
- 10. Какие б чувства не таились Тогда во мне - теперь их нет: Они прошли иль изменились...
- 11. КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ Имеющую огромное значение для химии чистую воду... можно рассматривать как слабую кислоту или слабое
- 12. При 25 °С Кд =1.8·10 -16 Концентрацию молекул воды как в чистой воде, так и в
- 13. В соответствии с принципом Ле Шателье при добавлении кислот или оснований равновесие H2O ↔ H+ +
- 14. Диссоциация воды - эндотермический процесс, следовательно, Kw растет с повышением температуры: Для наглядности удобно использовать величину
- 15. Для удобства в расчетах пользуются величинами водородного и гидроксильного показателей - рH и рОН, pH -
- 17. Для чистой воды рН=7 Дождевая вода за счет растворенного СО2 имеет рН ~ 5.5 – 6.0
- 18. Памятник Джорджу Вашингтону в Нью-Йорке в момент открытия и через 60 лет Мрамор СаСО3 под действием
- 19. Бронзовый памятник во влажном воздухе медленно покрывается налетом основного карбоната меди (СuOH)2CO3
- 20. Александр Федорович Тур (1894–1974) 1930-1934 -заведующий кафедрой физиологии, гигиены и диететики ребенка 1934-1939 - заведующий кафедрой
- 21. Наличие белкового буфера в составе слез поддерживает рН в пределах физиологической нормы !
- 22. Электролиты – вещества, растворы и расплавы которых проводят электрический ток вследствие диссоциации на ионы. Расчет рН
- 23. Сильные электролиты диссоциируют полностью, необратимо, в одну ступень. a – активность иона f – коэффициент активности,
- 25. К сильным электролитам относятся: 1. Кислоты - НСI , НВг , HI , H2SО4 , H2S2O7
- 27. Ионная сила растворов Ионная сила растворов - величина, измеряемая полусуммой произведений концентраций всех находящихся в растворе
- 28. Уравнение Дебая-Хюккеля Дебай Петер (24.III.1884–2.XI.1966) Йозеф Хюккель (9.09.1896— 16.021980)
- 29. Слабые электролиты диссоциируют а) обратимо б) ступенчато
- 30. Степень диссоциации (ионизации) - отношение числа молекул, распавшихся на ионы, к общему числу молекул в растворе.
- 31. Закон разведения Оствальда Нобелевская премия (1909г) « в знак признания работ по катализу, а также за
- 32. При α Вывод закона разведения Оствальда
- 33. 2. Степень диссоциации кислоты HX равна 0,25. Какое суммарное число ионов H+ и X- приходится в
- 34. Расчет рН в растворах сильных электролитах Рассчитать рН, рОН, [OH-] для 0,001 м НNO3 рН =
- 35. Задача 1. рН яблочного сока равен 4,57. Найти [Н+] и [OH-] (моль/л). рОН = 14 -
- 37. Расчет [ Н+] и рН для растворов слабых электролитов Кислоты Смесь кислот
- 38. Для смеси оснований Основания
- 39. Задача 2. Найти рН, [Н+] и [OH-] 0,3 м раствора муравьиной кислоты (Кд=1.8∙10-4) рН = –
- 40. Общая, активная и потенциальная кислотность Активная кислотность – концентрация свободных катионов Н+, имеющихся в растворе при
- 43. Скачать презентацию
































![Расчет рН в растворах сильных электролитах Рассчитать рН, рОН, [OH-] для](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447450/slide-33.jpg)
![Задача 1. рН яблочного сока равен 4,57. Найти [Н+] и [OH-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447450/slide-34.jpg)

![Расчет [ Н+] и рН для растворов слабых электролитов Кислоты Смесь кислот](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447450/slide-36.jpg)

![Задача 2. Найти рН, [Н+] и [OH-] 0,3 м раствора муравьиной](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447450/slide-38.jpg)


 Аттестационная работа. Исследовательская работа Выращивание кристаллов
Аттестационная работа. Исследовательская работа Выращивание кристаллов Презентация по Химии "синтетичні миючі засоби" - скачать смотреть бесплатно
Презентация по Химии "синтетичні миючі засоби" - скачать смотреть бесплатно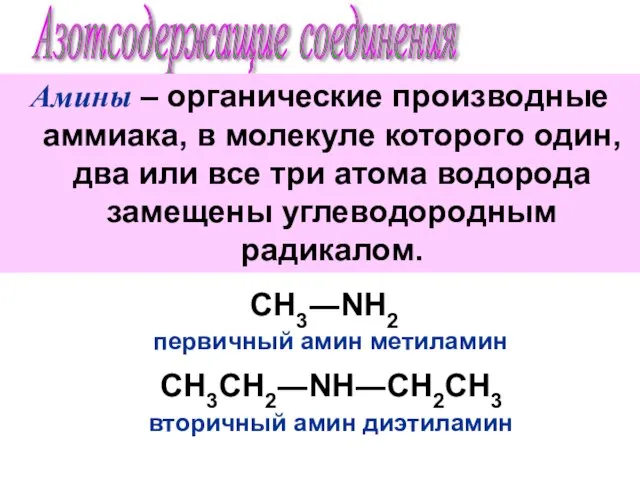 Азотсодержащие соединения. Амины
Азотсодержащие соединения. Амины Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Хроматографические методы анализа. Метод газовой хроматографии
Хроматографические методы анализа. Метод газовой хроматографии Дисахаридттер. Сахароза
Дисахаридттер. Сахароза Зарождение научной химии в России в XVI XVIII веках. История и методология химии. Лекция 9
Зарождение научной химии в России в XVI XVIII веках. История и методология химии. Лекция 9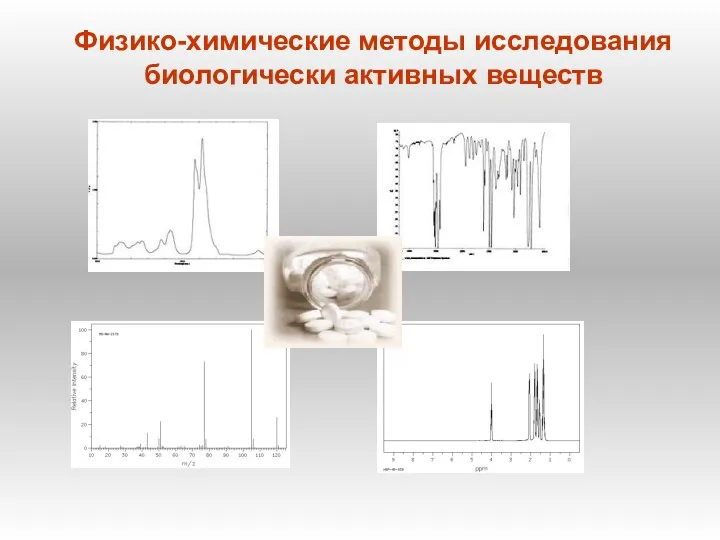 Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Алкадиены. Непредельные углеводороды
Алкадиены. Непредельные углеводороды Углеводороды. Алканы
Углеводороды. Алканы Алюминий и его соединения
Алюминий и его соединения Кристаллические системы
Кристаллические системы Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Методические подходы к формированию и развитию личностных качеств учащихся на уроках химии
Методические подходы к формированию и развитию личностных качеств учащихся на уроках химии Полимеры, пластмассы и товары на их основе
Полимеры, пластмассы и товары на их основе Биохимия соединительной ткани
Биохимия соединительной ткани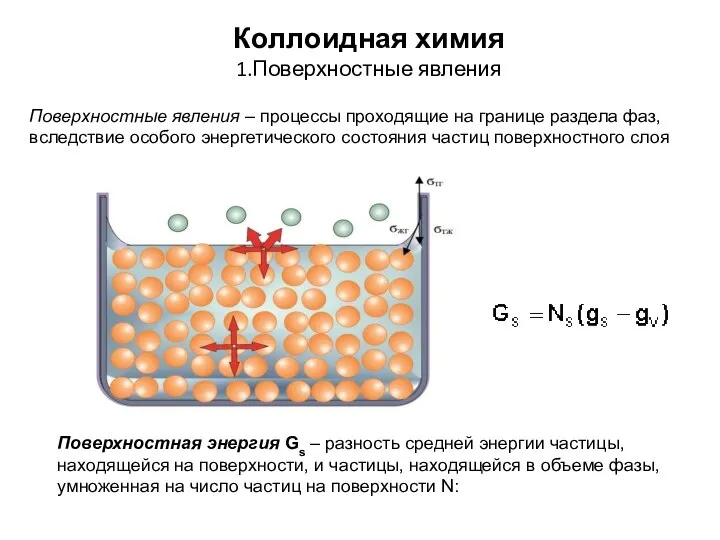 Коллоидная химия. Поверхностные явления
Коллоидная химия. Поверхностные явления Рефрактометрия как экспресс-метод определения лекарственных средств
Рефрактометрия как экспресс-метод определения лекарственных средств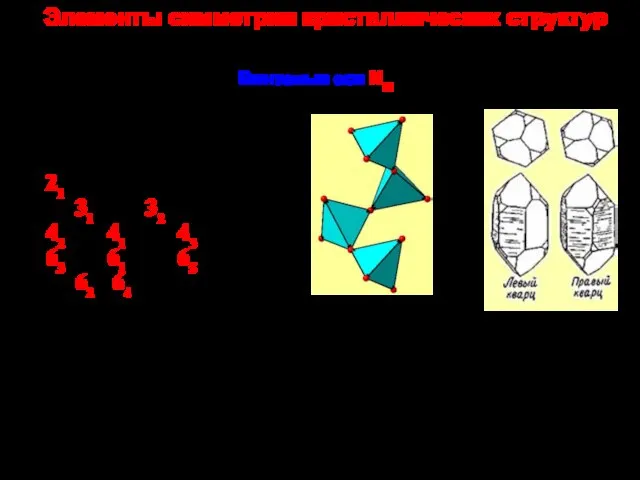 Элементы симметрии кристаллических структур
Элементы симметрии кристаллических структур Фотохимический смог и химизм его образования
Фотохимический смог и химизм его образования Строение атома
Строение атома Химия и Первая Мировая Война
Химия и Первая Мировая Война Презентация по Химии "Химия. Классификация химических реакций" - скачать смотреть бесплатно
Презентация по Химии "Химия. Классификация химических реакций" - скачать смотреть бесплатно Исследовательский проект «Кристаллы»
Исследовательский проект «Кристаллы» ЕГЭ. Химия. Содержательный блок Химический элемент. Вопрос А1, А 2
ЕГЭ. Химия. Содержательный блок Химический элемент. Вопрос А1, А 2 Тагер. Физико-химия полимеров
Тагер. Физико-химия полимеров Элементы третьего периода, периодической системы Д. И. Менделеева
Элементы третьего периода, периодической системы Д. И. Менделеева