Содержание
- 2. Гомогенные и гетерогенные системы Гетерогенные системы Фаза – совокупность всех гомогенных частей системы, одинаковых по составу
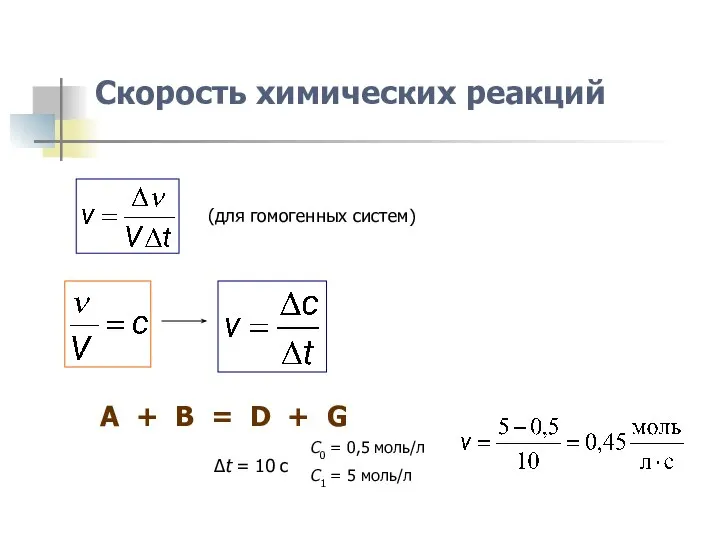
- 3. Скорость химических реакций (для гомогенных систем) A + B = D + G C0 = 0,5
- 4. Скорость химических реакций (для гомогенных систем) A + B = D + G C0 = 2
- 5. Факторы, от которых зависит скорость реакции Природа реагирующих веществ Концентрация веществ в системе Площадь поверхности (для
- 6. Влияние температуры Правило Вант-Гоффа При нагревании системы на 10 ˚С скорость реакции возрастает в 2-4 раза
- 7. Катализ Йенс Якоб Берцелиус ввел термин «катализ» в 1835 г. Катализатор – вещество, изменяющее скорость реакции,
- 8. Механизм разложения пероксида водорода 2H2O2 = 2H2O + O2 (1) H2O2 = H+ + HO2- (2)
- 9. Разложение H2O2 в присутствии Fe3+ H2O2 = H+ + HO2- HO2- + Fe3+ = Fe2+ +
- 10. 17 белых верблюдов Кай Линдерстрём-Ланг (1896-1959) Притча о катализе + 1 черный верблюжонок 1/2 1/3 1/9
- 11. Терминология Катализ, катализатор Ингибитор Промоторы Каталитические яды Гомогенный и гетерогенный катализ Ферменты
- 12. Особенности ферментативного катализа Высокая избирательность и специфичность катализатора Жесткие требования к условиям протекания реакций Классификация ферментов
- 13. Теперь к вопросам ЕГЭ!
- 14. A20 На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния 1) концентрация
- 15. A20 Для увеличения скорости химической реакции Mg (тв.) + 2H+ = Mg2+ + H2(г.) необходимо 1)
- 16. A20 C наибольшей скоростью при обычных условиях протекает реакция 1) 2Ba + O2 = 2BaO 2)
- 17. A20 Для увеличения скорости реакции 2CO + O2 = 2CO2 + Q необходимо 1) увеличить концентрацию
- 18. A20 Для увеличения скорости реакции Zn (тв.) + 2H+ = Zn2+ + H2(г.) необходимо 1) уменьшить
- 19. 1) Zn + HCl (5%p-p) 2) Zn + HCl (10%p-p) 3) Zn + HCl (20%p-p) 4)
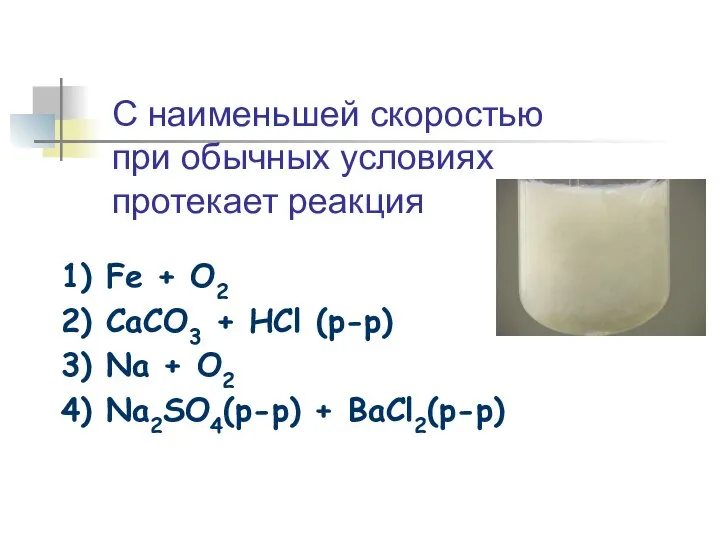
- 20. 1) Fe + O2 2) CaCO3 + HCl (p-p) 3) Na + O2 4) Na2SO4(p-p) +
- 21. А20 Скорость реакции железа с азотной кислотой не зависит от 1) наличия ингибитора 2) концентрации азотной
- 22. А20 Скорость реакции известняка с раствором кислоты увеличивается при 1) понижении температуры 2) измельчении известняка 3)
- 23. А20 С наибольшей скоростью при комнатной температуре происходит взаимодействие 1) цинка с разбавленной уксусной кислотой 2)
- 24. А20 Изменение площади поверхности соприкосновения реагирующих веществ влияет на скорость реакции 1) CO + 2H2 →
- 25. А20 С наибольшей скоростью при комнатной температуре происходит взаимодействие 1) цинка с разбавленной уксусной кислотой 2)
- 27. Скачать презентацию






















 Основания
Основания Анаболические стероиды
Анаболические стероиды Ion exchange
Ion exchange Общая характеристика элементов IIIA-группы. Бор. Алюминий
Общая характеристика элементов IIIA-группы. Бор. Алюминий Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Презентация по Химии "Термодинамика и электрохимия" - скачать смотреть бесплатно
Презентация по Химии "Термодинамика и электрохимия" - скачать смотреть бесплатно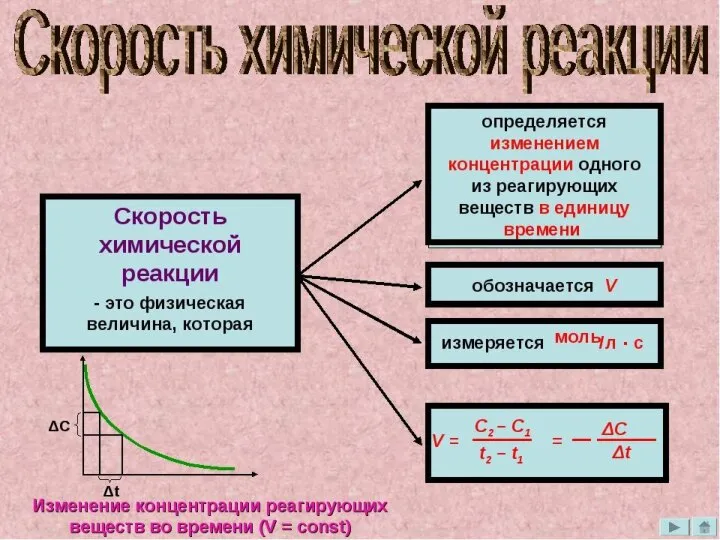 Скорость химичесой реакции и химическое равновесие
Скорость химичесой реакции и химическое равновесие Физические и физико-химические свойства и характеристики грунтов. (Лекция 2)
Физические и физико-химические свойства и характеристики грунтов. (Лекция 2) Металлы, их свойства и область применения
Металлы, их свойства и область применения Сложные эфиры. Жиры
Сложные эфиры. Жиры A quantum computer
A quantum computer Способы выражения состава раствора. Решение задач
Способы выражения состава раствора. Решение задач Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия
Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия Органика вокруг нас
Органика вокруг нас «Контейнерная химия»: комплексоны, комплексообразование, применение
«Контейнерная химия»: комплексоны, комплексообразование, применение Тема: физико-химический анализ хлеба. Цель: Физико - химический анализ разных разных сортов хлеба. Задачи: 1.Определить физико-хими
Тема: физико-химический анализ хлеба. Цель: Физико - химический анализ разных разных сортов хлеба. Задачи: 1.Определить физико-хими Карбоновые кислоты
Карбоновые кислоты Синтетические органические соединения
Синтетические органические соединения Развитие теории восстановления металлов
Развитие теории восстановления металлов Спирты
Спирты Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Увлекательная химия
Увлекательная химия Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Общая химия
Общая химия Презентация по Химии "Кристалл – основа жизни на земле" - скачать смотреть
Презентация по Химии "Кристалл – основа жизни на земле" - скачать смотреть