Содержание
- 2. Соединения железа
- 3. В ПРИРОДЕ ЖЕЛЕЗО РЕДКО ВСТРЕЧАЕТСЯ В ЧИСТОМ ВИДЕ, ЧАЩЕ ВСЕГО ОНО ВСТРЕЧАЕТСЯ В СОСТАВЕ ЖЕЛЕЗО-НИКЕЛЕВЫХ МЕТЕОРИТОВ.
- 4. Гематит (кровавик) красный железняк Fe2O3 Магнети́т (магнитный железняк) FeO•Fe2O3 Лимонит Fe2O3* н2о бурый железняк Пирит FeS2
- 5. Сидерит (карбонат железа, железный шпат) Сидерит, добытый в Бразилии Вивиани́т (синяя земля, синяя железная болотная руда)
- 6. По запасам железных руд Россия занимает первое место в мире. Содержание железа в морской воде —
- 7. Гидротерамальные источники с железистой водой Так в Casteljaloux еще в 19-ом веке, были известны два источника
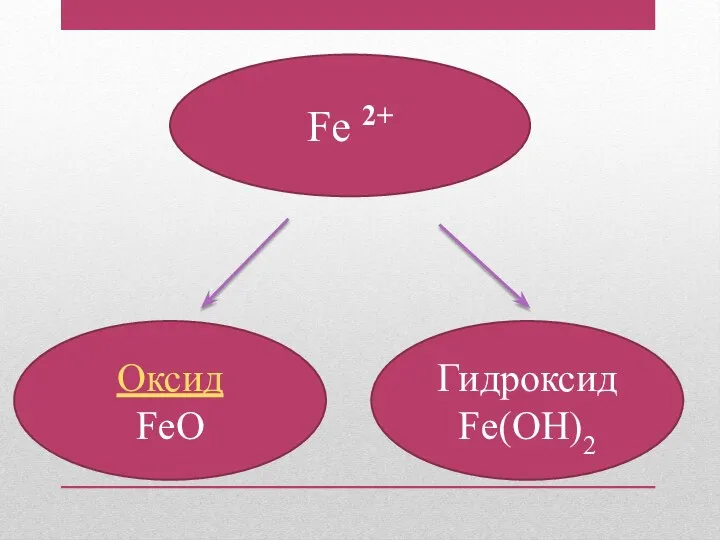
- 8. Fe 2+ Оксид FeO Гидроксид Fe(OH)2
- 9. Физические свойства Оксид железа (II) Порошок черного цвета Нерастворимый в воде Тугоплавкое (1377) Гидроксид железа (II)
- 10. Химические свойства С какими веществами реагирует оксид железа (II) ? HCl H2O NaOH Записать уравнения реакций.
- 11. Химические свойства С какими веществами реагирует гидроксид железа (II) ? NaOH H2SO4 H2O CaO AlCl3 Записать
- 12. Качественные реакции на ионы железа ( II ) Реактивом для обнаружения Fe 2+ гексацианоферрат калия (красная
- 13. Просмотр опыта https://www.youtube.com/watch?v=eEsG0t6s6Go&t=1s
- 14. Обнаружение ионов железа щелочью Реакция со щелочью – еще один способ обнаружения ионов железа ( II
- 17. Скачать презентацию













 Зелёная химия
Зелёная химия Электролитическая диссоциация
Электролитическая диссоциация Биохимия. Введение
Биохимия. Введение «Системно – деятельностный подход как механизм реализации ФГОС нового поколения» обучающий семинар МБОУ «СОШ №15», п.Аршан – 2015г
«Системно – деятельностный подход как механизм реализации ФГОС нового поколения» обучающий семинар МБОУ «СОШ №15», п.Аршан – 2015г Презентация по Химии "Прославившиеся ученые Саратовской области" - скачать смотреть
Презентация по Химии "Прославившиеся ученые Саратовской области" - скачать смотреть  Углеводы. Строение и функции
Углеводы. Строение и функции Кинетика ферментативного катализа. (Лекция 5)
Кинетика ферментативного катализа. (Лекция 5) Разноцветные кристаллы
Разноцветные кристаллы Периодическая Система Д. И. Менделеева в свете учения о строении атома
Периодическая Система Д. И. Менделеева в свете учения о строении атома Ферменты. Свойства ферментов
Ферменты. Свойства ферментов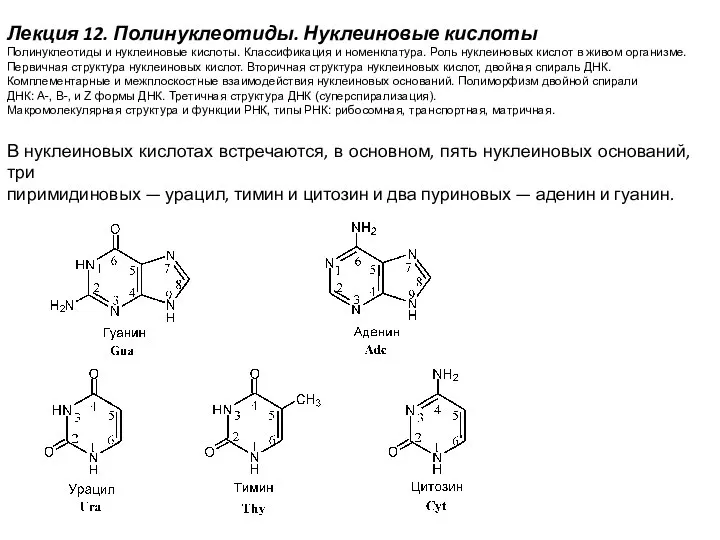 Полинуклеотиды. Нуклеиновые кислоты
Полинуклеотиды. Нуклеиновые кислоты Методи визначення питомої поверхні
Методи визначення питомої поверхні Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде
Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Химия функциональных материалов. Адсорбционные материалы. Цеолиты
Химия функциональных материалов. Адсорбционные материалы. Цеолиты Бор (Borum)
Бор (Borum) Биополимеры. Классификация полисахаридов (гликаны)
Биополимеры. Классификация полисахаридов (гликаны) Щелочные металлы — это элементы главной подгруппы I группы
Щелочные металлы — это элементы главной подгруппы I группы Воздух - источник жизни на земле. (3 класс)
Воздух - источник жизни на земле. (3 класс) Металлы в природе. Общие способы их получения.
Металлы в природе. Общие способы их получения. Задача о смесях
Задача о смесях МОЛЬ – ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 ∙1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА.
МОЛЬ – ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 ∙1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА. Индивидуальные задания для самостоятельной работы студентов нехимических специальностей
Индивидуальные задания для самостоятельной работы студентов нехимических специальностей Процессы технологии природных энергоносителей и углеродных материалов
Процессы технологии природных энергоносителей и углеродных материалов Технология поликристаллического кремния. Его применение
Технология поликристаллического кремния. Его применение Липидтер, жіктелуі (қарапайым және күрделі липидтер), қызметі, май қышқылдары
Липидтер, жіктелуі (қарапайым және күрделі липидтер), қызметі, май қышқылдары Презентация по Химии "Металлы. Типы сплавов" - скачать смотреть
Презентация по Химии "Металлы. Типы сплавов" - скачать смотреть  Скорость химических реакций Разработка урока по химии 11 класс
Скорость химических реакций Разработка урока по химии 11 класс