Соединения железа. Цель: изучение соединений железа. Задачи: исследовать свойства гидроксидов железа (II) и (III) ; научиться р
Содержание
- 2. Соединения железа. План урока. 1. Гидроксиды железа (II) и (III): получение и свойства. (Л/О). 2. Качественные
- 3. Не в количестве знаний заключается образование, а в полном понимании и искусном применении всего того, что
- 4. План урока. 1. Гидроксиды железа (II) и (III): получение и свойства. (Л/О).
- 5. Эксперимент – основа познания. Лабораторный опыт №1. Получение и изучение свойств гидроксидов железа (II) и (III).
- 6. Вывод по лабораторному опыту: Fe(OH)2 – основные свойства, взаимодействует с кислотами. Fe(OH)3 - слабовыраженные амфотерные свойства
- 7. План урока. 2. Качественные реакции на ионы Fe2+ и Fe3+. (Л/О).
- 8. «Нет искусства столь же трудного, как искусство наблюдения». Лабораторный опыт №2. Качественные реакции на ионы Fe2+
- 9. Лабораторный опыт: Качественные реакции на ионы Fe2+ и Fe3+. FeSO4 + K3 [Fe(CN)6 ] KFe +2
- 10. План урока. 3. Значение соединений железа в природе и в жизни человека (сообщение).
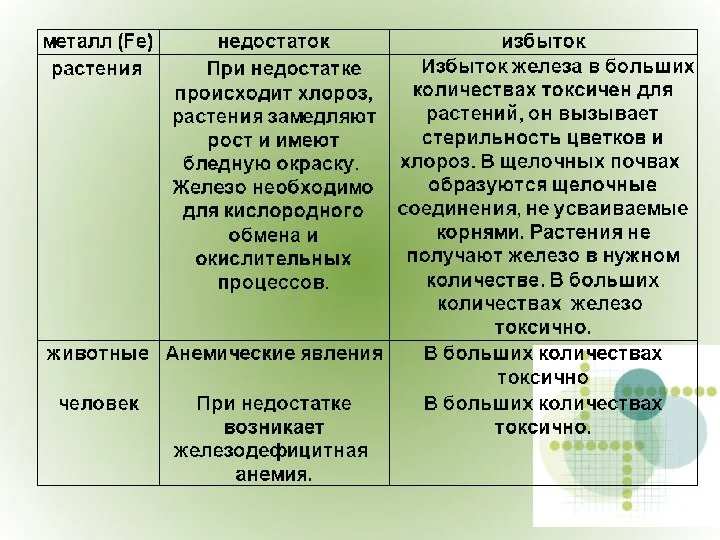
- 11. Роль cоединений железа в жизни живых организмов
- 12. Для нормального роста и выполнения биологических функций человеку и животным кроме витаминов необходим целый ряд неорганических
- 13. Значение железа для организма человека и в целом для живой природы трудно переоценить. Его биологическая ценность
- 16. В организм человека ионы железа попадают с продуктами питания, поэтому оно должно быть сбалансированным.
- 19. Следите за сбалансированностью своего питания, будьте здоровы!
- 20. План урока. 4. Исследование продуктов питания на содержание в них железа. ( исследовательская работа).
- 21. Исследовательская работа. Определение содержания железа в продуктах питания.
- 22. Цель: Обнаружение ионов железа в продуктах питания.
- 23. Оборудование: Реактивы: Штатив Пробирки Весы Горелка Ступка и пестик Колба Воронка Соляная кислота Роданид калия Дистилированная
- 24. Исследуемые продукты питания: 1) Гречка 2) Пшено 3) Мука пшеничная 4) Ржаной хлеб
- 25. Ход работы: 1. Взяла по 2.5г каждого образца продукта питания. 2. Положила их в отдельные тигли
- 26. Ход работы: 3. Измельчила золу до порошка. 4. Перенесла золу в пробирку и добавила 10мл HCI.
- 27. Ход работы: 6. собрала прибор для фильтрования. 7. профильтровала содержимое пробирок. 8. 5 мл каждого фильтрата
- 28. Ход работы: 9. К фильтратам добавила раствор роданида калия - KSCN. 10. Закрыла пробкой и интенсивно
- 29. Результаты исследования: Сравнила интенсивность цвета анализируемых растворов.
- 30. ВЫВОДЫ: 1. Все исследуемые продукты питания содержат железо. 2. Самое большое содержание железа в ржаном хлебе.
- 31. Итог урока. Изучили соединения железа: оксиды и гидроксиды (II) и (III). Соединения железа (II) проявляют основные
- 32. План урока. 5. Проверочный тест.
- 33. То, что не ясно, следует выяснить. То, что трудно творить следует делать с величайшей настойчивостью. Конфуций.
- 34. Домашнее задание: 1. параграф №14, упр. 5. 2. Решите задачи: а) В состав некоторых сортов природного
- 35. Не в количестве знаний заключается образование, а в полном понимании и искусном применении всего того, что
- 37. Скачать презентацию

































 Мыла: прошлое, настоящее, будущее
Мыла: прошлое, настоящее, будущее Презентация по Химии "Бензол" - скачать смотреть бесплатно
Презентация по Химии "Бензол" - скачать смотреть бесплатно Етанол (етиловий спирт, винний спирт)
Етанол (етиловий спирт, винний спирт) Минералы
Минералы Методические рекомендации к уроку по теме Скорость химических реакций в 11классе
Методические рекомендации к уроку по теме Скорость химических реакций в 11классе Синильная Кислота - циановодород
Синильная Кислота - циановодород Решение задач на растворы и смеси
Решение задач на растворы и смеси Фенолы и их производные
Фенолы и их производные Неотъемлемый аксессуар современного человека
Неотъемлемый аксессуар современного человека Нефть
Нефть  Презентация по Химии "Синтетические моющие средства" - скачать смотреть
Презентация по Химии "Синтетические моющие средства" - скачать смотреть  Картофельное пюре быстрого приготовления
Картофельное пюре быстрого приготовления Українські вчені-хіміки
Українські вчені-хіміки Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе
Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе Жиры. Классификация
Жиры. Классификация Химиялық байланыстың табиғаты
Химиялық байланыстың табиғаты Судың құрамы және физикалық қасиеттері
Судың құрамы және физикалық қасиеттері Марки бензина
Марки бензина Соли в природе. Реакции с участием солей. Модуль 2. Лекция 2.1
Соли в природе. Реакции с участием солей. Модуль 2. Лекция 2.1 Химия в сельском хозяйстве
Химия в сельском хозяйстве Битумы и материалы на основе битумов
Битумы и материалы на основе битумов Природный и синтетический каучуки
Природный и синтетический каучуки Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Презентация по Химии "Уравнение Менделеева - Клапейрона" - скачать смотреть
Презентация по Химии "Уравнение Менделеева - Клапейрона" - скачать смотреть  Химия вокруг нас
Химия вокруг нас Омыляемые Липиды
Омыляемые Липиды Группа рассеянных химических элементов
Группа рассеянных химических элементов Сера
Сера