Содержание
- 2. основа бизнеса - стремление сделать используемые материалы одновременно лучше и дешевле. дополнительно - сделать их безопаснее
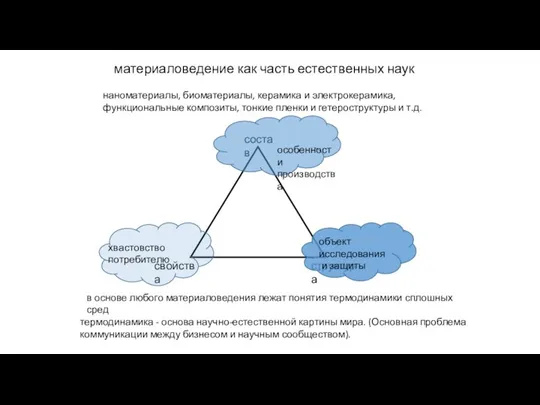
- 3. материаловедение как часть естественных наук наноматериалы, биоматериалы, керамика и электрокерамика, функциональные композиты, тонкие пленки и гетероструктуры
- 4. набор определений - определение фазы 1. Термодинамическая система - макроскопическая система находящаяся в термодинамическом равновесии. 2.
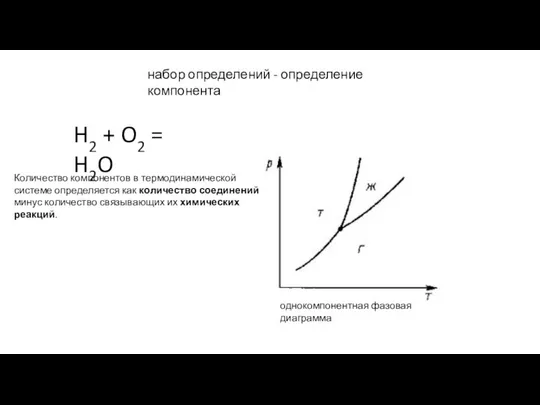
- 5. набор определений - определение компонента H2 + O2 = H2O Количество компонентов в термодинамической системе определяется
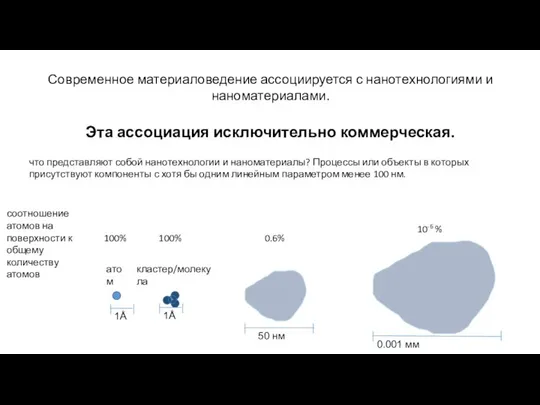
- 6. Современное материаловедение ассоциируется с нанотехнологиями и наноматериалами. Эта ассоциация исключительно коммерческая. что представляют собой нанотехнологии и
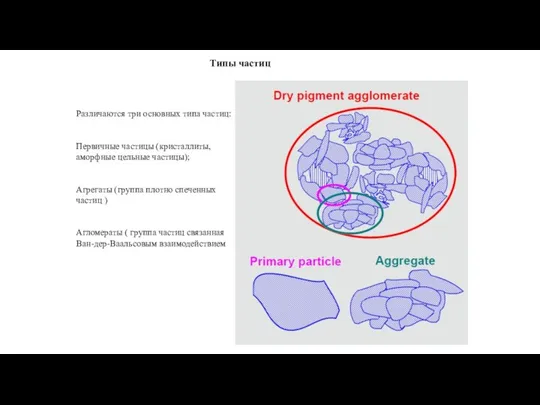
- 7. Типы частиц Различаются три основных типа частиц: Первичные частицы (кристаллиты, аморфные цельные частицы); Агрегаты (группа плотно
- 8. Некоторые понятия коллоидной химии Предмет коллоидной химии Дисперсные двух и более компонентные системы Межфазные границы, взаимодействие
- 9. Дисперсность частиц Мера дисперсности диаметр сферической частицы, ребро куба кубической частицы Степень дисперсности величина обратная диаметру
- 10. Термодинамическое обоснование неустойчивости коллоидных систем Определение свободной поверхностной энергии – избыточная свободная энергия Гиббса пропорциональная площади
- 11. Понятие поверхности физического разрыва Связь свободной энергии, изобарно-изотермического потенциала и химического потенциала Изменение плотности свободной энергии
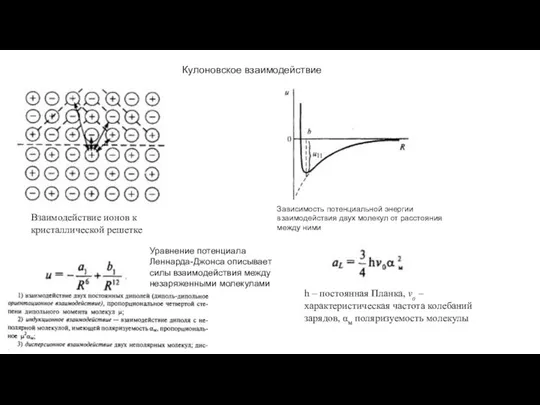
- 12. Зависимость потенциальной энергии взаимодействия двух молекул от расстояния между ними Уравнение потенциала Леннарда-Джонса описывает силы взаимодействия
- 13. Дисперсионное взаимодействие молекул в конденсированных средах Суммирование дисперсионных молекулярных взаимодействий по Гамакеру и Де-Буру Энергия взаимодействия
- 14. Граница раздела фаз для твердых тел а) межзеренная граница при малой разориентации, б) зависимость свободной поверхностной
- 15. Энергия границы раздела двухкомпонентных систем Рассматриваем случай двух поверхностей твердых фаз. Энергия адгезии, определяется как работа
- 16. Взаимодействие жидкости и твердой частицы Равновесный двугранный угол при образовании канавки травления Образование прослойки жидкости между
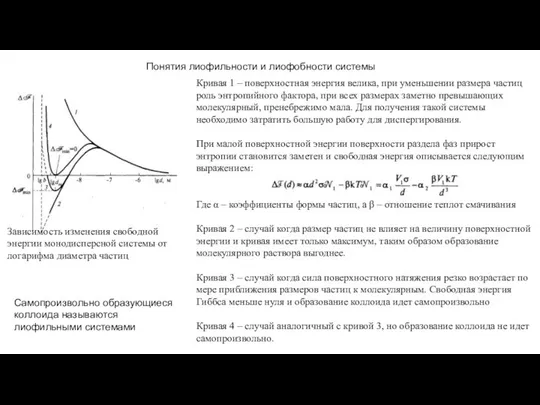
- 17. Понятия лиофильности и лиофобности системы Зависимость изменения свободной энергии монодисперсной системы от логарифма диаметра частиц Кривая
- 18. Образование лиофильных и лиофобных систем Критерий Ребиндера-Щукина условие самопроизвольного диспергирования макрофазы При достаточно низких но положительных
- 20. Скачать презентацию











 Эндогенная серия. Магматическая группа
Эндогенная серия. Магматическая группа Конкурс проектных работ «Химический элемент … – и это все о нем»
Конкурс проектных работ «Химический элемент … – и это все о нем» Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу
Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу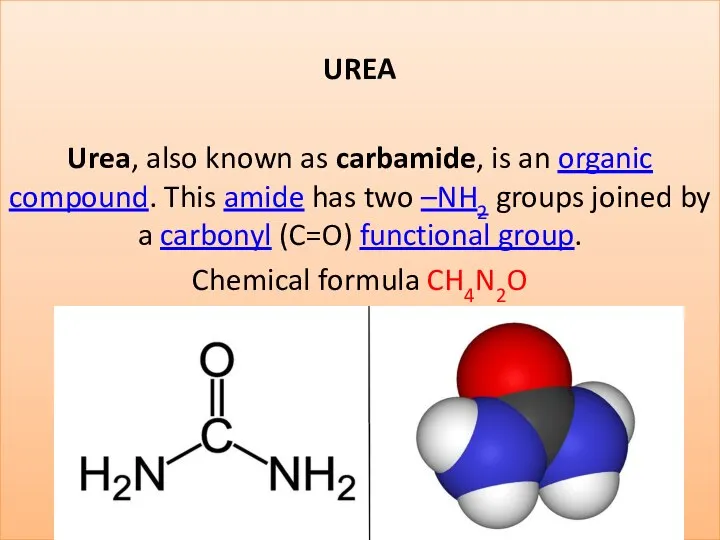 Urea (carbamide)
Urea (carbamide) Процессы минералообразования
Процессы минералообразования Предельные одноатомные спирты
Предельные одноатомные спирты  Занимательные опыты по химии
Занимательные опыты по химии Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама
Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2)
Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2) Дифференциация магмы
Дифференциация магмы Элементы кристаллохимии
Элементы кристаллохимии Основные объекты исследования биофизики клеточных и мембранных процессов. Лекция 3-1
Основные объекты исследования биофизики клеточных и мембранных процессов. Лекция 3-1 “B” (бор) как химический элемент
“B” (бор) как химический элемент Металлы в природе
Металлы в природе Сравнительная характеристика бензольного кольца и олимпийских колец
Сравнительная характеристика бензольного кольца и олимпийских колец Термохимия. Расчетные задачи. (Лекция 4.2)
Термохимия. Расчетные задачи. (Лекция 4.2)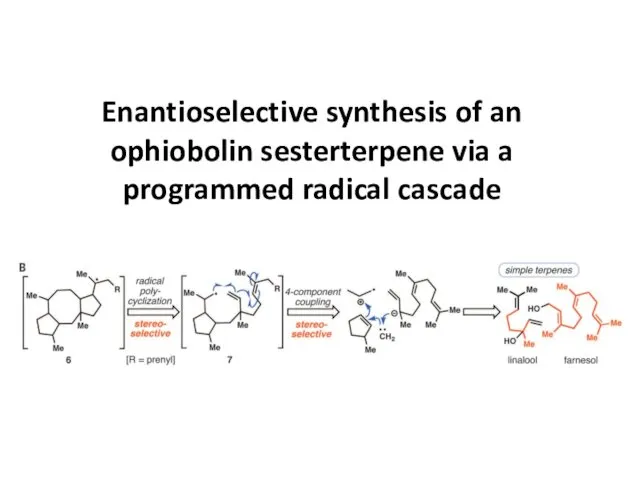 Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade
Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade Металлы и их соединения
Металлы и их соединения Введение в термические процессы вторичной переработки нефти
Введение в термические процессы вторичной переработки нефти Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль
Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль Жидкостная хроматография
Жидкостная хроматография Презентация по Химии "Тайна Е-621" - скачать смотреть
Презентация по Химии "Тайна Е-621" - скачать смотреть  Методические рекомендации по изучению курса «Коррозия и защита металлов»
Методические рекомендации по изучению курса «Коррозия и защита металлов» Применение этанола
Применение этанола Электропроводность растворов электролитов. Числа переноса
Электропроводность растворов электролитов. Числа переноса Етери. Ізомерія та номенклатура
Етери. Ізомерія та номенклатура Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы
Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы Презентация по Химии "Галогены" - скачать смотреть
Презентация по Химии "Галогены" - скачать смотреть