Содержание
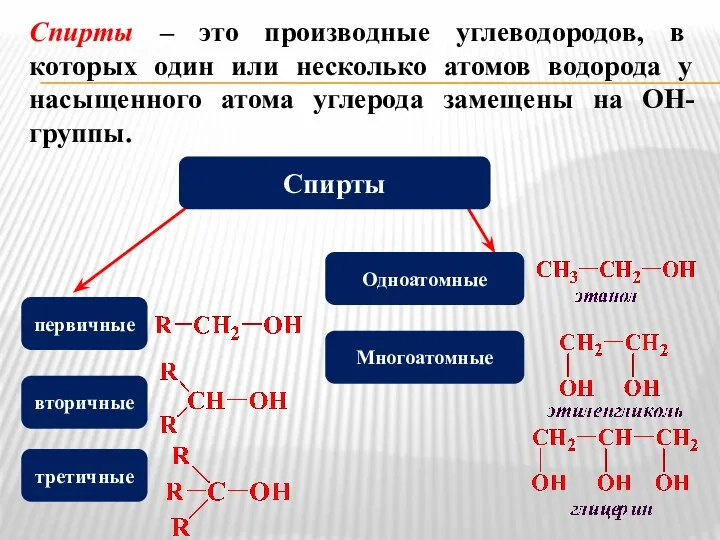
- 2. Спирты – это производные углеводородов, в которых один или несколько атомов водорода у насыщенного атома углерода
- 3. Способы получения одноатомных спиртов Гидратация алкенов Щелочной гидролиз галогенпроизводных Восстановление карбонильных соединений
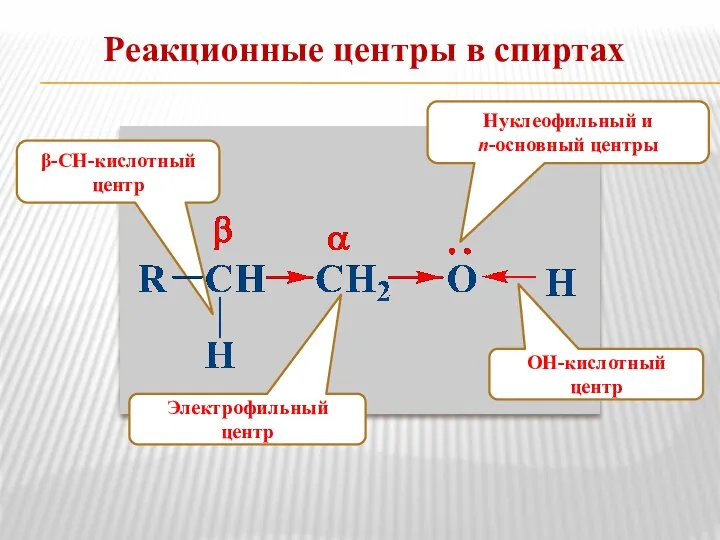
- 4. Реакционные центры в спиртах Электрофильный центр β-СН-кислотный центр ОН-кислотный центр Нуклеофильный и n-основный центры
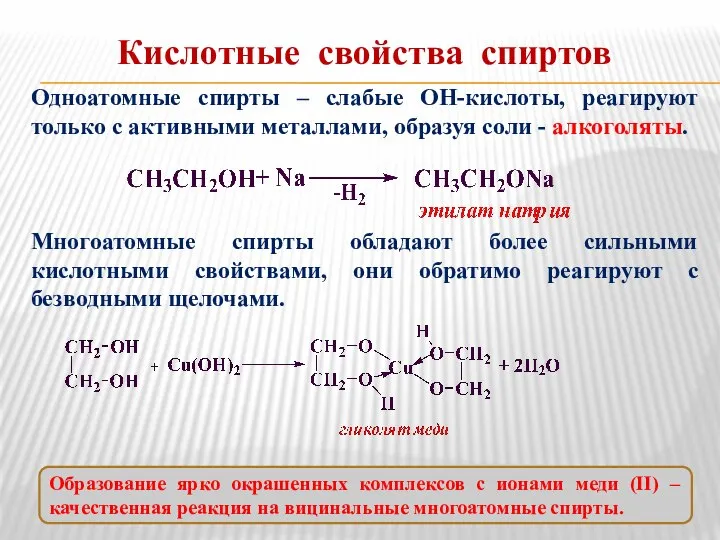
- 5. Кислотные свойства спиртов Одноатомные спирты – слабые ОН-кислоты, реагируют только с активными металлами, образуя соли -
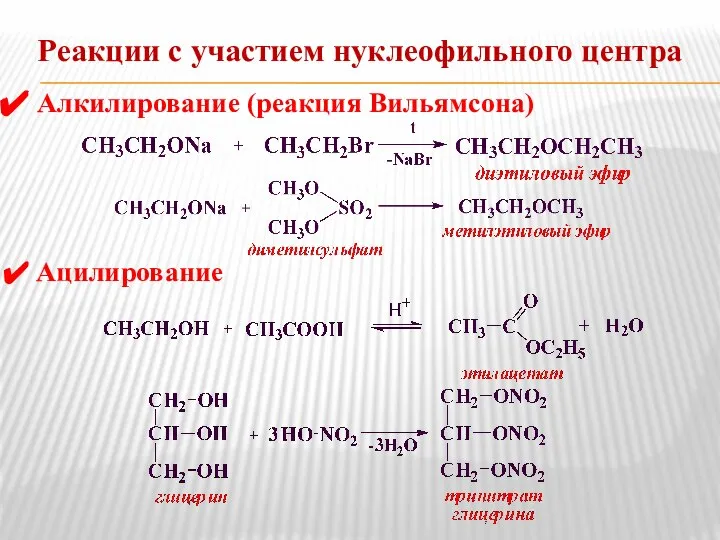
- 6. Реакции с участием нуклеофильного центра Алкилирование (реакция Вильямсона) Ацилирование
- 7. Реакции с участием электрофильного центра ОН-группа является плохо уходящей группой, поэтому , чтобы ее заместить, необходимо
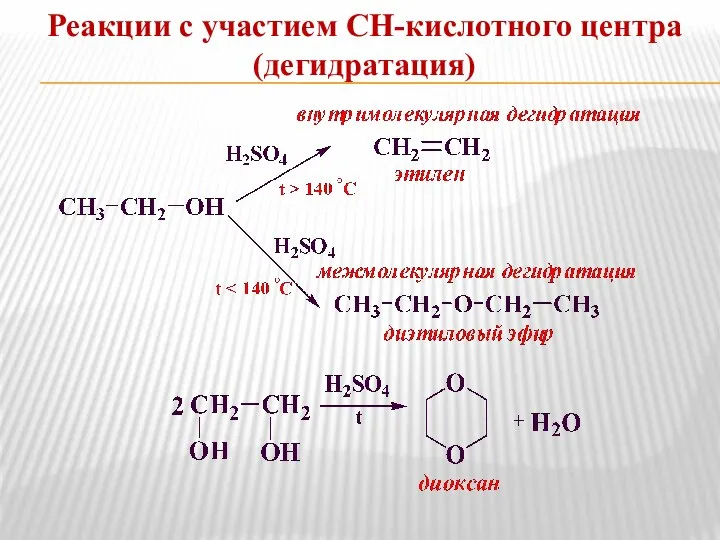
- 8. Реакции с участием СН-кислотного центра (дегидратация)
- 9. Окисление спиртов Первичные спирты окисляются до альдегидов, а затем – до карбоновых кислот Вторичные спирты окисляются
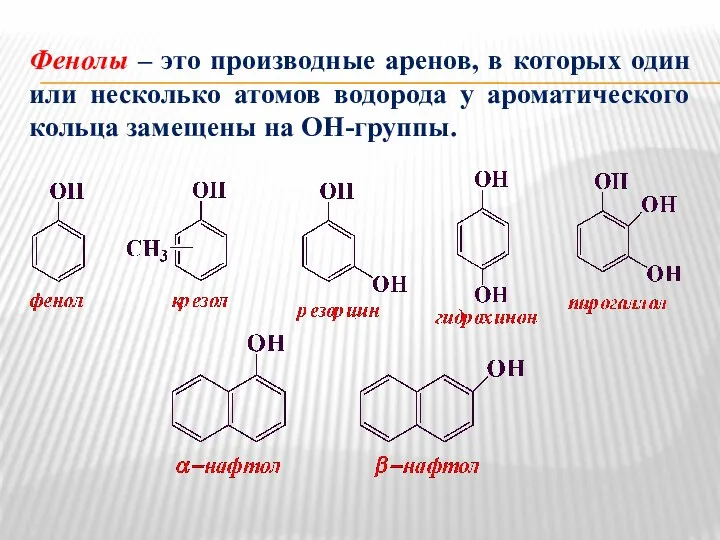
- 10. Фенолы – это производные аренов, в которых один или несколько атомов водорода у ароматического кольца замещены
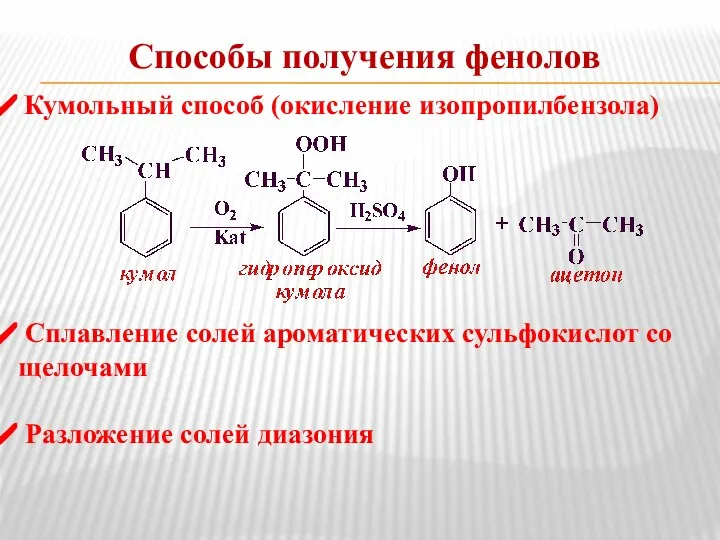
- 11. Способы получения фенолов Кумольный способ (окисление изопропилбензола) Сплавление солей ароматических сульфокислот со щелочами Разложение солей диазония
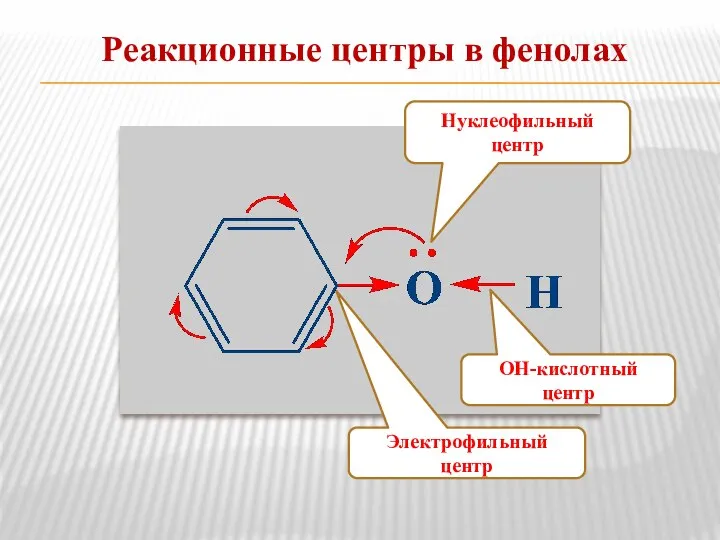
- 12. Реакционные центры в фенолах Электрофильный центр ОН-кислотный центр Нуклеофильный центр
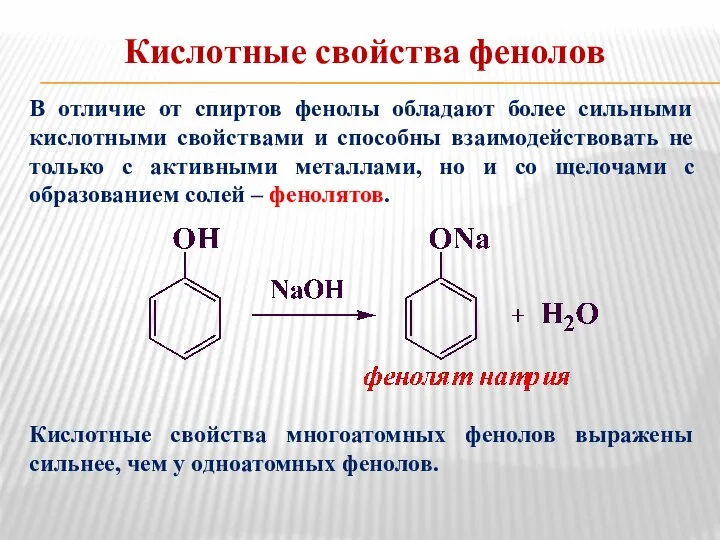
- 13. Кислотные свойства фенолов В отличие от спиртов фенолы обладают более сильными кислотными свойствами и способны взаимодействовать
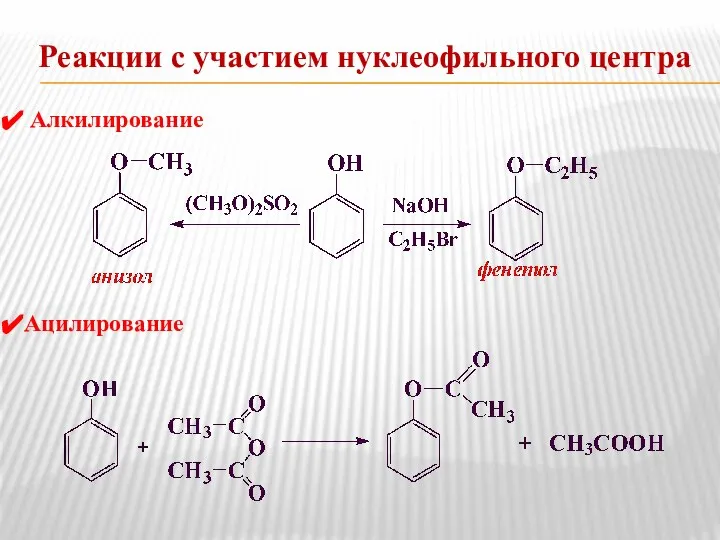
- 14. Реакции с участием нуклеофильного центра Алкилирование Ацилирование
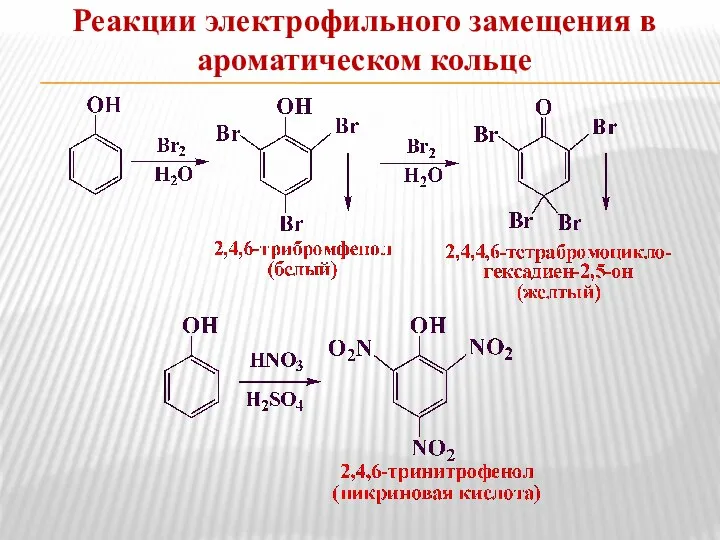
- 15. Реакции электрофильного замещения в ароматическом кольце
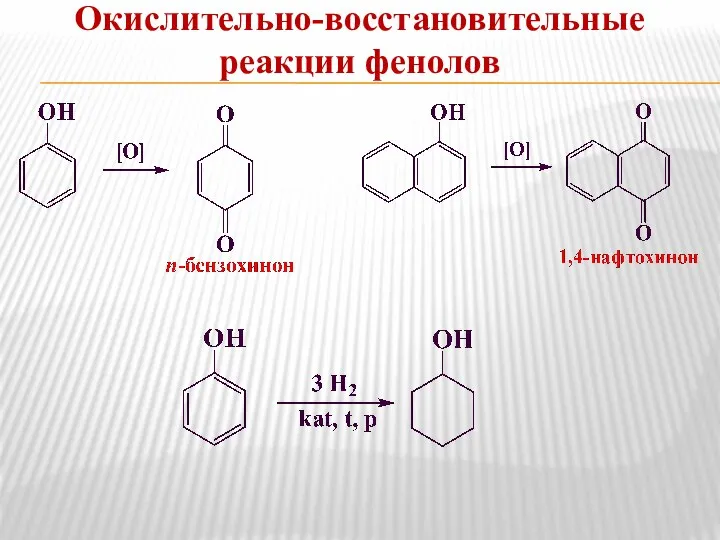
- 16. Окислительно-восстановительные реакции фенолов
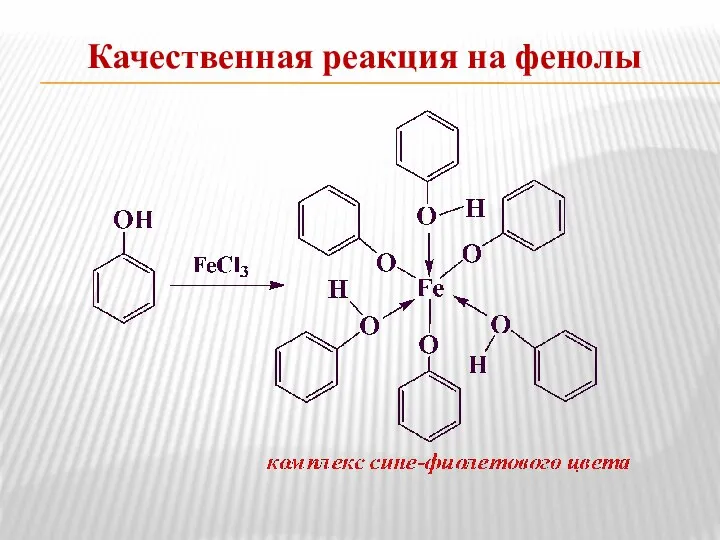
- 17. Качественная реакция на фенолы
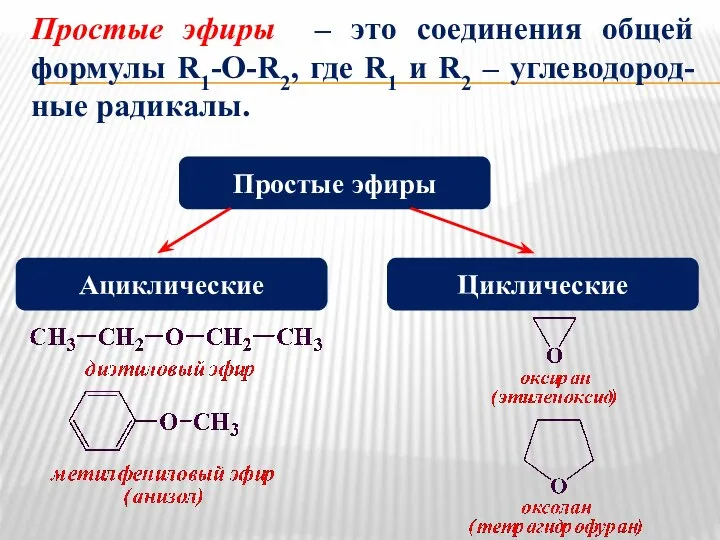
- 18. Простые эфиры – это соединения общей формулы R1-O-R2, где R1 и R2 – углеводород-ные радикалы. Простые
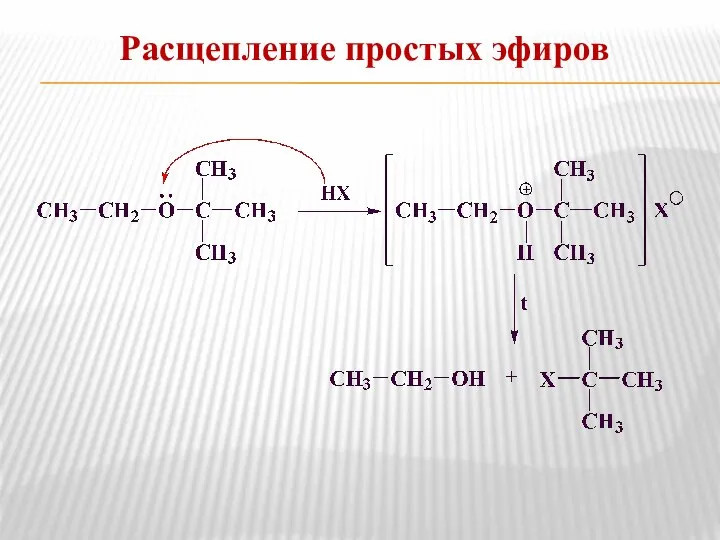
- 19. Расщепление простых эфиров
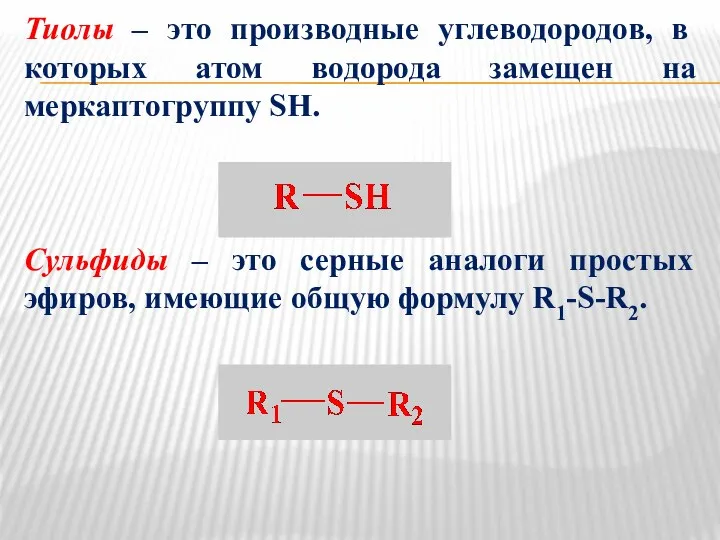
- 20. Тиолы – это производные углеводородов, в которых атом водорода замещен на меркаптогруппу SH. Сульфиды – это
- 21. Кислотные свойства тиолов Тиолы обладают повышенной кислотностью по сравнению со спиртами, реагируют как с активными металлами,
- 23. Скачать презентацию




 Гума
Гума  Презентация по Химии "Строение атома" - скачать смотреть бесплатно_
Презентация по Химии "Строение атома" - скачать смотреть бесплатно_ Презентация по Химии "Вода – это жизнь" - скачать смотреть
Презентация по Химии "Вода – это жизнь" - скачать смотреть  Формирование химического состава подземных вод
Формирование химического состава подземных вод Области применения спиртов
Области применения спиртов Дезактивація радіаційних речовин у зоні ядерного ураження
Дезактивація радіаційних речовин у зоні ядерного ураження Правила оформления лабораторных работ
Правила оформления лабораторных работ Карбонат калия K2CO3
Карбонат калия K2CO3 Химия в рисунках или эта удивительная химия Материал подготовила учитель высшей категории МОУ «Травниковская СОШ» Тутукова Е.Л
Химия в рисунках или эта удивительная химия Материал подготовила учитель высшей категории МОУ «Травниковская СОШ» Тутукова Е.Л Основания. Гидроксид аммония-NH₃·H₂O
Основания. Гидроксид аммония-NH₃·H₂O Синтез высокооктановых компонентов топлива
Синтез высокооктановых компонентов топлива Волокна підготував учень 11 класу :
Волокна підготував учень 11 класу :  ГИДРОЛИЗ ГИДРОЛИЗ ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
ГИДРОЛИЗ ГИДРОЛИЗ ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ Презентація з хімії на тему: “Захист довкілля від забруднення шкідливих мійних засобів» учениці 7(11)Б класу Одеського НВК №13 Бургелі Наталії
Презентація з хімії на тему: “Захист довкілля від забруднення шкідливих мійних засобів» учениці 7(11)Б класу Одеського НВК №13 Бургелі Наталії  Средства для борьбы с бытовыми насекомыми
Средства для борьбы с бытовыми насекомыми Физические свойства металлов
Физические свойства металлов Презентация по Химии "История открытия периодического закона и его экспериментальное подтверждение" - скачать смотреть
Презентация по Химии "История открытия периодического закона и его экспериментальное подтверждение" - скачать смотреть  Муниципальное общеобразовательное учреждение «Итатская СОШ №2 с.Томское» Томский район Как больше и дешевле получать кисл
Муниципальное общеобразовательное учреждение «Итатская СОШ №2 с.Томское» Томский район Как больше и дешевле получать кисл Группа веществ, изолируемых из объектов путём минерализации биологического материала (Продолжение)
Группа веществ, изолируемых из объектов путём минерализации биологического материала (Продолжение) Увеличение плотности дислокаций
Увеличение плотности дислокаций Образовательная программа дополнительного образования Химия в центре наук
Образовательная программа дополнительного образования Химия в центре наук The application nanotechnology in chemistry
The application nanotechnology in chemistry Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы
Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы Роль хімії в сучасному житті
Роль хімії в сучасному житті Типы изомерии
Типы изомерии Типы химических реакций в органической химии
Типы химических реакций в органической химии Дать характеристику новому классу органических веществ
Дать характеристику новому классу органических веществ