Содержание
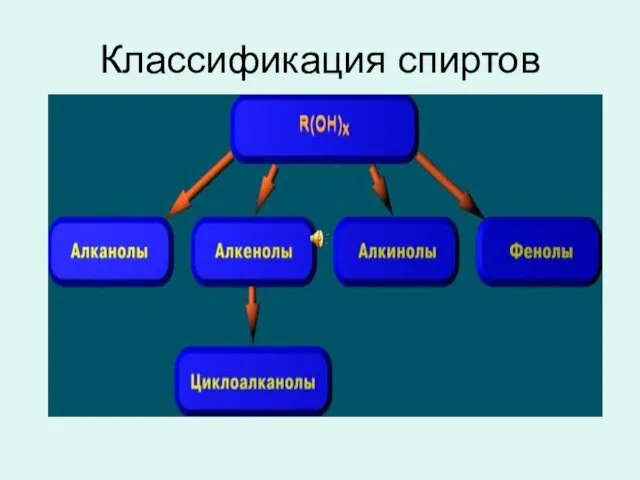
- 2. Классификация спиртов
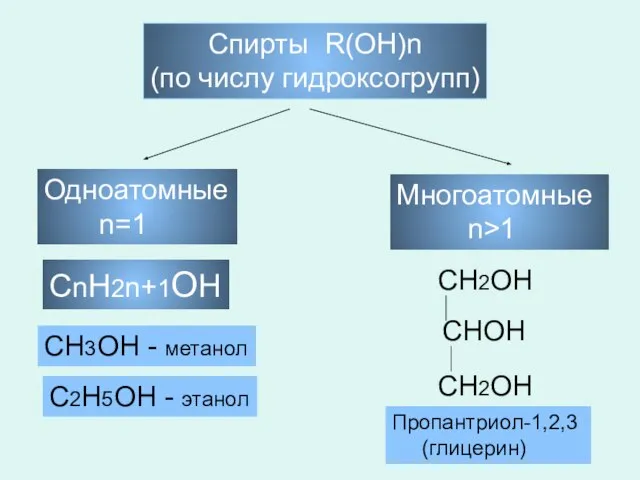
- 3. Спирты R(OH)n (по числу гидроксогрупп) Одноатомные n=1 Многоатомные n>1 СnH2n+1OH СH3OH - метанол С2H5OH - этанол
- 4. Изомерия спиртов Изомерия углеродного скелета: бутанол-1 и метилпропанол-1 Изомерия положения функциональной группы: бутанол-1 и бутанол-2 Межклассовая
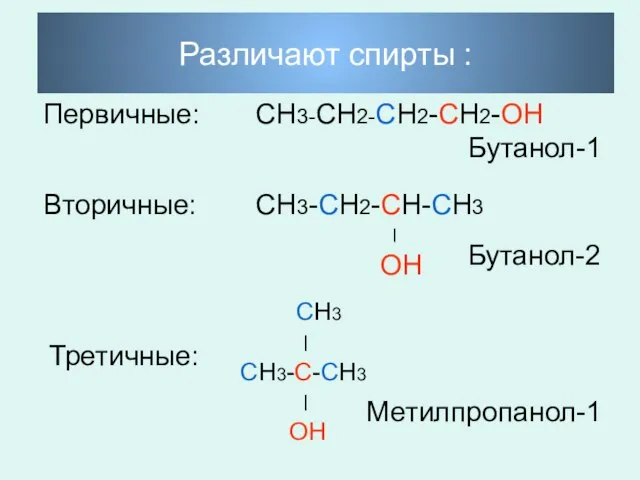
- 5. Различают спирты : Первичные: СН3-СН2-СН2-СН2-ОН Бутанол-1 Вторичные: СН3-СН2-СН-СН3 ׀ ОН Бутанол-2 Третичные: СН3 ׀ СН3-С-СН3 ׀
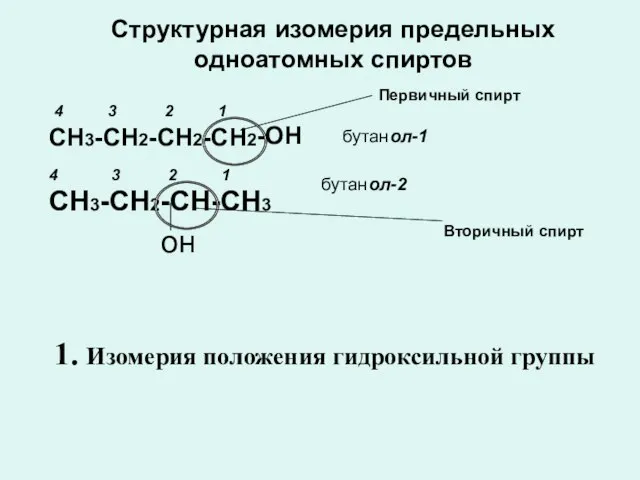
- 6. Структурная изомерия предельных одноатомных спиртов ол-1 СН3-СН2-СН2-СН2 4 3 2 1 бутан он бутан ол-2 4
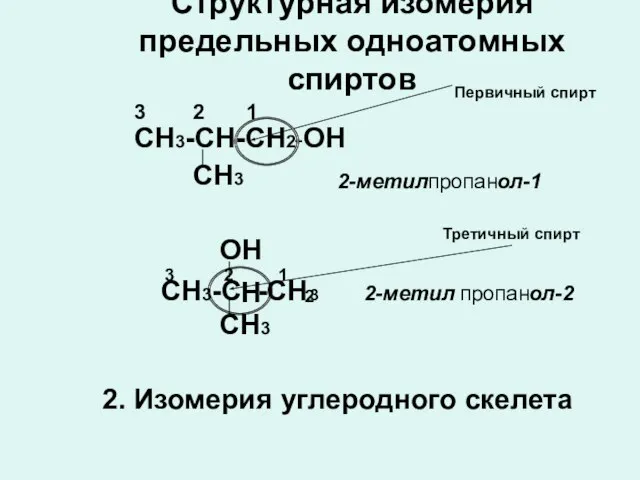
- 7. Структурная изомерия предельных одноатомных спиртов СН3 2-метил пропан -ОН 3 2 1 СН3-СН-СН2 ол-1 СН3-С -СН
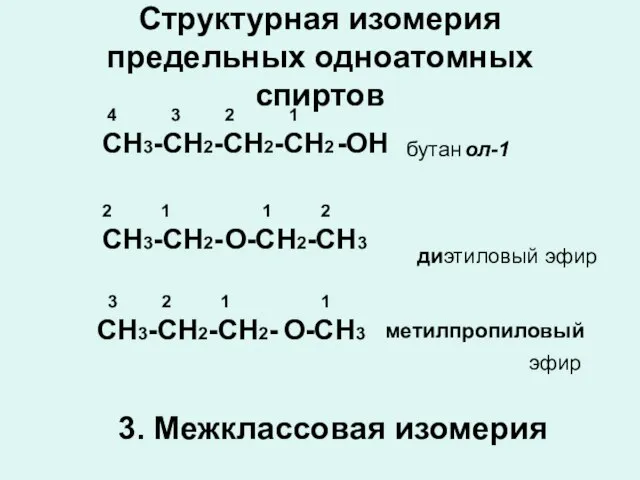
- 8. Структурная изомерия предельных одноатомных спиртов СН3-СН2-СН2-СН2 -ОН бутан ол-1 СН3-СН2- О -СН2-СН3 ди этиловый 4 3
- 9. Физические свойства спиртов
- 10. Физические свойства спиртов Растворимость спиртов Спирт как растворитель
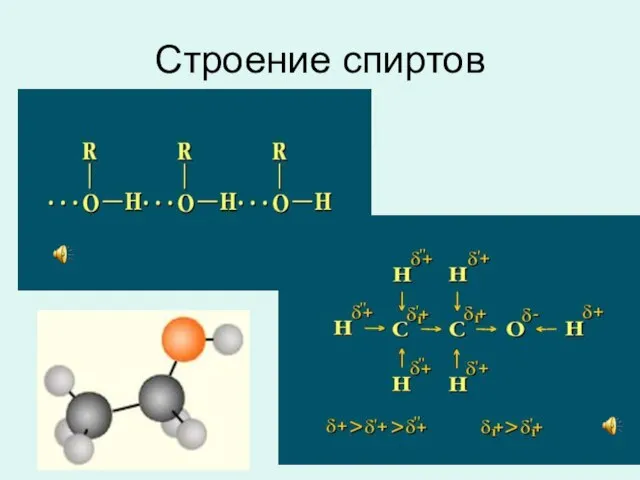
- 11. Строение спиртов
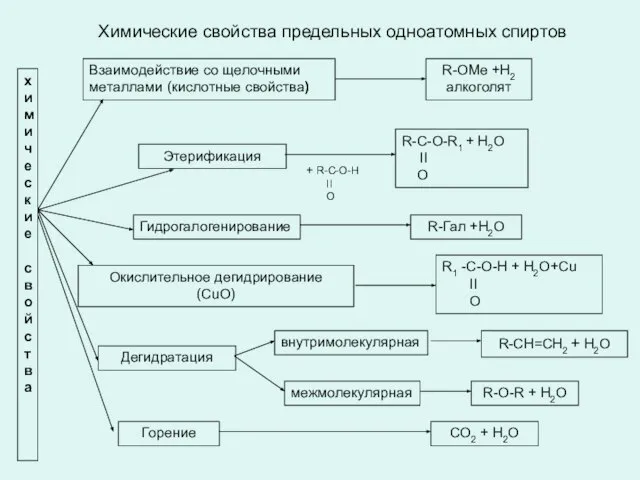
- 12. Химические свойства предельных одноатомных спиртов х и м и ч е с к и е с
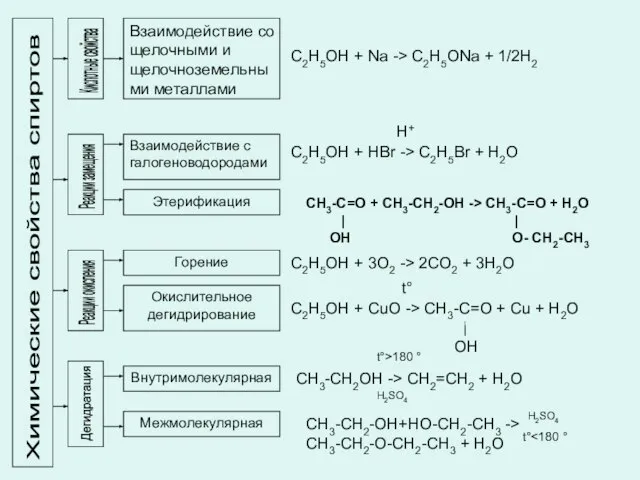
- 13. Химические свойства спиртов Кислотные свойства Взаимодействие со щелочными и щелочноземельными металлами Реакции замещения Взаимодействие с галогеноводородами
- 14. Получение спиртов 1.Гидратация алкенов в кислой среде: R-CH=CH2 + H2O → R-CH(OH)CH3 ( по правилу Марковникова)
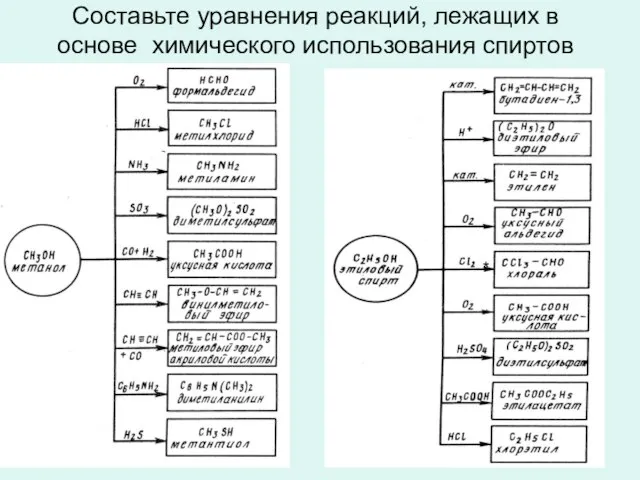
- 15. Составьте уравнения реакций, лежащих в основе химического использования спиртов *
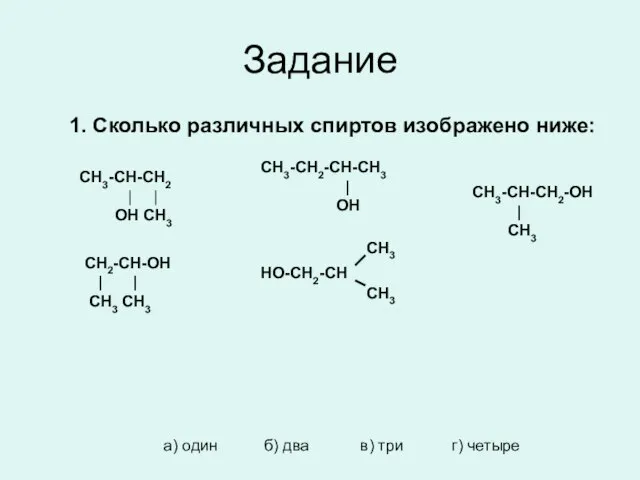
- 16. Задание 1. Сколько различных спиртов изображено ниже: CH3-CH-CH2 | | OH CH3 CH3-CH2-CH-CH3 | OH CH3-CH-CH2-OH
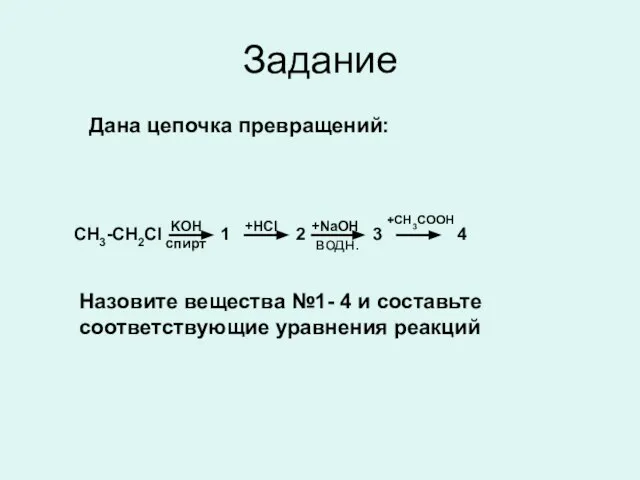
- 17. Задание Дана цепочка превращений: KOH спирт CH3-CH2Cl +HCl 1 +NaOH 2 +CH3COOH 3 4 Назовите вещества
- 18. О каком органическом веществе идет речь, если при сжигании 1,2 г его выделилось 1,344 л оксида
- 19. Решение 1,2 г 1,344 л 1,44 г СХНУ + О2 → хСО2 + у/2Н2О М=D(Н2)*2=30*2=60 г/моль
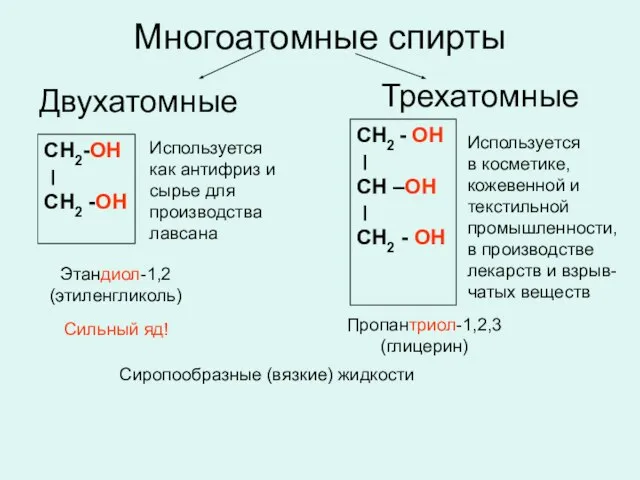
- 20. Многоатомные спирты СН2-ОН ׀ СН2 -ОН Этандиол-1,2 (этиленгликоль) СН2 - ОН ׀ СН –ОН ׀ СН2
- 21. Химические свойства многоатомных спиртов Составьте соответствующее уравнение реакции.
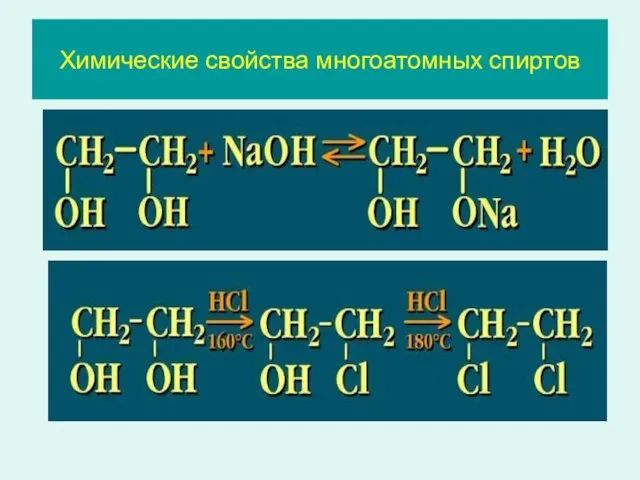
- 22. Химические свойства многоатомных спиртов
- 23. Химические свойства многоатомных спиртов
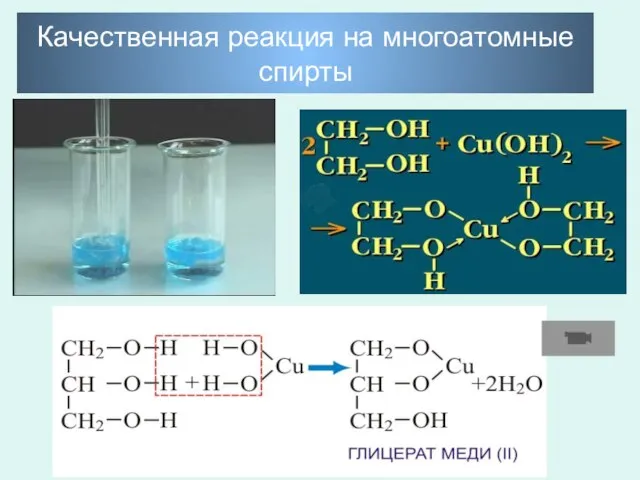
- 24. Качественная реакция на многоатомные спирты
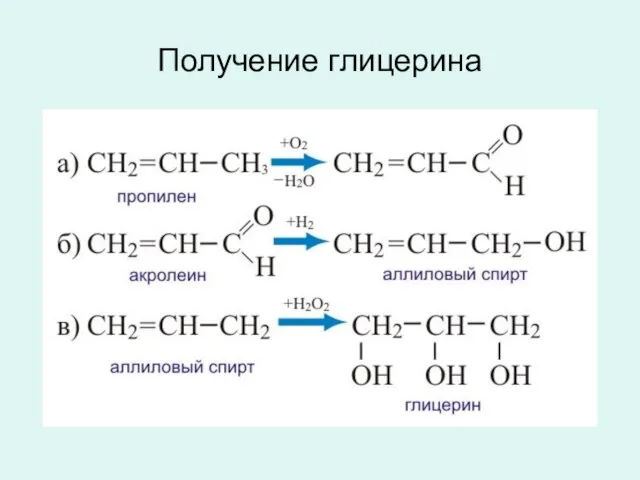
- 25. Получение глицерина
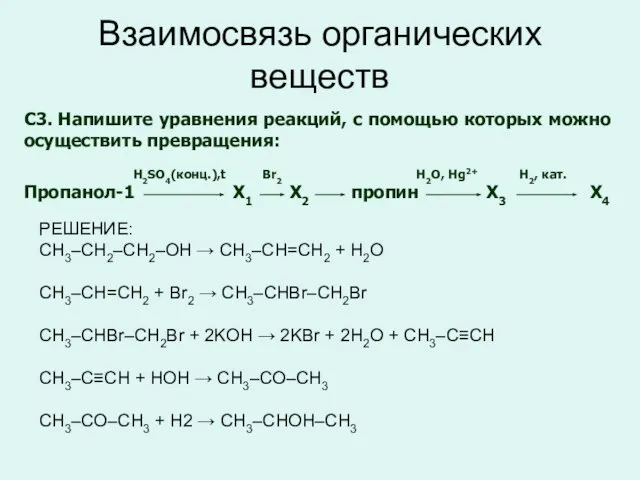
- 26. Взаимосвязь органических веществ C3. Напишите уравнения реакций, с помощью которых можно осуществить превращения: H2SO4(конц.),t Br2 H2O,
- 27. “Всё есть яд! Всё есть лекарство Всё дело в дозе” Топливо Растворитель Лекарственные препараты Лаки, краски
- 28. Физиологическое действие спиртов
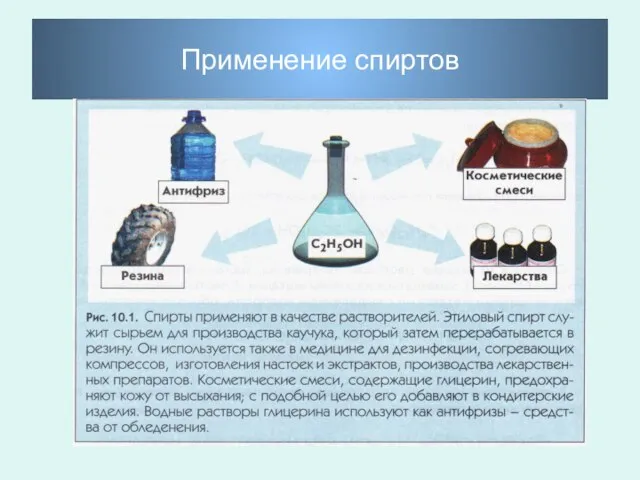
- 29. Применение спиртов
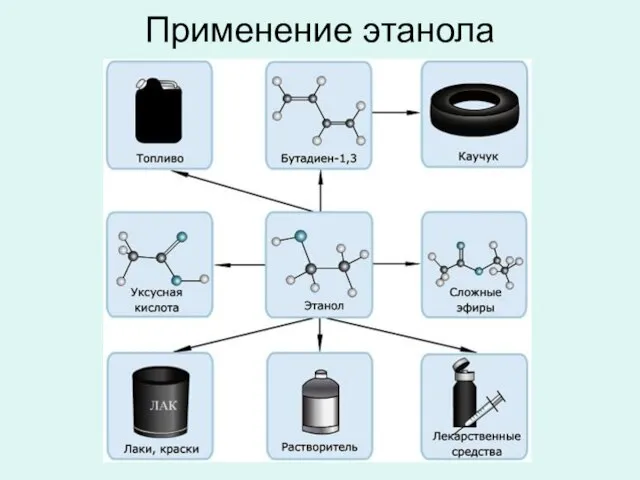
- 30. Применение этанола
- 35. Скачать презентацию












 Презентация Вещества и их свойства
Презентация Вещества и их свойства Ароматические углеводороды, строение, изомерия, номенклатура
Ароматические углеводороды, строение, изомерия, номенклатура Коллоидная химия наночастиц
Коллоидная химия наночастиц Тотығутотықсыздану титрлеу әдістері. Дәріс № 7
Тотығутотықсыздану титрлеу әдістері. Дәріс № 7 Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Металлические стёкла (аморфные металлы)
Металлические стёкла (аморфные металлы) Химическая связь
Химическая связь Пентозофосфатный цикл
Пентозофосфатный цикл Природный и синтетический каучуки
Природный и синтетический каучуки Интеллектуальная игра «Брейн-ринг
Интеллектуальная игра «Брейн-ринг Зависимость знака заряда белка от pH
Зависимость знака заряда белка от pH Генетическая связь между классами веществ
Генетическая связь между классами веществ Аммиак. Строение атома азота
Аммиак. Строение атома азота Кислота
Кислота ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ
ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ  Презентация по Химии "«Основания»" - скачать смотреть
Презентация по Химии "«Основания»" - скачать смотреть  Концентрация кобальта
Концентрация кобальта Открытие водорода
Открытие водорода Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Производство бензина
Производство бензина L’introduction a la biochimie. La structure et les proprietes des proteines
L’introduction a la biochimie. La structure et les proprietes des proteines Презентация по Химии "Биополимеры" - скачать смотреть
Презентация по Химии "Биополимеры" - скачать смотреть  The way to prepare gold clusters - Every atom makes a difference
The way to prepare gold clusters - Every atom makes a difference Природні гази
Природні гази Электрохимическая коррозия.
Электрохимическая коррозия. «Предмет органической химии. Особенности органических веществ». По учебнику О. С. Габриеляна. 9 класс
«Предмет органической химии. Особенности органических веществ». По учебнику О. С. Габриеляна. 9 класс Хром. Основні характеристики
Хром. Основні характеристики Моделирование процесса приготовления раствора уксусной кислоты различной концентрации
Моделирование процесса приготовления раствора уксусной кислоты различной концентрации